一种利用纯培养藻株制备浮游植物光合色素标准品的方法研究
李家园,胡 俊,侯建军*,周 婷,郑和龙,刘细霞,毕永红(. 湖北师范学院 生命科学学院,湖北 黄石 4500;. 华东师范大学 河口海岸学国家重点实验室,上海 0006;. 中国科学院 水生生物研究所,湖北 武汉 40070)
一种利用纯培养藻株制备浮游植物光合色素标准品的方法研究
李家园1,胡俊2,侯建军*1,周婷1,郑和龙1,刘细霞1,毕永红3
(1. 湖北师范学院 生命科学学院,湖北 黄石 435002;2. 华东师范大学 河口海岸学国家重点实验室,上海 200062;3. 中国科学院 水生生物研究所,湖北 武汉 430070)
浮游植物色素组成分析可间接反映野外样品中浮游植物的相对丰度和组成。然而由于色素标准品的获得较为困难,制约了该方法的广泛应用。本研究开发了一种利用纯培养藻株制备浮游植物光合色素标准品的方法,包括Chlorophyll a、Chlorophyll b、Fucoxanthin、Lutein、Zeaxanthin、Alloxanthin、N eoxanthin、Violaxanthin、Peridinin。每种浮游植物均有其特征的的色素组成,提取纯培养藻株的色素,用液相色谱分离,通过比较各色素的出峰时间和吸收光谱,对色素进行定性分析。之后通过馏分收集获得各种色素的标准品,并用分光光度法确定各色素分离液的浓度。液相色谱分析结果显示各色素标准品纯度均在99%以上,各色素标准品的响应因子与购买的光合色素标准品有很好的相关性。
纯培养藻株;高效液相色谱;色素分离;定量;标准品
浮游植物的化学分类需要有合适的生物标志物以及强有力的分析手段,Jeffrey[1]和Hallegraeff[2]等人先后意识到不同的光合色素及其组成具有浮游植物分类学意义。高效液相色谱法的发展可以完成浮游植物光合色素定性、定量分析工作,但是浮游植物光合色素种类繁多,藻细胞的光合色素组成非常复杂。因此,浮游植物光合色素研究的定性、定量工作较为困难,其中用于光合色素分析的定量标准品的获得就是主要困难之一[3]。淡水水体中常见的浮游植物类型有蓝藻、金藻、隐藻和甲藻等,各类型的色素组成如表1所示。

表1 单种藻及含有色素种类
不同门类的浮游植物有其特征的光合色素组成,自然水体中浮游植物色素组成可间接反映野外样品中浮游植物的组成和相对丰度。目前,叶绿素 a (Chlorophyll a)、叶绿素 b (Chlorophyll b)及β胡萝卜素(β -carotene)等可以从Sigma-Aldrich公司购得,玉米黄素(Zeaxanthin)和叶黄素 (Lutein)可以从Roth化学试剂公司购买,但其种类不全,提供的光合色素标准品有限,往往难以满足对水体中浮游植物光合色素的定性、定量需求。虽然丹麦DHI-14C公司提供了种类较全的光合色素标准品,但其量甚少(每瓶2.5ml),浓度也不够高。当环境中浮游植物生物量高,特别是在水华状态下,样品中的光合色素浓度落于工作曲线之外。另外,这些标准品是以有机溶剂的液态形式存在,由于溶剂的挥发以及色素的降解等因素,拆封后需立即使用。若想拆封保存一段时间后继续使用,需要确定标准品是否降解,并采用分光光度法重新进行浓度标定[4]。相对其昂贵的价格,这不是经济和方便的选择。因此,本研究探索了以实验室培养的单种藻为材料,采用高效液相色谱进行了单种光合色素的分离、纯化,并采用分光光度法对其浓度进行了标定,获得了9种光合色素标准品,旨在为光合色素的化学分类法研究提供借鉴与参考。
1 材料与方法
1.1单种藻的培养
本实验所用藻类选取了淡水水体中常见的5个门类的六种淡水藻,藻种的详细信息见表2,均由中国科学院淡水藻种库提供。单种藻的培养条件为:光照强度为 1000-4000 lux, 温度为 25℃,培养基分别为BG11、CSI、BBM、119、AF-6。
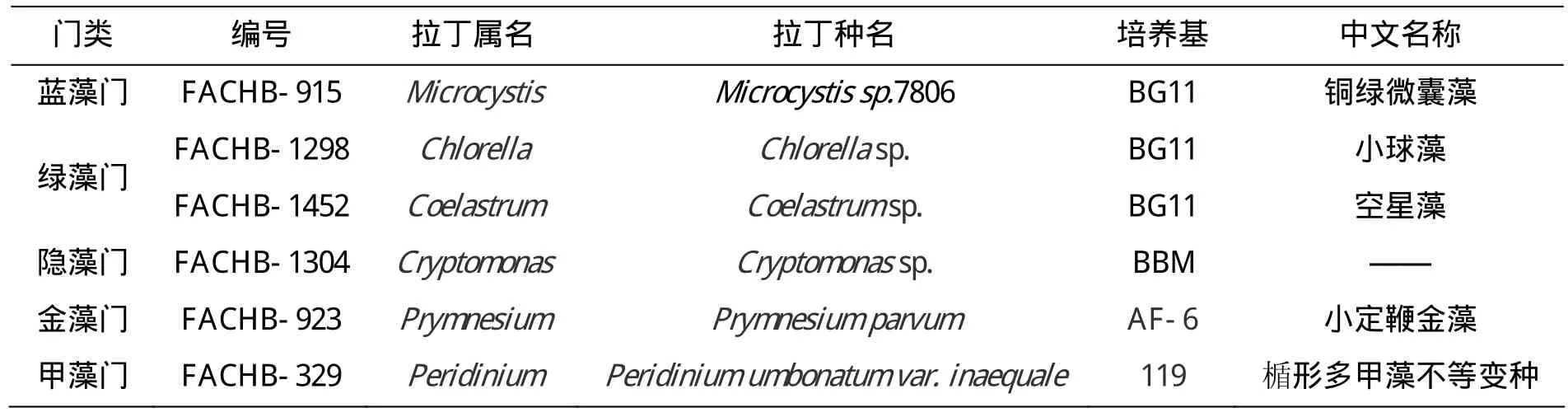
表2 单种藻种类信息
1.2藻类光合色素的提取
取处于对数生长期的藻液100mL,用4000~6000rpm/5min离心的方法浓缩收集于离心管中,将上清液的多余水分弃去,加入预冷至0~4℃的二甲基甲酰胺,振荡摇匀后置于-10℃~ -20℃温度下,抽提30~50min,期间摇晃1-2次;离心管用锡箔纸包好以避光;将提取液在4000rpm下离心3分钟,取上清液,用PTFE滤膜过滤于棕色色谱瓶中0.5ml,所有的处理过程均在低光照强度下进行;待HPLC仪器信号稳定,在提取液中加入相同体积的 1mol/L 乙酸铵溶液,然后上机进行混合色素分离。乙酸铵溶液的加入尽量在上机之前,避免出现沉淀,影响仪器的正常运行[5]。
1.3HPLC单种色素分离分析
光合色素的分离分析选用Agilent 1260 Infinity Series液相色谱工作站,色谱柱为Eclipse XDB-C8(3.5μ m, 4.6 ×150mm)。通过二极管阵列检测器(DAD)检测洗出峰,固定记录波长为440nm和667nm,波长范围为190~900nm。流动相A为甲醇:1mol/L乙酸铵溶液=80:20;流动相B为100% 甲醇;流动相A的配制:将甲醇与1mol/L乙酸铵溶液按体积比4:1比例混合,通过pH计测定逐滴加入乙酸调节至pH=7.2,并用0.45μ m碳酸纤维滤膜过滤,超声波清洗器超声脱气20min后再用,流动相均现配现用。乙酸铵作为离子配对剂可以有效提高色素分离效果,改善峰形[6]。HPLC分析所有有机试剂均为色谱纯。洗脱程序参考文献[7]如表3。
1.4单种色素的获取
在收集目标光合色素之前,先进行一次完整的单种藻 HPLC图谱分析,以混合标准色素的分析图谱为依据,并参考胡俊等[7]提出的各光合色素的保留时间及最大吸收波长等特征来进行定性分析。依据实验得到的各色素保留时间,重复收集5-10次。此操作过程均需要在弱光条件下进行,准确把握好收集色素的时间。
1.5单种光合色素的定性与定量
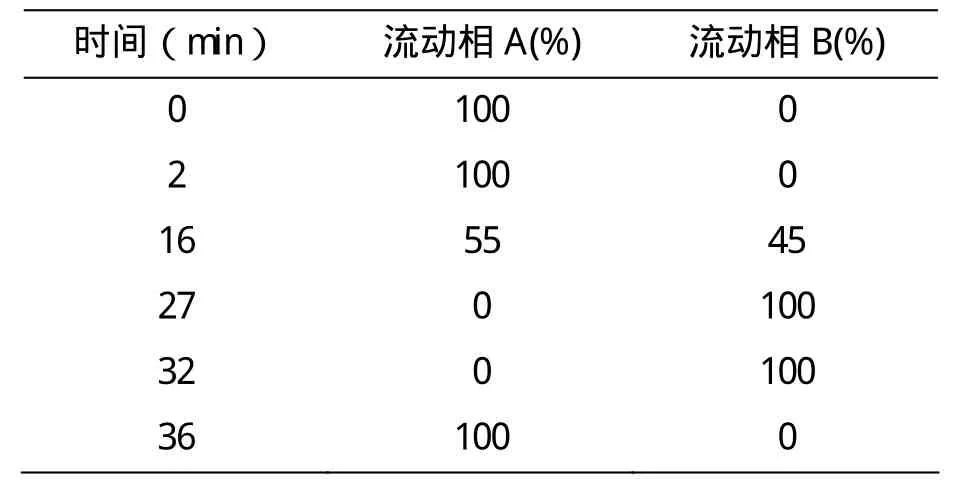
表3 梯度洗脱程序
将得到的单种藻的色谱图与光合色素的混合标准品液相色谱图进行对比分析,通过保留时间与各光合色素的最大吸收波长特征结合起来进行定性。得到目标单种色素后,首先用同样的梯度洗脱程序对其组成进行再分析,确保获得的目标物是单一色素后,用真空浓缩干燥器浓缩,并依据不同的分析要求溶解于不同的有机溶剂中(表4),通过分光光度计来测定其在最大吸收波长处的吸光度,扣除750nm处的杂质吸收,然后根据如下公式进行定量计算[8]:
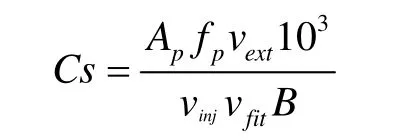
其中,C(g/L)为各色素浓度;Aλ max为各色素在最大吸收波长处的吸光度,d(cm)为比色皿的宽度;α (L·g-1·cm-1)为各光合色素的消光系数;各光合色素的消光系数数值[9]如表4所示。文中各光合色素分别为别藻黄素(Alloxanthin),叶绿素a (Chllorophyll a),叶绿素b (Chllorophyll b),岩藻黄素(Fucoxanthin),叶黄素(Lutein),新叶黄素(Neoxanthin),堇菜色素(Violaxanthin),玉米黄素(Zeaxanthin),多甲藻黄素(Peridinin)。
1.6各光合色素响应因子的确定
将已知浓度的光合色素溶液按要求的梯度(如5个浓度梯度)稀释后,以相同的实验条件、通过 HPLC获得不同浓度下的积分面积,以峰面积为 x轴,各光合色素进样量为 y轴,通过线性回归得出线性方程,拟合直线的斜率即为某一光合色素的响应因子值(fp)。此过程要严格保持弱光的环境条件。
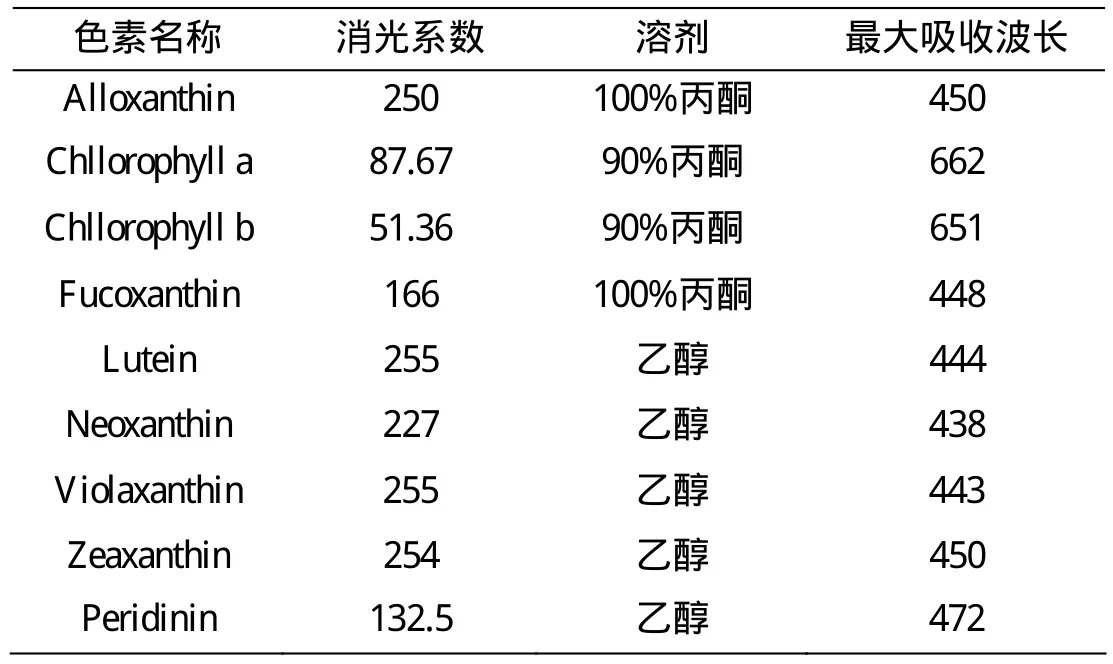
表4 浮游植物光合色素定量的消光系数
2 实验结果
2.1藻类光合色素组成的HPLC分析
各纯种培养藻类的 HPLC分析图谱如图1所示。除α-carotene与β-carotene没有很好的分离外,其它各色素都可以得到较好的分离。通过对铜绿微囊藻(图1.a)的高效液相色谱分析表明:该藻的主要色素为Zeaxanthin及Chlorophyll a。其中Zeaxanthin的保留时间为21分钟,经过多次收集保留时间为21分钟的出峰物质,即可获得Zeaxanthin单物质溶液;同样,多次收集保留时间在28分钟的物质即获得叶绿素a单物质溶液。

图1 单种藻的HPLC色素分析图谱
图1.b、c、d、e分别为单种培养的小球藻、空星藻、小定鞭金藻、隐藻的光合色素HPLC分析图谱,小球藻和空星藻的色素组成基本一致,包括Neoxanthin(16.0),Violaxanthin(16.92),Lutein(22.6),Chlorophyll b(26.0), Chlorophyll a(28.0)。用同样的方法分离小球藻(1.b)空星藻(1.c)也可得到各光合色素的单一物质溶液;小定鞭金藻(1.d)的色素组成主要有Fucoxanthin,Chlorophyllide,Violaxanthin单物质溶液,同样通过HPLC分离,手动富集可得到各色素的单一物质溶液;分离隐藻(图1.e)可得到Alloxanthin单一物质溶液,分离甲藻(图1.f)可得到Peridinin单一物质溶液。
2.2单一光合色素的分离及纯度分析
图2显示,用本实验方法获得的光合色素为单一物质,分别根据其保留时间和吸收光谱特征,可以确定其为Zeaxanthin。用同样的方法对收集的色素用相同的梯度洗脱程序经过HPLC分析后,也可确定其为单物质溶液。继续分离和富集可得到其他几种藻类光合色素。
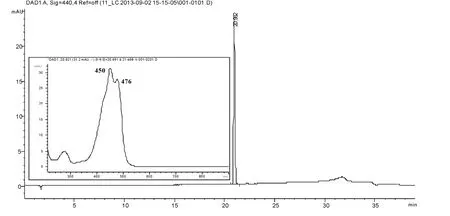
图2 单种色素的HPLC分析及其DAD图谱
2.3光合色素定量的响应因子分析
图 3分别为 Zeaxanthin, Alloxanthin, Chlorophyll a, Chlorophyll b, Fucoxanthin, Lutien, Neoxanthin, Violaxanthin, Peridinin的HPLC定量工作曲线,对实验得到的9种不同光合色素分别用不同的浓度梯度进行进样,外标法得到了其响应因子fp,各拟合曲线的线性相关系数均在0.9954与1之间。对本实验获得的各光合色素的响应因子与文献参考值进行相关性分析,相关系数为0.931。
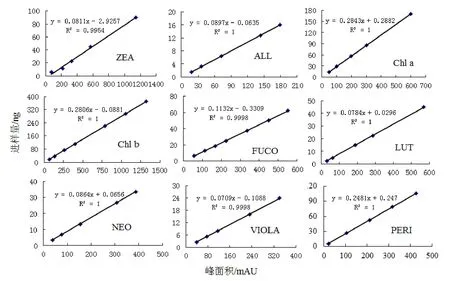
图3 标准光合色素定量曲线
3 讨论
Chlorophyll a和Zeaxanthin从铜绿微囊藻中分离;Neoxanthin、Violaxanthin、Lutein和Chlorophyll b从小球藻和空星藻中分离;Alloxanthin和Peridinin分别从隐藻和甲藻中分离。
以光合色素为生物标志物的化学分类法是一个成熟可靠的研究方法,目前已被广泛地应用于河口、近海、陆架及开放大洋区域的浮游植物类群组成研究。相对于海洋,淡水中浮游植物光合色素的研究起步较晚。关于HPLC法分析淡水浮游植物光合色素的研究均基于海洋浮游植物的化学分类法,但由于环境不同,淡水藻类与海洋藻类可能存在差异,直接采用海洋的相关数据,可能会导致较大误差。因此,非常有必要开展淡水常见优势藻类光合色素的组成、含量及其生理变化的研究。本研究以淡水蓝藻(铜绿微囊藻)、绿藻(小球藻、空星藻)、及金藻(小定鞭金藻)、隐藻(Cryptomonas sp.)为主要研究对象,分析了各种藻的色素组成,通过手动富集各目标色素,进行单种色素标定,得到了各色素的响应因子,结果显示各色素响应因子与文献中各色素的响应因子基本一致(表5)。各光合色素的fp值除Chlorophyll a和Chlorophyll b外,其余都与文献的报道值[3,7]一致。
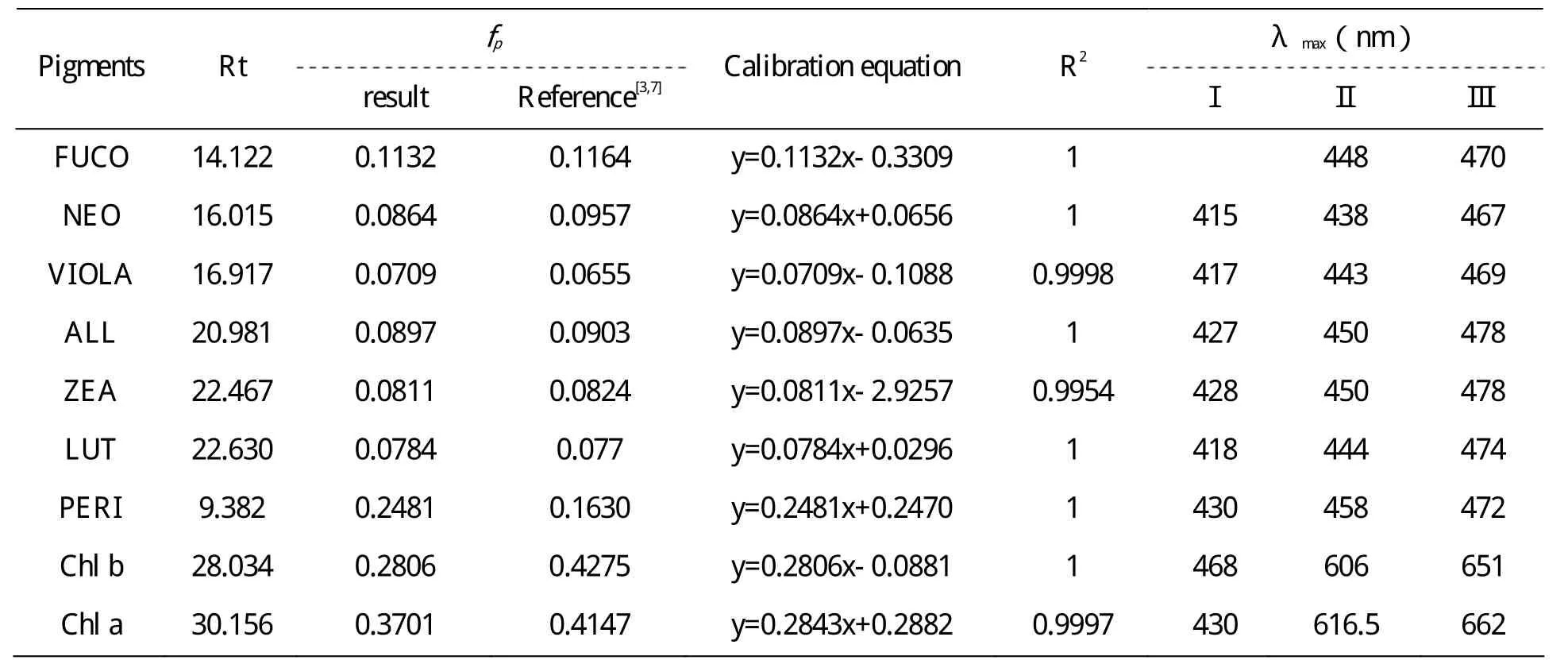
表5 光合色素标准品保留时间、响应因子、相关系数及最大吸收波长
蓝藻门的铜绿微囊藻检测出高含量的 Zeaxanthin;小球藻和空星藻都属于绿藻门,它们的色素组成基本一致,都含有较高含量的Chlorophyll b、Lutien、Neoxanthin和Violaxanthin;在小定鞭金藻中检测出一定含量的Fucoxanthin;在隐藻里面检测出一定含量的特征光合色素Alloxanthin;另外,小定鞭金藻和隐藻中Chlorophyllide含量较高,这是由于单种培养过程中没有及时进行HPLC色素分析工作,实验藻处于衰亡期,部分叶绿素a降解所致。本实验经过手动富集得到的单一色素溶液浓度较高,在标准曲线制作过程中,需要根据现场监测到的各光合色素实际浓度进行相应地稀释。
对同一光合色素进行平行进样,结果显示各光合色素的保留时间波动范围在2分钟内,最大吸收波长的波动范围在1-2nm之间,这可能是由于流动相配比的差异,造成乙酸铵-色素离子配对剂的修饰作用不同。另外,本实验得到各目标光合色素的DAD吸收光谱特征与文献值[3,7]相差1-5nm,这也是由于不同HPLC分析系统的流动相及色素与不同溶剂的作用力不同引起的。特别是实验得出的各光合色素的响应因子与文献[3,7]提供的数据有显著的相关性,这一点类胡萝卜素类表现尤为明显,而叶绿素类则差异较大。本结果中叶绿素类相关性欠佳的原因可归结为三点:第一、不同的光合色素分离条件(色谱柱型号、流动相组成、梯度洗脱程序、有机溶剂)之间存在差异;第二、叶绿素类较类胡萝卜素类对光敏感程度强烈,在手动收集、紫外分光光度计定量及外标法制作标准曲线的过程中,虽然光照条件很弱,但即使是弱光条件仍不可避免地影响其稳定性;第三、在有机溶剂中,叶绿素类的稳定性较差,即使是在超低温状态下也可能存在着降解的问题,在运输过程中更难免存在降解的问题。
[1] Jeffrey S. W. Profiles of Photosynthetic Pigments in the ocean using thin-Iayer chromatography[J]. Marine Biol., 1974, 26: 101-110.
[2] Hallegraeff G. F. Seasonal study of Phytoplankton Pigments and species at a coastal station off Sydney: importance of diatoms and nanoplankton[J]. Marine Biol., 1981, 61: 107-118.
[3] Jeffrey S. W., Mantoura R. F. C., Wright S. W. Praparation of chlorophyll standard[M]. In: Phytoplankton pigments in oceanography: guidelines to modern methods. UNESCO, Paris, 1997b, 207-237.
[4] Saro Jayaraman, Michael L. Knuth, Mark Cantwell, et al. High performance liquid chromatographic analysis of phytoplankton pigments using a C16-Amide column[J]. J. Chromatogr. A, 2011, 1218: 3432-3438.
[5] Wright S. W., Jeffrey S. W., Mantoura R. F. C. et al. Improved HPLC method for the analysis of chlorophylls and carotenoids from marine phytoplankton[J]. Marine ecology progress series, 1991, 183-196.
[6] Ston-Egiert J., Kosakowska A. RP-HPLC determination of phytoplankton pigments—comparison of calibration results for two columns[J]. Marine Biol., 2005, 147: 251-260.
[7] 胡俊, 柳欣, 王磊, 等. 应用反相高效液相色谱定性和定量浮游植物光合色素[J]. 海洋科学, 2011, 35(11): 19-28.
[8] Van Heukelem L., Thomas C. S. Computer-assisted high-performance liquid chromatography method development with applications to the isolation and analysis of phytoplankton pigments[J]. J. Chromatogr. A, 2001, 910(1): 31-49.
[9] Jeffrey S. W. Chlorophyll and carotenoid excitation coefficients[M]. In: Jeffrey S.W., Mantoura R. F. C.w, Wright S. W (eds) Phytoplankton pigments in oceanography: guidelines to modern methods. UNESCO, Paris, 1997a. 595-596.
Preparation of Phytoplankton Pigments Standards from Pure Culture of Freshwater Algae
LI Jia-yuan1, HU Jun2, HOU Jian-jun1, ZHOU Ting1, ZHENG He-long1, LIU Xi-xia1, BI Yong-hong3
(1. College of Life Sciences, Hubei Normal University, Huangshi Hubei 435002, China; 2. State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200062, China; 3.Institute of Hydrobiology, Wuhan Hubei 430070, China)
Analyzing the component and content of pigments in phytoplankton community enables the classification of strains into different phyla. However, the series of pigments standards are unavailable which restrains the application of this method. In this study, a method for the preparation of phytoplankton pigments standards from pure culture of freshwater algae was proposed, including chlorophyll a, chlorophyll b, fucoxanthin, lutein, zeaxanthin, alloxanthin, neoxanthin, violaxanthin and peridinin. Each phylum of phytoplankton has its typical composition of pigments. The pigments in each pure culture of phytoplankton were separated by high performance liquid chromatography (HPLC). The chromatographic peaks were identified according to the typical composition of pigments in the phytoplankton, also the retention time and absorption spectra of each peak. After the peak of each pigment was qualitative identified, the corresponding fraction was collected. Pool collected fractions were used as standard solutions whose concentrations were determined by spectrophotometry. Purities of all the standard solutions were over 99% identified by HPLC. The response factors of the the standard solutions were well correlated with those in literatures.
pure culture; high-performance liquid chromatographic; pigments separation; quantification; standards
Q178
A
2095-414X(2015)06-0078-06
侯建军(1966-),男,教授,研究生导师,研究方向:水环境分析及化学分类法研究浮游植物多样性.
国家自然科学基金项目(41171045);湖北师范学院优秀创新团队项目(T201504);湖北省高等学校2014年省级大学生创新创业训练计划项目(201410513027);湖北师范学院研究生创新基金项目(201204).

