地黄多糖对糖尿病肾病大鼠模型的治疗作用及对RAGE/NF-κB信号通路的影响*
康 伟,徐燕颖
地黄多糖对糖尿病肾病大鼠模型的治疗作用及对RAGE/NF-κB信号通路的影响*
康伟1,徐燕颖2
(1.天津市第五中心医院内分泌科,天津 300071;2.天津医科大学第二附属医院,天津300150)
[目的]探讨地黄多糖(RG)对糖尿病肾病(DN)大鼠模型的治疗作用以及对RAGE/NF-κB信号通路的影响。[方法]采用随机数字表法将健康雄性Sprague-Dawley(SD)大鼠分为5组(n=10),腹腔注射链脲佐菌素(STZ)构建DN大鼠模型,给予低、中、高3种不同剂量的RG,通过检查体质量变化、空腹血糖、胰岛素水平、血清肌酐、血清尿素氮、24 h尿量及尿蛋白等指标,观察RG对DN大鼠模型的治疗作用;同时采用Western Blot测定各组动物肾脏组织晚期糖基化终末产物特异性受体(RAGE)、细胞核因子-κB(NF-κB)的表达水平。[结果]RG可以显著改善DN大鼠的相关生化指标,增加大鼠肾脏组织中RAGE和NF-κB表达,发挥抗炎作用。[结论]地黄多糖对糖尿病肾病大鼠模型具有保护作用,其机制可能与RAGE/NF-κB信号通路有关。
地黄多糖;糖尿病肾病;抗炎;糖基化终产物受体;NF-κB
慢性肾病(CKD)逐渐成为全球范围内危害人类健康的重要疾病之一。据统计中国成年人CKD患病率为10.8%,且随着生活水平的提高以及人口老龄化,糖尿病肾病(DN)超越慢性肾小球肾炎成为导致CKD的首要病因[1]。DN是糖尿病最常见的微血管并发症之一[2],已成为导致慢性肾功能衰竭的最主要原因和糖尿病死亡的病因之一[3]。研究发现糖尿病高血糖可诱发多种炎症细胞因子和趋化因子产生并引起细胞外基质降解减少导致细胞增生,进而促进肾小球细胞外基质积聚及肾小球硬化,最终促进DN发生发展[4-5]。其中晚期糖基化终末产物(AGEs)可与糖基化终产物受体(RAGE)结合激活细胞核因子-κB(NF-κB)等多种信号转导途径[6],导致多种细胞因子及生长因子合成和释放,如血管内皮生长因子(VEGF)、血栓调节素和肿瘤坏死因子-α(TNF-α)等,扩大免疫/炎症反应,改变血流动力学及血液流变学,诱发细胞基质异常增生等多种病理变化[7],在DN病理生理发展过程中具有重要作用。
地黄是玄参科(Scrophulariaceae)植物地黄(Rehmannia glutinosa Libosch.)新鲜或干燥根茎,是中国传统补益类中药,根据炮制方法不同分为生地与熟地黄两类。生地中具有清热凉血,养阴生津之功效。熟地黄具有滋阴补血,益精填髓之功效[8]。研究表明,地黄能改善进行性肾功能衰竭和DN[9],地黄多糖(RG)是地黄的有效成分之一,具有增强造血功能,降低血糖[10],抑制肿瘤生长等作用[11]。但目前为止,对于RG对DN治疗作用尚无相关报道,笔者通过构建DN大鼠模型,探讨RG对DN大鼠模型的治疗作用,以及对RAGE/NF-κB信号通路的影响。
1 材料与方法
1.1实验材料及仪器RG由本实验室提取分离;链脲佐菌素(STZ,Sigma公司);血糖检测试剂盒,上海梅联生物科技有限公司;胰岛素检测试剂盒(Linco公司);DY89-I型组织匀浆机(上海天呈科技有限公司);5417R型低温超高速离心机(德国EPPENDORF公司);GC-2100型γ放射免疫计数仪(中国科大中佳公司);UV-1750型紫外可见分光光度计[岛津国际贸易(上海)有限公司]。
1.2实验动物雄性SD大鼠(200~250 g),购于中国人民解放军军事医学科学院实验室动物中心,饲养温度(22±1)℃,相对湿度40%~70%,12 h光照循环,自由饮食和饮水。高脂饮食含22%脂肪,20%蛋白质和48%碳水化合物;标准饮食含5%脂肪,20%蛋白质和53%碳水化合物。
1.3实验方法
1.3.1动物模型构建及分组雄性SD大鼠依据随机数字表法分为5组,每组10只。对照组给予标准饮食;DN模型组与RG低、中、高剂量组(治疗组)糖给予高脂饮食4周,12 h空腹禁食后,单次无菌腹腔注射剂量为65 mg/kg体质量的STZ(柠檬酸缓冲液配置)。72 h后尾静脉采血,空腹血糖水平高于16.7mmol/L确定为糖尿病大鼠。3周后留24 h尿样,检测24 h尿样中蛋白若高于30 mg则确定为DN模型构建成功[8]。治疗组分别腹腔注射10 mg/kg、20 mg/kg和30 mg/kg RG 0.2 mL,每日1次。对照组与模型组每日注射等剂量生理盐水,连续给予4周。
1.3.2体质量及血清生化指标检测连续给药4周后测定大鼠体质量,计算平均体质量;空腹12 h后,水合氯醛麻醉大鼠,腹主动脉采血,3 000 r/min离心15 min,分离血清,按照试剂盒说明测定大鼠空腹血糖和胰岛素水平(FINS);全自动生化分析仪测定血清肌酐、血尿素氮;收集各组大鼠24 h尿标本,计算尿量,检测尿蛋白。
1.3.3肾脏组织中RAGE和NF-κB表达含量的测定肾脏组织匀浆,测总蛋白含量,取40 μg蛋白进行凝胶电泳,兔抗RAGE多克隆抗体和兔抗NF-κB多克隆抗体孵育过夜,次日山羊抗兔二抗孵育1 h。Gene Tools图像分析系统测定灰度值,以目的蛋白/内参灰度值反映目的蛋白表达。
1.3.4统计学分析采用SPSS 20.0统计软件包进行数据处理,计量资料以均数±标准差表示,组间比较采用单因素方差分析,组间两两比较若方差齐采用LSD法,若方差不齐采用Dunnett’s T3法,P<0.05为差异有统计学意义。
2 实验结果
2.1一般情况观察正常对照组大鼠状态良好,皮毛光泽,动作自如,反应灵敏,未见动物死亡。高脂饮食组大鼠腹腔注射STZ后,典型的“三多一少”症状明显,精神状态较差,皮毛失去光泽,动作迟缓,反应迟钝;RG治疗组大鼠症状程度较轻,RG低、中和高剂量组未见动物死亡。
2.2RG对DN大鼠体质量及空腹血糖的影响给予DN大鼠RG治疗4周后测量各组大鼠体质量变化与空腹血糖水平。与对照组相比,DN模型组与RG治疗组大鼠体质量显著增加,空腹血糖水平升高(P<0.05);与模型组相比,RG治疗组大鼠体质量和空腹血糖水平均有不同程度下降,其中RG中、高剂量组差异有统计学意义(P<0.05),RG低剂量组无统计学意义(P>0.05),且体质量和空腹血统水平降低具有剂量依赖性,见表1。
表1 RG对DN大鼠体质量及空腹血糖的影响Tab.1 The effects of RG on weight and fasting glucose of DN rats

表1 RG对DN大鼠体质量及空腹血糖的影响Tab.1 The effects of RG on weight and fasting glucose of DN rats
注:与对照组相比,*P<0.05;与模型组相比,△P<0.05。
组别 体质量(kg) 空腹血糖(mmol/L)给药前 给药后 给药前 给药后对照组 0.25±0.02 0.35±0.05 4.76±0.25 4.79±0.15*模型组 0.52±0.03 0.67±0.03*14.83±0.33 18.33±0.58* RG低剂量组 0.53±0.02 0.65±0.04*15.15±0.24 17.65±0.43* RG中剂量组 0.51±0.04 0.55±0.03*△14.85±0.5312.35±0.63*△RG高剂量组 0.53±0.02 0.42±0.05*△14.92±0.4510.62±0.52*△n 剂量(mg/kg)10 10 10 10 10 --1 0 20 30
2.3RG对DN大鼠生化指标的影响不同剂量RG治疗DN大鼠4周后测量各组大鼠血清胰岛素、血肌酐和血尿素氮水平。与对照组相比,DN模型组与RG治疗组大鼠胰岛素水平显著降低,血肌酐和血尿素氮水平增加(P<0.05);与模型组相比,RG治疗组大鼠胰岛素水平剂量依赖性增加,血肌酐和血尿素氮水平降低,其中RG中、高剂量组差异有统计学意义(P<0.05),见表2。
表2 RG对DN大鼠血液生化指标的影响Tab.2 The effects of RG on blood biochemical index of DN rats

表2 RG对DN大鼠血液生化指标的影响Tab.2 The effects of RG on blood biochemical index of DN rats
注:与对照组相比,*P<0.05;与模型组相比,△P<0.05。
组别 胰岛素水平 血尿素氮 血肌酐(μg/L) (mmol/L) (μmol/L)对照组 0.82±0.05 6.56±1.25 19.79±7.34模型组 0.52±0.03* 12.83±6.35 28.33±8.49* RG低剂量组 0.59±0.04* 12.15±5.22 27.46±9.35* RG中剂量组 0.68±0.03*△10.25±6.43 24.53±7.61*△RG高剂量组 0.79±0.02*△ 9.92±4.65 20.47±8.46*△n 剂量(mg/kg)10 10 10 10 10 --1 0 20 30
2.4RG对DN大鼠24 h尿量和尿蛋白的影响DN大鼠经不同剂量RG治疗4周后测量各组大鼠24 h尿量和尿蛋白水平。与对照组相比,DN模型组与RG治疗组大鼠24 h尿量和尿蛋白显著增加(P<0.05);与模型组相比,RG治疗组大鼠24 h尿量和尿蛋白降低明显,其中以RG中、高剂量组差异有统计学意义(P<0.05),并成剂量依赖性,见表3。
2.5RG对DN大鼠RAGE和NF-κB蛋白表达的影响与对照组相比,DN模型组与RG治疗组大鼠RAGE和NF-κB蛋白表达显著增加(P<0.05);与模型组相比,RG治疗组大鼠RAGE和NF-κB蛋白表达呈剂量依赖性降低,其中以RG中、高剂量组有统计学差异(P<0.05),见表4,图1。
表3 RG对DN大鼠24 h尿量和尿蛋白的影响Tab.3 The effects of RG on 24 h urine and urine protein of DN rats
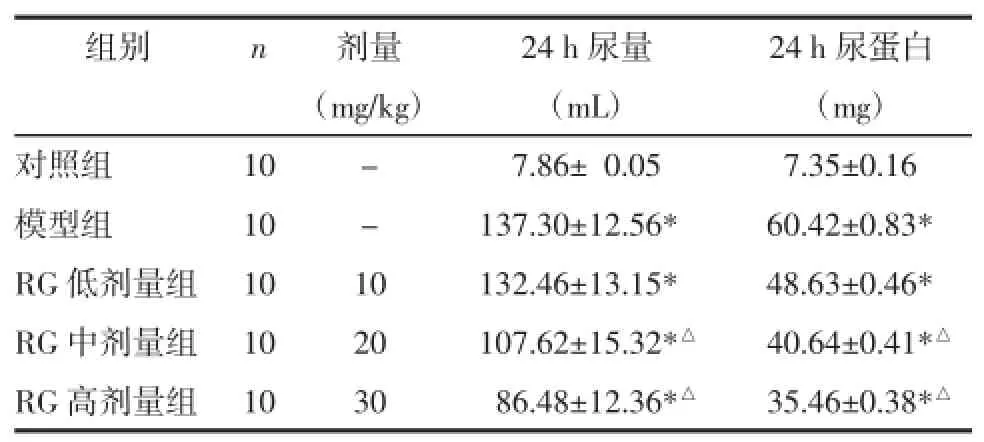
表3 RG对DN大鼠24 h尿量和尿蛋白的影响Tab.3 The effects of RG on 24 h urine and urine protein of DN rats
注:与对照组相比,*P<0.05;与模型组相比,△P<0.05。
组别n对照组模型组RG低剂量组RG中剂量组RG高剂量组10 10 10 10 10剂量 24 h尿量 24 h尿蛋白(mg/kg) (mL) (mg)- 007.86±0.05 07.35±0.16 - 137.30±12.56* 60.42±0.83* 10 132.46±13.15* 48.63±0.46* 20 107.62±15.32*△ 40.64±0.41*△30 086.48±12.36*△ 35.46±0.38*△
表4 RG对DN大鼠RAGE和NF-κB的影响?Tab.4 The effects of RG on the expression of RAGE and NF-κB of DN rats
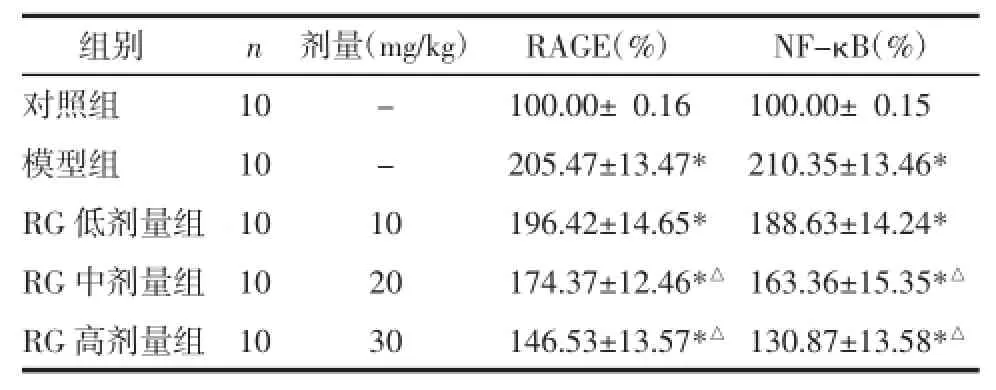
表4 RG对DN大鼠RAGE和NF-κB的影响?Tab.4 The effects of RG on the expression of RAGE and NF-κB of DN rats
注:与对照组相比,*P<0.05;与模型组相比,△P<0.05。
组别对照组模型组RG低剂量组RG中剂量组RG高剂量组n 10 10 10 10 10剂量(mg/kg) RAGE(%) NF-κB(%)- 100.00±0.16 100.00±00.15 - 205.47±13.47* 210.35±13.46* 10 196.42±14.65* 188.63±14.24* 20 174.37±12.46*△ 163.36±15.35*△30 146.53±13.57*△130.87±13.58*△

图1 RG对DN大鼠RAGE和NF-κB蛋白表达的影响Fig.1 The effects of RG on the expression of RAGE and NF-κB of DN rats
3 讨论
作为生命活动的基础物质之一,多糖不仅参与细胞骨架功能构成,而且在调节免疫,抗炎,抗氧化,降血糖血脂等多方面具有重要生物功能[12-13]。RG作为继苷类之后发现的地黄活性成分,同样具有降血糖,抗氧化,抗过敏,抗炎等多种药理活性[14]。DN已成为美国、欧洲许多国家和地区CKD和慢性肾衰竭的首要原发病,在中国其发病率不断升高[15]。高血糖是DN患者糖代谢紊乱的标志,研究表明长期高血糖刺激可导致肾小球硬化和肾小管间质炎症纤维化,促进DN的发生发展[16-17]。本研究通过给与予同剂量RG干预DN大鼠模型发现,RG可以有效降低大鼠空腹血糖浓度,提高血清胰岛素水平,改善糖尿病大鼠生存状况;同时降低血清血肌酐和血尿素氮浓度,减少大鼠24 h尿量和尿蛋白排量,延缓DN病理生理进展,可见RG通过干预糖代谢紊乱发挥DN保护作用,并且具有剂量依赖性。
高血糖及糖代谢紊乱造成晚期糖基化终末产物增多,与特异性配体-晚期RAGE结合,从而激活细胞内蛋白激酶C,蛋白酪氨酸激酶、细胞外信号调节激酶、氧自由基、NF-κB等多种信号转导途径,导致多种细胞因子及炎症因子释放,引发氧化应激,扩大免疫/炎症反应,损伤内皮细胞功能,促进胶原蛋白交联,血流动力学和血液流变学异常、细胞基质异常增生等病理变化[5,18]。RAGE终末糖基化产物受体,是单次穿膜片段受体,属于免疫球蛋白超家族成员之一,但表达水平较低[19]。本研究发现,RAGE在DN大鼠模型中表达显著增高,而RG给予治疗后却能显著降低其在DN大鼠模型中的表达,提示RG发挥DN保护作用可能与降低RAGE表达相关。此外,RAGE受体的激活进一步引发下游级联反应,其中最重要的就是激活NF-κB信号通路,NF-κB受到激活而易位,发生核转位,诱导基因组多种因子的转录,进而损伤血管内皮细胞,导致细胞基质异常增生,血流动力学异常等病理变化,参与DN病理生理过程[20]。同时研究证实炎症机制是DN持续发展的关键因素之一,其中NF-κB起着重要的介导作用[21-22]。笔者研究发现不同剂量RG可显著降低DN大鼠肾脏组织中NF-κB的过表达,抑制细胞中炎症通路的激活,发挥DN保护作用。
综上所述,RG对DN大鼠模型具有保护作用,其机制可能与RAGE/NF-κB信号通路有关。
[1] Zhang L,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China:a cross-sectional survey[J].The Lancet,2012,379(9818):815-822.
[2]彭立人.糖尿病肾病[J].中国全科医学,2006,9(2):91-93.
[3]陈翠兰,张兴坤,车树强.糖肾康胶囊对糖尿病肾病Ⅲ期尿微量白蛋白的影响[J].天津中医药,2014,31(10):596-598.
[4]Fornoni A,Tejada T.Role of inflammation in diabetic nephropathy[J]. Curr Diabetes Rev,2008,4(1):10-17.
[5]Kanesaki Y,Suzuki D,Uehara G,et al.Vascular endothelial growth factor gene expression iscorrelated with gloerular neovascularization in human diabetic nephropathy[J].Am J Kidney Dis,2005,45(2): 288-294.
[6]郑凝,魏世津.金芪降糖片对糖尿病大鼠肾脏保护作用的实验研究[J].天津中医药,2013,31(4):226-230.
[7]Hegab Z,Gibbons S,Neyses L,et al.Role of advanced glycation end products in cardiovascular disease[J].World J Cardiol,2012,4(4): 90-102.
[8]陶御风.临证本草[M].北京:人民卫生出版社,2005.
[9]赵晓娟,王德云,胡元亮,等.地黄多糖体外对小鼠淋巴细胞增殖及树突状细胞活性的影响.中国畜牧兽医学会中兽医学分会,2013年学术年会论文集[C].哈尔滨:中国畜牧兽医学会,2013: 435-441.
[10]赵平鸽,刘晓.地黄多糖的提取纯化及其对糖尿病小鼠血糖的影响研究[J].海峡药学,2010,22(9),29-32
[11]崔瑛.地黄多糖药理研究进展[J].中国自然医学杂志,2000,2(3): 186-188.
[12]Chen H,Zhang M,Qu Z,et al.Antioxidant activities of different fractions of polysaccharide conjugates from green tea(Camellia sinensis)[J].Food Chemistry,2008,106(2):559-563.
[13]马继伟,王宏天,刘培娜,等.肾康注射液治疗早期糖尿病肾病的临床观察[J],天津中医药,2013,30(9):526-528.
[14]Jiang YH,Jiang XL,Wang P,et al.The antitumor and antioxidative activities of polysaccharides isolated from Isaria farinosa B05[J]. Microbiological Research,2008,163(4):424-430.
[15]李发胜,徐恒瑰,李明阳,等.熟地多糖提取物对小鼠免疫活性的影响[J].中国公共卫生,2008,24(5):1109-1110.
[16]Sourris KC,Forbes JM.Interactions between advanced glycation end-products(AGE)and their receptors in the development and progression of diabetic nephropathy-are these reeepton valid therapentictargets[J].Curt Drug Targets,2009,10(1):42-50.
[17]Kanwar YS,wada J,Sun L,et al.Diabetic nephropathy:mechanisms of renal disease progression[J].Exp Bid Med(Maywood),2008,233(1):4-11.
[18]Schram MT,Schalkwijk CG,Bootsma AH,et al.Advanced end products are associated with pulse pressure in type 1 diabetes:the EURODIABProspectiveComplicationsStudy[J].Hypertension,2005,46(1):232-237.
[19]Rojas A,Figueroa H,Morales E.Fueling inflammation at tumor microenvironment:the role of multiligand/RAGE axis[J].Carcinogenesis,2010,31(2):334-341.
[20]Yamagishi S,Fukami K,Ueda S.Molecular mechanisms of diabetic neprophathy and its therapeutic intervention[J].Curr Drug Targets,2007,8(8):952-959.
[21]Vidt DG.Inflammation in renal disease[J].Am J Cardio J,2006,97(2):20-27.
[22]Mora C,Navarro JF.Inflammation and diabetic nephropathy[J].Curr Diab Rep,2006,6(6):463-468.
(本文编辑:马英,高杉)
Study of therapeutic effect of Rehmaniae Radix Polysaccharide on diabetic nephropathy rats and the role of RAGE/NF-κB signaling pathway
KANG Wei1,XU Yan-ying2
(1.Department of Endocrinology,Tianjin Fifth Central Hospital,Tianjin 300071,China;2.The Second Affiliated Hospital of Tianjin Medical University,Tianjin 300150,China)
[Objective]To investigate the therapeutic effect of Rehmaniae Radix Polysaccharide on diabetic nephropathy rats and the role of RAGE/NF-κB signaling pathway.[Methods]Diabetic nephropathy rats induced by STZ were randomly divided into five groups(n=10): control group,diabetic nephropathy group,low Rehmaniae Radix Polysaccharide group,middle Rehmaniae Radix Polysaccharide,and high Rehmaniae Radix Polysaccharide group.The effects of Rehmaniae Radix Polysaccharide on body weight,FBG,FINS,24 h urine volume and urine protein were investigated.Moreover,Western Blot was applied for evaluating the expression of RAGE and NF-κB protein.[Results]Rehmaniae Radix Polysaccharide could increase the body weight,reduce the content of FBG,enhance FINS level. Meanwhile,serum creatinine,blood urea nitrogen,24 h urine volume and urine protein of diabetic nephropathy rats were also decreased after Rehmaniae Radix Polysaccharide treatment.Furthermore,Rehmaniae Radix Polysaccharide showed an obvious anti-inflammatory effect through increasing the expression of RAGE and NF-κB in kidneys.[Conclusion]These results indicated Rehmaniae Radix Polysaccharide could provide protection effect on diabetic nephropathy rats through hpyerglycemic and anti-inflammatory,which is related to RAGE/NF-κB signaling pathway.
Rehmaniae Radix Polysaccharide;diabetic nephropathy;anti-inflammatory;RAGE;NF-κB
R587.1
A
1672-1519(2015)06-0364-04
10.11656/j.issn.1672-1519.2015.06.12
国家自然科学基金资助项目(81102613)。
康伟(1970-),女,副主任医师,主要从事糖尿病临床与基础研究工作。
徐燕颖,E-mail:xuyanying_2010@126.com。
(2015-01-20)

