地拉罗斯联合顺铂对非小细胞肺癌细胞增殖及凋亡的影响
袁婷,梁吉祥,张斌,汪蓓蕾,张欣,郭刚,张瑞△
地拉罗斯联合顺铂对非小细胞肺癌细胞增殖及凋亡的影响
袁婷1,梁吉祥2,张斌1,汪蓓蕾1,张欣1,郭刚1,张瑞1△
目的探讨铁鳌合剂地拉罗斯及其联合顺铂对肺腺癌A549细胞增殖、凋亡的影响,为寻找肺癌有效的治疗途径提供依据。方法常规传代细胞培养方法培养肺腺癌细胞A549,以不同浓度的地拉罗斯、地拉罗斯联合顺铂干预细胞生长一定时间。在倒置显微镜下观察A549的生长抑制特征;MTT法检测细胞的增殖抑制状况;DAPI、AO/ EB染色观察细胞凋亡的形态学变化;Annxin V-FITC/PI双染流式细胞术定量测定细胞凋亡状况。结果A549细胞经不同浓度的药物作用一定时间以后,在倒置显微镜下可见随药物浓度和时间的增加,细胞数明显减少,细胞相互分散,贴壁细胞出现皱缩变小折光性差;MTT检测显示,细胞增殖抑制率随药物浓度的增加和作用时间的延长呈现上升趋势,即剂量效应关系及时间效应关系;DAPI、AO/EB染色法观察到细胞凋亡的形态学变化,即细胞发生染色质凝集,核固缩等典型的凋亡形态特征;流式细胞术检测显示,细胞的凋亡率随药物浓度的增加而升高,联合用药促细胞凋亡显著。结论铁鳌合剂地拉罗斯具有抗肺癌细胞A549增殖的能力,促进肿瘤细胞凋亡,其与顺铂联合可增强癌细胞耐受性,降低顺铂的用量及其不良反应。
癌,非小细胞肺;铁螯合剂;顺铂;细胞增殖;细胞凋亡;地拉罗斯
肺癌是世界范围内最常见的恶性肿瘤之一,已经成为人类因癌症死亡的主要原因之一。肺癌分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中非
1 材料与方法
1.1主要试剂与仪器人肺腺癌细胞系A549细胞,购自中科院上海细胞生物研究所,本实验室常规传代培养。RPMI-1640、胎牛血清(FBS)、青霉素、链霉素均购自Gibco公司;胰蛋白酶、MTT购自Sigma公司;Annexin V细胞凋亡检测试剂盒购自Jacson公司;吖啶橙(Acridine orange,AO)和溴乙啶(ethidium bromide,EB)购自Amresco公司;细胞培养板、离心管、培养瓶等购自Corning公司。荧光倒置显微镜(德国Lei⁃ca,4000B型),普通光学显微镜(德国Leica,520804型),二氧化碳培养箱(美国热电公司产品),酶标检测仪(德国Beck⁃man),流式细胞仪(美国BD公司),超净工作台(北京东联哈尔仪器制造有限公司),离心机(德国HERMLE,Z300型)。
1.2方法
1.2.1A549细胞复苏从液氮罐中取出A549细胞冻存管,直接投入37℃温水中,并不时摇动令其尽快融化,待冻存液完全溶解后,乙醇消毒冻存管,用吸管吸出细胞悬液,注入10 mL离心管中,再加入9 mL 10%FBS RPMI 1640培养基,轻轻吹打混匀,离心、去上清,再用培养液洗1次,弃上清,加入5 mL培养液,轻轻吹打离散细胞,移入25 mL培养瓶,置于37℃、5%CO2培养箱中培养,次日更换培养液。
1.2.2A549细胞传代及细胞培养选择生长状态良好,细胞贴壁融合达70%~80%的细胞进行传代,弃去旧培养基,用0.01 mol/L PBS液清洗2次,加入0.25%胰酶消化液1 mL,置显微镜下观察,当细胞回缩,间隙增大后加入含体积分数10%FBS RPMI 1640培养基终止消化,用吸管轻轻地将细胞吹打下来,离心、去上清、重悬细胞使之成为单细胞悬液,细胞计数,之后将细胞悬液分成等份分装数个培养瓶,补加培养基,37℃、5%CO2培养箱中培养,隔天换液1次,待细胞融合成致密单层后可再次传代。
1.2.3A549细胞计数台盼蓝染料排除法:用95%乙醇清洗擦净计数板和盖片,自然风干,将盖片置于计数板上面,微露一侧计数板台面,9滴细胞悬液和0.4%台盼蓝燃料1滴混匀,置2~3 min后取1滴轻轻滴入计数板边缘,使之充满计数板和盖片间隙,立即镜检:健康细胞透明不着色。计4个大方格内的健康细胞数,按以下公式计算细胞悬液浓度,每一样品重复计数3次,取均值。每毫升细胞数=4大格细胞总数/4×104。
1.2.4A549细胞冻存选择生长状态良好的对数生长期细胞,冻存前1 d换液1次。胰酶消化收集细胞,制成单细胞悬液,将细胞悬液移至离心管中,室温下1 000 r/min离心5 min,弃上清,加入3 mL PBS,吸管吹打混匀,室温下1 000 r/ min离心5 min,弃上清,加入细胞冻存液,使细胞的最终密度为5×106/mL,吹打混匀,移入冻存管,封口,注明冻存细胞名称、冻存日期。冻存细胞依次置于4℃30 min,20℃l h,80℃过夜,液氮罐中长期保存。
1.2.5A549细胞生长抑制的形态学观察取对数生长期的A549细胞,用0.25%胰酶消化液消化,加入含体积分数10% FBS RPMI 1640培养基终止消化,用吸管轻轻地将细胞吹打下来,离心、去上清、重悬细胞配制成密度为1×105个/mL的单细胞悬液,均匀铺到6孔板中,孵育过夜,倒置显微镜下观察细胞贴壁后,分别加入终浓度为20、40、80、160、320 μmol/ L地拉罗斯,加或不加顺铂(终浓度8 μmol/L)的培养液,对照组用含体积分数10%FBS RPMI 1640培养基同步培养,置37℃、5%CO2培养箱中分别培养24 h、48 h后,置于倒置显微镜下动态性及对照性地观察细胞。
1.2.6MTT法测定A549细胞的增殖抑制率取对数生长期的A549细胞,以1×105个/mL细胞密度接种96孔板中,每孔加入100 μL培养液,置体积分数为5%CO2、37℃饱和湿度培养箱内,继续培养。待细胞贴壁后,实验组分别加入终浓度为20、40、80、160、320 μmol/L地拉罗斯,加或不加顺铂(终浓度8 μmol/L)的培养液继续培养24 h、48 h、72 h,对照组用含体积分数10%FBS RPMI 1640培养基同步培养,以上每孔均设置4个平行复孔。药物作用指定时间以后,每孔加入5 g/L的MTT溶液20 μL,37℃孵育4 h后吸弃培养液,每孔加入150 μL的DMSO,震荡10 min使结晶物充分溶解,采用酶标仪在490 nm波长处测定各孔的光密度(OD)值,取每4个重复孔OD值的平均数,按下列公式求出药物对肿瘤细胞的抑制率。细胞存活率=(实验组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)×100%。
1.2.7DAPI、AO/EB染色观察A549细胞凋亡的形态学变化DAPI染色:取对数生长期的A549细胞,以1×105个/mL细胞密度接种于6孔板中,每孔加入2 mL培养液,置体积分数为5%CO2、37℃饱和湿度培养箱内过夜培养,分别加入终浓度为20、40、80、160、320 μmol/L地拉罗斯、加或不加顺铂(终浓度8 μmol/L)的培养液继续培养48 h,吸弃培养液,用4%多聚甲醛温室固定1 h,PBS洗涤3次,每次5 min,再用DAPI染液温室避光染色30 min,吸弃染液,PBS洗涤,荧光显微镜下观察,拍照。AO/PI染色:同上方法培养处理细胞48 h后弃去培养液,加入AO/EB染液温室避光染色15 min,吸弃染液,PBS洗涤,荧光显微镜下观察,拍照。
1.2.8A549细胞凋亡的测定取对数生长期的A549细胞以1×105个/mL的密度接种于6孔板中,孵育过夜,细胞贴壁后,分别加入不同浓度的地拉罗斯、加或不加顺铂的培养液,对照组加入等体积的生理盐水,置于37℃、5%CO2培养箱中培养48 h后收集细胞1×106个,离心、弃上清,用4℃预冷的PBS洗涤2次,离心、弃上清,用1×结合缓冲液重悬细胞使其浓度为1×106/mL,加入5 μL Annexin V/FITC和10 μL PI染色液(20 mg/L)避光反应5 min,BDFACS Aria流式细胞仪检测分析。
1.3统计学方法数据采用Origin 8.0软件计算平均值和标准差,用SPSS 13.0软件进行多组间方差分析,P<0.05为差异有统计学意义。
2 结果
2.1地拉罗斯对A549细胞生长抑制的形态学影响培养24 h、48 h的A549细胞,对照组细胞连接紧密,密集成片生长,形态大小均匀,折光性好。经不同浓度的药物处理后,可见细胞数明显减少,细胞相互分散,贴壁细胞出现皱缩变小,固缩且深染,折光性差。随着浓度的增加和作用时间的延长,漂浮细胞增多,贴壁生长的细胞变得稀疏,见图1、2。
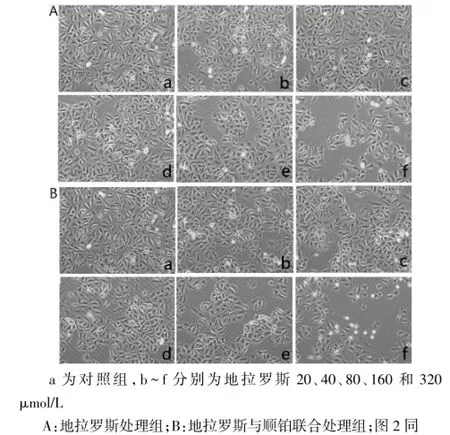
Fig.1 Morphological effects of drugs after 24 h of cell growth inhibition(HE,×100)图1 药物作用24 h后细胞生长抑制的形态学影响(HE,×100)
2.2地拉罗斯对A549细胞增殖的影响地拉罗斯在24 h处理组20 μmol/L时,对细胞的抑制作用不明显,48 h、72 h处理组与对照组相比,各浓度均显示出明显的生长抑制作用,差异有统计学意义(P<0.05)。随给药时间的延长,药物对细胞抑制作用也越来越强,320 μmol/L地拉罗斯联合顺铂作用48 h,细胞抑制率已达到65%,160 μmol/L地拉罗斯联合顺铂抑制率也达到47%,80 μmol/L地拉罗斯联合顺铂组作用细胞72 h,细胞抑制率接近50%,差异有统计学意义(P<0.05),见图3。
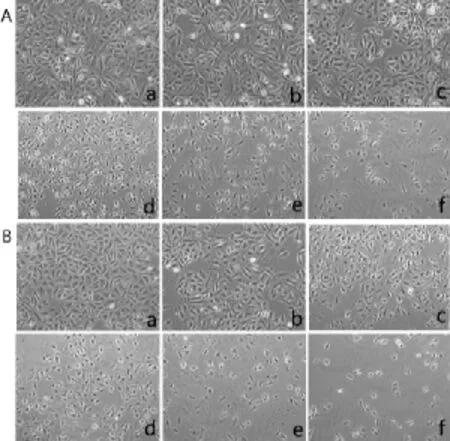
Fig.2 Morphological effects of drugs after 48 h of cell growth inhibition(HE,×100)图2 药物作用48 h后细胞生长抑制的形态学影响(HE,×100)

Fig.3 The impact of drugs on A549 cell proliferation图3 药物对A549细胞增殖的影响
2.3地拉罗斯对A549凋亡的形态学观察正常细胞核被染成均一的淡蓝色,核完整性良好,而药物处理后部分细胞发生染色质凝集,核固缩等典型的凋亡形态特征,在荧光显微镜下细胞核内呈现亮蓝色斑点,并随药物浓度的增大,发生核固缩现象的细胞数量相应增多,且联合用药组现象更明显,以160μmol/L的地拉罗斯或联合顺铂处理时,凋亡细胞数量明显增多;AO/EB染色进一步观察显示,对照组细胞核完整,呈均匀的绿色荧光,而处理组细胞膜边缘粗糙,细胞核边集、浓缩等变化,呈不均匀的亮绿色荧光。以160 μmol/L的地拉罗斯或80 μmol/L地拉罗斯联合顺铂处理细胞48 h后,可见细胞部分已经处于凋亡晚期,细胞膜完整性被破坏,细胞核被染成橘红色,见图4、5。
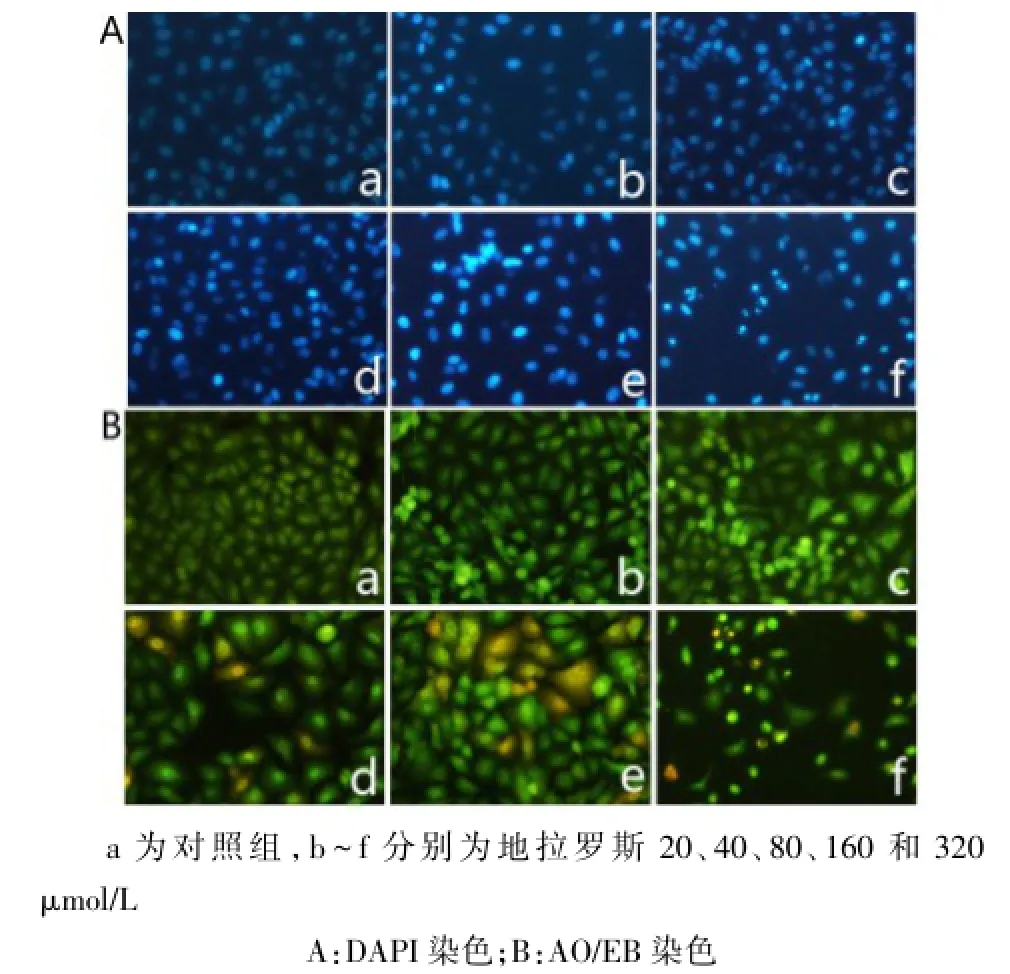
Fig.4 Effect of Deferasirox on apoptotic morphology of A549图4 地拉罗斯对A549细胞凋亡的形态学影响(×200)
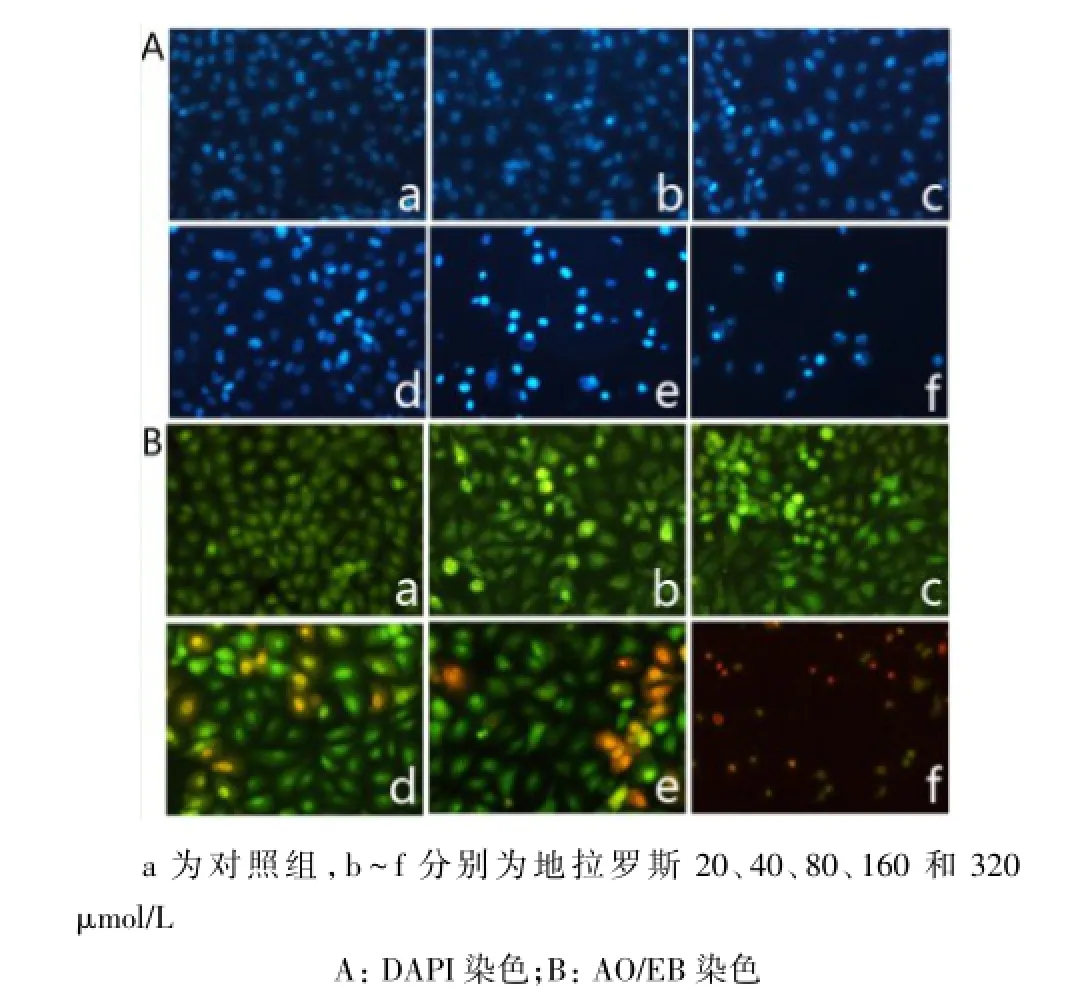
Fig.5 Effect of combination of Deferasirox with cisplatinon on apoptotic morphology of A549图5 地拉罗斯联合顺铂对A549细胞凋亡的形态学影响(×200)
2.4Annxin V-FITC/PI双染流式细胞术定量测定细胞凋亡A549细胞凋亡率随药物处理剂量的增大而增加,160 μmol/L地拉罗斯处理A549细胞48 h 或80 μmol/L地拉罗斯联合顺铂处理48 h时,凋亡率显著增加,见图6。
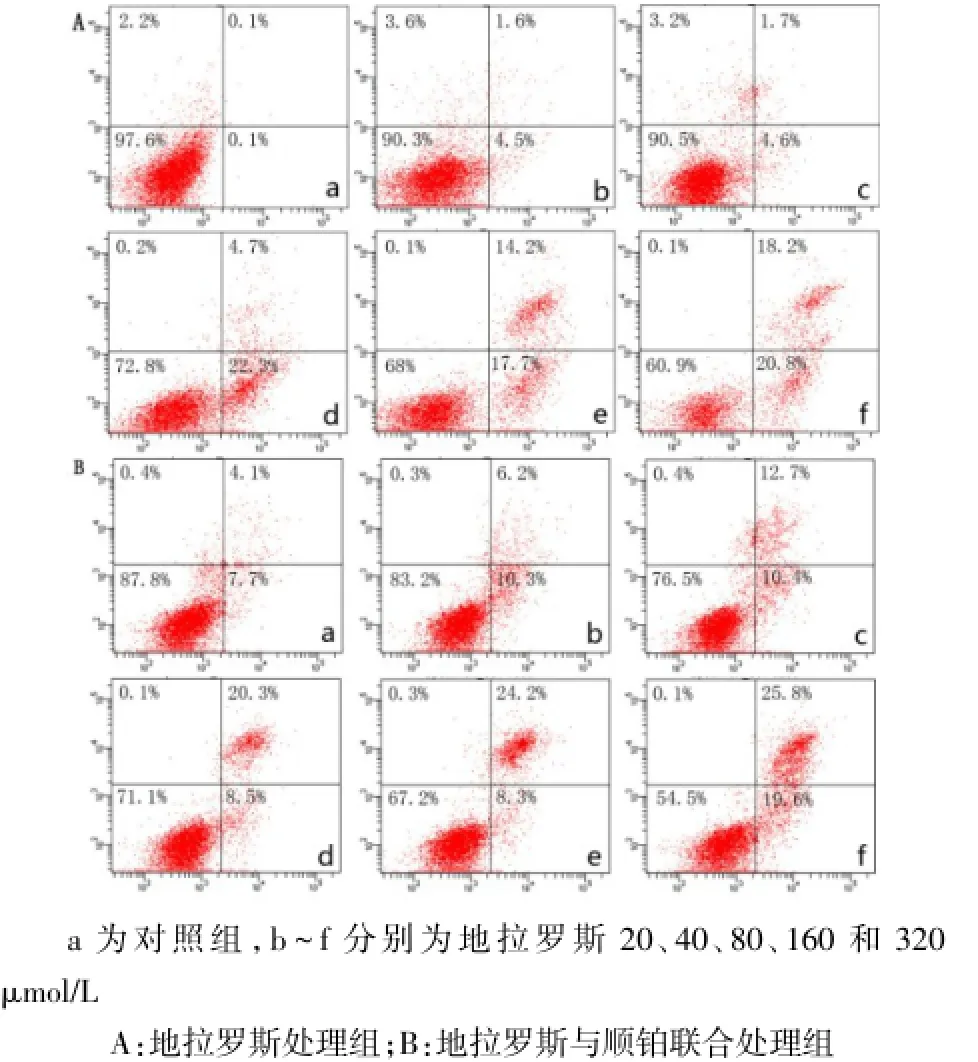
Fig.6 The impact of drugs on the rate of apoptosis in A549 cell图6 药物对A549细胞凋亡率的影响
3 讨论
肺癌细胞具有高侵袭、高转移等复杂的生物学特性,其恶性程度比较高。在国际上肺癌的发病率和死亡率是增长最快的恶性肿瘤。所以如何有效阻断癌细胞的增殖,抑制肺癌的发生发展已经成为世界性的抗癌焦点。虽然近年来随着科学技术的发展,人类对肺癌的研究、治疗已取得进展,治疗肺癌的药物也已用于临床,但是疗效均无实质性突破。
铁是各种生命细胞增殖和功能活动所需的必要元素之一[6]。肿瘤细胞更需要摄取足量的铁以供其自身生长、分化及增殖,其需铁量显著高于正常细胞。国内外的研究发现:铁超载可促进肿瘤细胞的生长,而铁剥夺可抑制肿瘤细胞的生长[7-9]。肺腺癌细胞也属肿瘤细胞,其增殖也需大量的铁,而应用铁鳌合剂造成铁缺乏对肺癌细胞也有一定的影响。然而目前用于临床的铁鳌合剂如去铁胺等治疗肺癌的药物,存在半衰期短,患者顺应性差,不良反应较大等缺陷。本研究利用另一种高效口服的铁鳌合剂—地拉罗斯,作用于肺腺癌细胞来观察其对细胞增殖凋亡的影响,为肺癌的治疗、研究提供理论依据。
为研究A549细胞的生长状况以了解地拉罗斯和地拉罗斯联合化疗药物对肺腺癌细胞增殖抑制的作用,本实验采用两种手段即形态学观察、细胞增殖活力(MTT)法来反映药物对A549的抑制作用。本研究利用倒置显微镜观察细胞的形态学特征,发现正常细胞连接紧密,密集成片生长,形态大小均匀。经不同浓度的地拉罗斯或联合顺铂作用后,可见细胞数目减少,细胞形态发生变化,折光性差,随着药物浓度的增加以及作用时间的延长,漂浮细胞增多,贴壁生长的细胞变得稀疏,并且地拉罗斯联合顺铂处理后,细胞生长抑制作用更明显。MTT法检测地拉罗斯及联合顺铂对A549细胞增殖抑制率的影响,结果显示,随药物浓度的增加和作用时间的延长,细胞的增殖抑制率升高,地拉罗斯为160μmol/L作用48 h时抑制率已达到50%左右,且联合用药抑制率更高。另外,通过查文献显示顺铂的半数致死浓度为12μmol/L,而本实验采用的顺铂终浓度为8 μmol/L。以上表明地拉罗斯对A549细胞的增殖有较强的抑制作用,联合化疗药物效果更好,并且可以降低化疗药物的使用浓度,增强癌细胞耐受性。
细胞凋亡是机体维持自身稳定和平衡的一种重要机制,肿瘤的发生、发展与细胞凋亡抑制密切相关[10]。诱导肿瘤细胞凋亡在癌症的治疗中具有重要作用,是许多药物抑制肿瘤细胞生长的机制之一[11-12]。为了研究地拉罗斯对肿瘤细胞的生长抑制作用是否通过诱导其凋亡实现,本实验采用DAPI和AO/EB荧光染色、Annexin-V/PI双染流式细胞术来对A549细胞从形态学和生化特征两个方面进行凋亡特征检测。DAPI和AO/EB荧光染色法显示对照组细胞核均匀淡染,而药物处理组细胞部分出现染色质凝集,核固缩为新月状、念珠状,呈现亮蓝色或亮绿色荧光,从形态学方面证实地拉罗斯诱导细胞凋亡的发生。Annexin-V/PI双染流式细胞术检测显示,随药物浓度的增加,细胞凋亡率逐渐上升,呈现一定的剂量依赖性关系。
综上所述,本实验利用形态学观察、MTT法、流式细胞术等生物学指标,证实了铁鳌合剂地拉罗斯及其联合顺铂对非小细胞肺癌增殖、凋亡的作用,即抗增殖、促凋亡作用,地拉罗斯单药或联合其他化疗药物应用可能是治疗肺癌的一个可行的途径,为临床采用地拉罗斯或联合地拉罗斯治疗研究非小细胞肺癌提供了实验基础。
[1]Bansal N,Banerjee D.Tumor initiating cells[J].Curr Pharm Bio⁃technol,2009,10(2):192-196.doi:10.1073/pnas.0905016106.
[2]Cheng Z,Xia J,Song YN.In vitro effects of iron on human lung ade⁃nocarcinoma cell line A549[J].Chinese Journal of Gerontology,2010,30(24):3713,3715.[程哲,夏杰,宋永娜.铁对人肺腺癌A549细胞凋亡的体外影响[J].中国老年学杂志,2010,30(24):3713,3715].doi:10.3969/j.issn.1005-9202.2010.24.042.
[3]Kukulj S,Jaganjac M,Boranic M,et al.Altered iron metabolism,in⁃flammation,transferrin receptors,and ferritin expression in nonsmall-cell lung cancer[J].Med Oncol,2010,27(2):268-277.doi: 10.1007/s12032-009-9203-2.
[4]Kovacevic Z,Kalinowski DS,Lovqoy DB,et al.Iron Chelators:De⁃velopment of novel compounds with high and selective anti-tumour activity[J].Curr Drug Deliv,2010,[Epub ahead of print].doi: 10.1165/rcmb.2008-0299OC.
[5]Zhang LL,Wang L,Chen Z,et al.Efficacy analysis of two drugs con⁃sisting platinum combined with first-line chemotherapeutics regi⁃mens on 117 elderly patients with advanced non-small cell lung carcinoma[J].Med J Chin PLA,2013,38(8):644-648.[张黎黎,王莉,陈卓,等.一线含铂两药化疗方案治疗117例老年晚期非小细胞肺癌的疗效分析[J].解放军医学杂志,2013,38(8):644-648].
[6]Zhang AS,Enns CA.Molecular mechanisms of normal iron homeo⁃stasis[J].Hematology Am Soc Hematol Educ Program,2009:207-214.doi:doi:10.1186/1477-5956-7-4.
[7]Munoz M,Villar I,Garcia-Erce JA.An update on iron physiology [J].World J Gastroenterol,2009,15(37):4617-4626.doi:10.3748/ wjg.15.4617.
[8]Richardson DR,Kalinowski DS,Lau S.Cancer cell iron metabolism and the development of potent iron chelators as anti-tumour agents [J].Biochim Biophys Acta,2009,1790(7):702-717.doi:10.2174/ 138920209788488517.
[9]Toyokuni S.Role of iron in carcinogenesis:cancer as a ferrotoxic disease[J].Cancer Sci,2009,100(1):9-16.doi:10.1016/j.bba⁃bio.2009.05.010.
[10]Kutanzi KR,Koturbash I,Bronson RT,et al.Imbalance between apoptosis and cell proliferation during early stages of mammary gland carcinogenesis in ACI rats[J].Mutat Res,694(1-2):1-6.doi: 10.1016/j.mrfmmm.2010.07.006.
[11]Jin S,Zhang Q,Kang X,et al.Daidzein induces MCF-7 breast can⁃cer cell apoptosis via the mitochondrial pathway[J].Ann Oncol,2010,21(2):263-268.doi:10.1093/annonc/mdp499.
[12]Sarkar S,Mazumdar A,Dash R,et al.ZD6474,a dual tyrosine ki⁃nase inhibitor of EGFR and VEGFR-2,inhibits MAPK/ERK and AKT/PI3-K and induces apoptosis in breast cancer cells[J].Cancer Biol Ther,2010,9(8):592-603.doi:10.1016/j.cellbi.2010.08.013.
(2014-04-30收稿2014-09-25修回)
(本文编辑魏杰)
The effect of combination treatment using iron chelator deferasirox and cisplatin on proliferation and apoptosis in non-small cell lung cancer
YUAN Ting1,LIANG Jixiang2,ZHANG Bin1,WANG Beilei1,ZHANG Xin1,GUO Gang1,ZHANG Rui1△
1 Institute of Endocrinology/Metabolic Disease Hospital of Tianjin Medical University,Tianjin 300070,China;2 The Second Hospital of Tianjin Medical University
△Corresponding Author E-mail:bbrui2003@hotmail.com
ObjectiveTo investigate the combination effect using iron chelators deferasirox and cisplatin on A549 cell proliferation and apoptosis and to provide evidences to explore an effective way to treat lung cancer.MethodsLung adeno⁃carcinoma cells were cultured by conventional way,with administration of different concentrations of deferasirox and cisplat⁃in.Cell growth inhibition was observed under an inverted microscope.Proliferation inhibition was evaluated by MTT assay. Morphological changes of cell apoptosis was detected using DAPI,AO/EB straning and flow cytometry.ResultsAfter a cer⁃tain time of incubation with different concentrations of the combined drugs,the cell number reduce significantly,which was counted under invert microscope.Cells were dispersed with each other and adherent cells appear shrunken and poor in re⁃fractivity.MTT assay showed that inhibition of cell proliferation was in a concentration-time-dependent manner.Chromatin condensation,nuclear condensation and other typical apoptotic morphology were detected after DAPI and AO/EB straning. Flow cytometry showed that apoptosis increased with rising drug concentration.So combination therapy was significantly pro-apoptotic.ConclusionDeferasirox has the ability to inhibit proliferation of A549 cells and can promote tumor cell apoptosis and enhances cancer cell tolerance when combined with cisplatin.It can also reduce the amount and toxicity of cis⁃platin.It provides a basis for finding an effective way to treat lung cancer.
carcinoma,non-small-cell lung;iron chelating agents;cisplatin;cell proliferation;apoptosis;deferasirox
R734.2
ADOI:10.11958/j.issn.0253-9896.2015.02.007
1天津医科大学代谢病医院内分泌研究所、卫生部激素与发育重点实验室(邮编300070);2天津医科大学第二医院
袁婷(1989),女,硕士在读,主要从事内分泌代谢病研究
△E-mail:bbrui2003@hotmail.com小细胞肺癌约占肺癌总数的80%,总的5年平均生存率不超过15%,有症状者≤10%[1]。铁与肿瘤细胞的增殖、凋亡关系密切,其可以影响人肺腺癌A549细胞的凋亡[2],在人类非小细胞肺癌中起到关键作用[3]。目前已有铁鳌合剂用于治疗肿瘤的研究报道[4]。虽然目前应用于临床的铁鳌合剂,去铁胺、去铁酮等对肿瘤细胞具有杀伤性,但是其血浆半衰期短,代谢迅速,口服吸收差,需要连续皮下或静脉输注长期给药等,患者依从性差,所以仍然需要寻找治疗肺癌有效、方便的药物。以铂类为基础的一线化疗方案治疗老年晚期NSCLC疗效较好[5]。本研究利用另一种高效口服的铁鳌合剂地拉罗斯、地拉罗斯联合顺铂作用肺腺癌细胞,以期提高癌细胞增殖抑制率及凋亡率,增强化疗药物的敏感性,旨在为肺癌治疗及研究方面奠定基础。

