席夫碱Ru(Ⅲ)配合物的合成及其与DNA的相互作用
余光勤,宋文婷,袁泽利,胡庆红,吴 庆,张铭钦,江 波
(遵义医学院药学院,贵州 遵义563003)
金属配合物因其在医药领域有着巨大的潜在药用价值而引起药物化学研究者的长期关注[1-2]。如已成功应用于临床的铂类药物对DNA结构造成损伤的作用机制,迄今为止没有任何有机药物可以模仿;此外,由于金属配合物具有不同的配位数和几何构型以及不同的热力学与动力学特性,易产生不同的氧化还原态,可利用其实现化学治疗与光动力治疗的双治疗功能[3]。铂类配合物型抗肿瘤药物临床应用广泛,而此类抗肿瘤药物易产生毒副作用(如神经毒性、肝毒性、肾毒性、耳毒性、骨髓毒性等)[3],严重制约了其实际疗效和适用范围,因此,人们继而研究具有不同作用机理的新型金属配合物用于抗癌药物筛选。
钌配合物作为非铂系金属配合物,已有文献报道了其低毒、易吸收及排泄快等特点[4];此外,钌配合物还具有易被肿瘤组织吸收的特性[5]。因而,钌配合物是国际公认的最具发展潜力的过渡金属配合物,有望成为继铂类配合物后的抗肿瘤活性高、毒性低的金属配合 物 型 抗 肿 瘤 药 物[4,6]。钌 配 合 物 [HIm][trans-RuCl4(DMSO)(Im)](NAMI-A)和 [HIm][trans-RuCl4(Im)2](KP1019)成功进入抗肿瘤临床试验[7-8],极大地激发了研究者们对钌配合物的研究热情[9-10]。金属配合物与生物大分子,尤其是与DNA相互作用的方式和机理,可为抗癌前药的初步筛选提供有用的信息,也有助于从分子水平了解抗癌药物的作用机理,为设计、合成低毒、高效的抗癌药物提供理论和实验基础,使药物的初步筛选更加有效[11]。因此,设计、合成金属配合物分子并研究其与DNA的相互作用具有重要意义。
席夫碱类配合物因具有许多优良的生物活性(如抑菌、杀菌、抗肿瘤、抗病毒等),其与生物大分子相互作用的研究多年来备受关注[12-14]。鉴于此,作者设计、合成具有席夫碱配体的Ru(Ⅲ)配合物(合成路线见图1),并在模拟生理条件(pH=7.40)下,通过荧光光谱法研究其与鲱鱼精DNA的相互作用,探讨它们之间的结合方式,以期为后续有关研究奠定理论和实验基础。
1 实验
1.1 试剂与仪器
三羟甲基氨基甲烷(Tris)、吖啶橙(AO)、鲱鱼精DNA、间苯二甲胺、2-羟基-1-萘甲醛、三氯化钌,百灵威试剂公司,均未经处理直接使用;实验用水均为二次蒸馏水。
北京谱析TU-1901型双光束紫外可见分光光度计;美国奥立龙868型pH计;德国Vario ELⅢ型元素分析仪;美国 Varian 1000型红外光谱仪;德国 MS HP-1100型质谱仪;美国 Agilent-400DD2型核磁共振仪;上海仪电雷磁DDS-307型电导率仪。
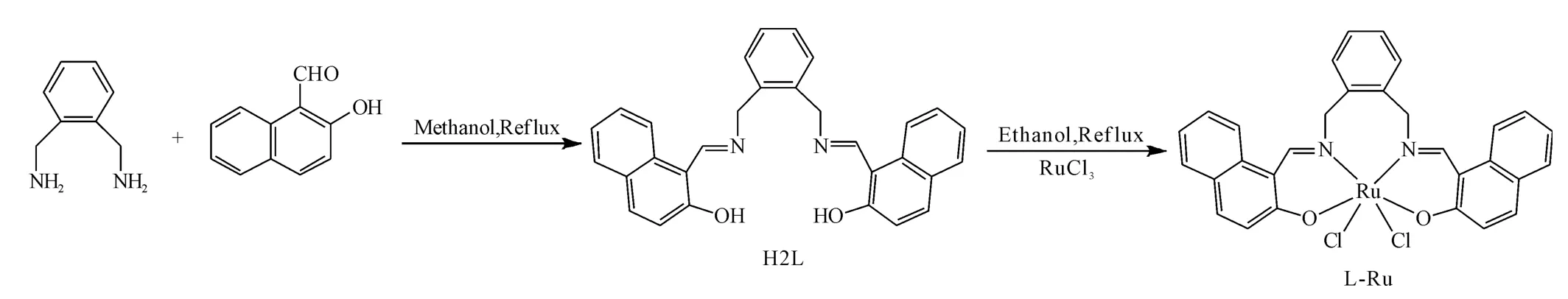
图1 席夫碱Ru(Ⅲ)配合物(L-Ru)的合成Fig.1 Synthetic route of Schiff base Ru(Ⅲ)complex(L-Ru)
1.2 配体(H2L)和配合物(L-Ru)的合成
称取0.81g(6mmol)间苯二甲胺溶于75mL无水甲醇中,再加入2.36g(14mmol)2-羟基-1-萘甲醛,溶解后加热回流4h,冷却,用无水乙醇洗涤2~3次,真空干燥,得黄色固体即配体(H2L),产率63.26%。
在50mL圆底烧瓶中加入0.87g(2mmol)H2L和25mL无水乙醇,溶解后缓慢滴加含0.52g(2 mmol)三氯化钌的乙醇溶液20mL(30min内滴完),加热回流1h,冷却后置于冰箱中过夜,抽滤,用少量的冰无水乙醇洗涤,真空干燥,得黑色粉末固体即配合物(L-Ru),产率31.33%。
1.3 H2L和L-Ru的表征
采用1HNMR、13CNMR、FTIR、MS及元素分析对H2L和L-Ru的结构及组成进行表征。
1.4 L-Ru与鲱鱼精DNA的相互作用研究
1.4.1 溶液配制
DNA溶液用Tris-HCl缓冲液(pH=7.40)配制,置于0~5℃冰箱中,备用。经紫外可见分光光度计测定其A260/A280大于1.8,说明该溶液纯度满足实验要求,基本不含蛋白质;根据其在260nm波长处的吸收系数6 600L·mol-1·cm-1可确定其浓度为2.409×104mol·L-1。
其余溶液用Tris-HCl缓冲液(pH=7.40)按浓度要求配制,置于0~5℃冰箱中,备用。
紫外测试中以pH=7.40的Tris-HCl缓冲液为空白。
1.4.2 L-Ru与鲱鱼精DNA的相互作用及热力学参数测定
考察在298K和308K下L-Ru溶液浓度对DNA的影响。在DNA溶液浓度不变的情况下,分别加入不同体积的L-Ru溶液,将L-Ru-DNA体系分别置于298K和308K的恒温水浴箱中反应20min,以pH=7.40的Tris-HCl缓冲液为空白,测定其荧光光谱,并计算其热力学参数。
1.4.3 L-Ru对 AO-DNA体系荧光光谱的影响
以与DNA具有嵌插作用的典型化合物吖啶橙(AO)为探针,用pH=7.40的 Tris-HCl缓冲液定容至刻度,摇匀,于298K的恒温水浴箱中反应20min,以pH=7.40的Tris-HCl缓冲液为空白,测定其荧光光谱,考察L-Ru与AO对DNA的竞争性。
1.4.4 NaCl、Na3PO4对 L-Ru-DNA 荧光光谱的影响
向一定浓度的L-Ru-DNA体系中分别加入一定量的NaCl或Na3PO4,于298K的恒温水浴箱中反应20min,以pH=7.40的 Tris-HCl缓冲液为空白,测定其荧光光谱。
2 结果与讨论
2.1 H2L和L-Ru的表征
H2L:1HNMR(CDCl3),δ:14.776(s,2H,OH),8.92(s,2H,CH=N),6.95~7.91(m,16H,Ar-H),4.83(s,4H,-CH2-);13CNMR(CDCl3),δ:158.78,137.71,136.64,133.26,129.03,127.75,126.89,126.39,123.55,122.77,117.97,57.73;FTIR(KBr),ν,cm-1:3 550,3 130,2 989,1 618,1 586,1 498,786;Anal.Calcd.for C30H26N2O2:C 80.69,H 5.87,N 6.27;Found C 80.63,H 5.95,N 6.18;MS(ESI),m/z:448[M+H]+。
1HNMR中,在δ8.9~9.0之间为席夫碱典型CH=N质子化学位移,说明了席夫碱的生成[15],而在FTIR中的1 618cm-1更进一步证实了这一官能团的生成[15]。
L-Ru:FTIR(KBr),ν,cm-1:3 150,1 625,1 595,1 500,785;Anal.Calcd.for C30H22N2O2Cl2Ru·2H2O:C 55.39,H 4.03,N 4.56;Found C 55.53,H 4.25,N 4.29;MS(ESI),m/z:580[M-2H2O-Cl-+H];Λm[(H2O∶DMSO)=1∶5(体积比),1.0×10-5mol·L-1,Ω-1·mol-1·cm2]:8.7。
结合质谱和元素分析结果,可以说明L-Ru的生成。此外,L-Ru的摩尔电导率很小,说明L-Ru中的Cl-与中心金属离子以配位形式而非离子形式存在,其为非电解质[16]。
2.2 L-Ru与鲱鱼精DNA的相互作用考察
2.2.1 L-Ru与鲱鱼精DNA的相互作用及热力学参数的测定
1)L-Ru与DNA的荧光光谱
荧光光谱是研究配合物与DNA相互作用的最常见和简便的方法[17]。如果配合物与DNA作用后出现了荧光增强或减弱现象,说明配合物与DNA发生了一定的作用。虽不能以此作为配合物与DNA发生嵌插或其它作用的直接判据,但荧光变化幅度的大小可反映出配合物与DNA之间是否发生作用及其作用的强弱。图2为L-Ru与DNA作用前后的荧光光谱图。
由图2可以看出,随着L-Ru的加入,DNA在551 nm处的荧光强度逐渐增强,说明L-Ru与DNA之间能够发生作用。
2)结合常数与热力学函数的测定
热力学函数可以考察化学反应在一定条件下能否发生。因此,通过考察吸光度与DNA浓度的关系(式1)[18],确定L-Ru能否与鲱鱼精DNA发生相互作用。


图2 不同浓度L-Ru与DNA的荧光光谱Fig.2 Fluorescence spectra of DNA in the presence of L-Ru at different concentrations
式中:A0和A分别表示DNA加入前后体系的吸光度;K为DNA与L-Ru的结合常数;c为DNA的浓度,μmol·L-1。
本实验分别对298K和308K时在260nm处测定的相对吸收强度按式(1)进行数据处理,以1/(A0-A)对1/c作图,结果见图3。

图3 在298K(a)和308K(b)下DNA体系在260nm处1/(A0-A)对1/c的双倒数曲线Fig.3 Double reciprocal curve of 1/(A0-A)vs 1/c for DNA system at 260nm in 298K(a)and 308K(b)
由 图 3 得 到 1/KD,298K=3.0925×10-5mol·L-1、1/KD,308K=3.1046×10-5mol·L-1,因此,结合常数分别为 KD,298K=3.234×104L·mol-1、KD,308K=3.221×104L·mol-1。
结合热力学公式,有:
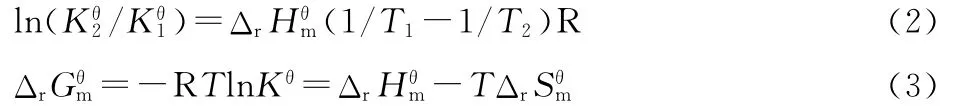
根据式 (2)、式 (3)可 计 算:298K 时,L-Ru 与DNA反应的焓变 ΔrHθm,298K=45.50kJ·mol-1、自由能 ΔrGθm,298K=-25.73kJ·mol-1及熵变 ΔrSθm,298K=0.23J·mol-1·K-1。由此可判定 L-Ru能与 DNA自发发生相互作用,且这种作用为熵与焓共同驱动所致。
2.2.2 AO对L-Ru-DNA体系的荧光光谱的影响
研究表明,AO系共轭稠环刚性平面分子,是一种碱性染料,能与DNA的双螺旋碱基对之间发生专一的嵌插作用[19],因而常常用作核酸的光谱探针。AO本身荧光性很弱,当与DNA作用后,由于生色团嵌插入碱基对中使其荧光性大大增强,在525nm处产生非常强的荧光信号。若某化合物与DNA发生了类似于AO与DNA的嵌插作用,在溶液体系中就会出现竞争,从而使得AO-DNA体系在525nm处的荧光强度发生变化,因而AO-DNA体系的荧光强度变化常常被用作判断某化合物是否与DNA发生嵌插的作用标志之一[19]。此外,传统的EB探针有致癌性、对环境污染大,故采用低毒的AO作为探针研究L-Ru与DNA的相互作用。
AO对L-Ru-DNA的荧光光谱的影响如图4所示。

图4 AO对L-Ru-DNA体系荧光光谱的影响Fig.4 Effect of AO on fluorescence spectra of L-Ru-DNA
由图4可以看出,L-Ru-DNA体系在551nm处有最大荧光发射峰,随着AO的逐渐加入,在525nm处出现了新的荧光发射峰,该峰为AO与DNA的典型峰[20-21]。且551nm处的荧光发射峰没有随着 AO的加入而完全消失,表明L-Ru与DNA具有较强的嵌插作用,即使与DNA具有很强的嵌插作用的AO也未能完全将其从DNA的双螺旋结构中挤出。
2.2.3 NaCl、Na3PO4对L-Ru-DNA荧光光谱的影响
为了进一步考察L-Ru与DNA之间是否存在静电作用,以强电解质NaCl和Na3PO4考察离子强度的增加对L-Ru与DNA之间的荧光强度的影响,结果见图5。
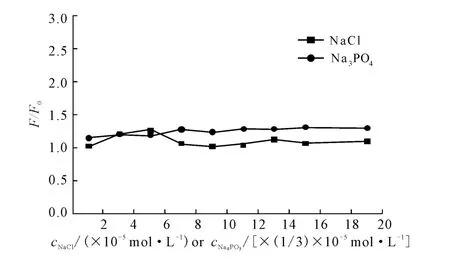
图5 NaCl和Na3PO4对L-Ru-DNA体系荧光光谱的影响Fig.5 Effect of NaCl and Na3PO4on fluorescence spectra of L-Ru-DNA
由图5可以看出,在开始加入NaCl时,体系荧光强度略有变化,继续加大离子强度时,荧光强度几乎未发生变化;体系中额外加入的磷酸根几乎没有引起体系荧光强度变化。说明L-Ru不与DNA的磷酸基团等负电荷基团发生静电作用,也证实了L-Ru确实不与DNA发生静电作用[22]。
3 结论
采用直接合成法合成了一个新的席夫碱Ru(Ⅲ)配合物,并利用1HNMR、13CNMR、FTIR、MS及元素分析等手段对其结构和组成进行表征。在模拟生理条件下,以吖啶橙为光谱探针,采用荧光光谱法考察LRu与鲱鱼精DNA的作用机制。结果表明,L-Ru与DNA之间能够自发地发生作用,这种作用是由熵与焓共同驱动而发生的嵌插作用。
[1]WANG Y L,LIU M Y,CAO R,et al.A soluble bis-chelated gold(Ⅰ)diphosphine compound with strong anticancer activity and low toxicity[J].J Med Chem,2013,56(4):1455-1466.
[2]LIU Z,SADLER P J.Organoiridium complexes:Anticancer agents and catalysts[J].Acc Chem Res,2014,47(4):1174-1185.
[3]王晓勇,郭子建.金属抗癌药物设计的新策略和新趋势[J].化学进展,2009,21(5):845-855.
[4]MESTRONI G,ALESSIO E,SAVA G,et a1.Water-soluble ruthenium(Ⅲ )-dimethyl sulfoxide complexes:Chemical behaviour and pharmaceutical properties[J].Met Based Drugs,1994,1(1):41-63.
[5]KEPPLER B K,FRIESEN C,MORITZ H G,et a1.Tumor-inhibiting bis(β-diketonato)metal complexes.Budotitane,cis-diethoxybis(1-phenylbutane-1,3-dionato)titanium(Ⅳ),the first transition metal complex after platinum complexes to qualify for clinical trials[J].Structure and Bonding,1991,78:97-127.
[6]刘利锋,李培源,钱全全,等.2-甲酰噻吩缩氨基硫脲及其芳基钌配合物的合成、结构与抗癌活性研究[J].有机化学,2013,33(4):854-859.
[7]SUSS-FINK G.Arene ruthenium complexes as anticancer agents[J].Dalton Trans,2010,39(7):1673-1688.
[8]HARTINGER C G,JAKUPEC M A,ZORBAS-SEIFRIED S,et al.KP1019,A new redox-active anticancer agent-preclinical development and results of a clinical phase/study in tumor patients[J].Chemistry Biodiversity,2008,5(10):2140-2155.
[9]HARTINGER C G,METZLER-NOLTE N,DYSON P Y.Challenges and opportunities in the development of organometallic anticancer drugs[J].Organometallics,2012,31(16):5677-5685.
[10]徐丽,陈禹,巫佳焕,等.钌多吡啶配合物与DNA作用及抗肿瘤活性[J].无机化学学报,2013,29(3):613-620.
[11]容智敏,郭奇峰,刘四红,等.新型钌(Ⅱ)配合物抑制骨肉瘤 MG-63细胞增殖并诱导其凋亡[J].中华显微外科杂志,2013,36(4):356-359.
[12]袁泽利,吴庆,杨兴变,等.新型含均三唑席夫碱型大环化合物的合成及其抗菌活性[J].有机化学,2011,31(10):1698-1702.
[13]XU H,ZHENG K C,CHEN Y,et al.Effects of ligand planarity on the interaction of polypyridyl Ru(Ⅱ)complexes with DNA[J].Daton Trans,2003,11:2260-2268.
[14]杨浩,陈文涛,邱东方,等.新型三齿多吡啶钴(Ⅱ)、钌(Ⅱ)配合物的合成、表征及其与DNA的作用研究[J].化学学报,2007,65(24):2959-2964.
[15]袁泽利,周承恩,吴庆,等.吡唑席夫碱化合物的合成及其生物活性研究[J].化学与生物工程,2012,29(3):37-39.
[16]袁泽利,胡庆红,吴庆,等.二氨基硫脲异双核席夫碱化合物的合成与表征[J].应用化工,2008,37(7):791-793.
[17]张玉霖,雷迪,陈莉.荧光光谱法研究盐酸二甲双胍与牛血清白蛋白的相互作用[J].化学与生物工程,2015,32(6):46-49.
[18]袁泽利,杨名慧,莫明贵,等.含均三唑席夫碱钛(Ⅳ)配合物的合成及其与 DNA 的相互作用[J].分析试验室,2013,32(11):38-41.
[19]赵娜,王兴明,王单,等.色氨酸-镝(Ⅲ)配合物与鲱鱼精DNA的作用方式[J].无机化学学报,2009,25(12):2129-2136.
[20]NAFISI S,SABOURY A A,KERAMAT N,et al.Stability and structural features of DNA intercalation with ethidium bromide,acridine orange and methylene blue[J].J Mole Structure,2007,827(1-3):35-43.
[21]袁泽利,杨名惠,易颜丹,等.分子光谱法研究新型抗肿瘤前药双(β-二酮)Ti(Ⅳ)与 DNA 相互作用[J].分子科学学报,2012,28(5):383-388.
[22]邓胜国,邓泽元,范亚苇,等.荷叶中紫云英苷和DNA相互作用的光谱学研究[J].光谱学与光谱分析,2010,30(2):476-480.
——勇敢者的游戏

