新型手性硫脲催化剂的合成与表征
李 文 马志伟 陶京朝 杨贯羽
(1.郑州大学化学系,河南 郑州 450001;2.河南牧业经济学院 质量检测与管理系,河南 郑州 450046)
1 硫脲类催化剂的研究进展
作为有机合成化学的一个重要分支,不对称合成及其方法学研究受到广泛重视并得以迅速发展[1]。
手性硫脲类催化剂因其具有独特的催化效果,倍受众多化学家的青睐。最初,利用硫脲基团具有较弱的Brφnsted 酸性,可以与底物通过氢键作用形成稳定的反应中间体,从而起到催化作用。随着有机催化剂研究的深入,同时受天然酶催化模式的启发,双功能硫脲催化剂被设计开发出来,并在各种不对称催化反应中得到了应用[2-4],并取得收率较高、对应性较强的化合物[5-6]。
2 硫脲类催化剂的合成与表征
2.1 伯胺-硫脲催化剂的合成
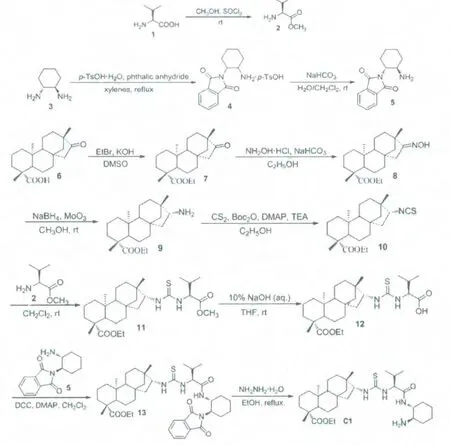
催化剂(Cl)的合成路线如图所示。
2.2 实验部分
2.2.1 主要反应试剂、测试仪器及条件
实验中所用试剂,如无特殊说明,均为直接购买的分析纯或化学纯产品。
熔点经XT5A 显微熔点测定仪测定, 温度计未经校正。红外光谱经Thermo Nicolet IR200 型红外光谱仪测定,KBr 压片。比旋光度经Perkin Elmer341 型旋光仪测定。核磁共振氢谱和碳谱经Bruker DPX 400(400MHz)型超导核磁共振仪测定,TMS 为内标。 高分辨质谱经Waters Micromass Q-Tof MicroTM 高分辨质谱仪用电喷雾离子源测定。
2.2.2 化合物的合成及结构鉴定
2.2.2.1 化合物2 的合成
将L-缬氨酸1 溶于甲醇中,然后在冰浴、搅拌条件下,向体系中滳加二氯亚砜。 室温搅拌过夜。 减压蒸除溶剂得L-缬氨酸甲酯盐酸盐。
将L-缬氨酸甲酯盐酸盐溶于二氯甲烷/饱和碳酸钠溶液的混合溶液中,室温搅拌过夜反应。 反应完成后,将体系转移到分液漏斗中,分出有机层,并用二氯甲烷萃取水层,合并有机层,无水Na2SO4干燥后,过滤、浓缩即得L-缬氨酸甲酯2,产率96%。
L-缬氨酸甲酯2 可不经纯化,直接用于下步反应。
2.2.2.2 化合物4 的合成
将(R,R)-反式环己二胺、一水合对甲苯磺酸和邻苯二甲酸酐加入甲苯中,回流分水10h。反应完全后,将体系冷至室温,抽滤,并用少量甲苯洗涤滤饼,得对甲苯磺酸盐4,收率97%。
2.2.2.3 化合物5 的合成
将对甲苯磺酸盐4 加入二氯甲烷/饱和碳酸氢钠溶液(V/V=1/1)的混合溶液中,室温搅拌过夜反应。 反应完成后,将体系转移到分液漏斗中,分出有机层,并用二氯甲烷萃取水层,合并有机层,无水Na2SO4干燥后,过滤、浓缩即得化合物5,产率86%。化合物5 可不经纯化,直接用于下步反应。
2.2.2.4 化合物7 的合成与表征
将异斯特维醇6 和KOH 加入DMSO 中,室温搅拌反应6h。 反应结束后,将体系倒入500mL 冰水中,边加边搅拌,产生大量固体,抽滤,并用冷水洗至无DMSO。 粗品经柱层析(乙酸乙酯/石油醚)分离后得白色固体产物异斯特维醇乙酯7,收率92%。
白色固体, 产率92%;m.p:125.0-126.8℃;1H NMR(400MHz,CDCl3):δ 0.77 (s,3H),0.84-1.07(m,4H),1.18(s,3H),1.22(s,3H),1.26(t,J=7.2Hz,3H),1.40-1.47(m,5H),1.58-1.88 (m,8H),1.99 (m,1H),2.17(m,1H),2.96(m,1H),4.10(q,J=7.2Hz,2H);IR(KBr,cm-1):ν 1146,1451,1730,2847,2926,2957;HR-MS(m/z):calcd.for C22H34O3Na[M+Na]+369.2406,found 369.2400。
2.2.2.5 化合物8 的合成与表征
将异斯特维醇乙酯7 溶于乙醇中, 而后加入盐酸羟胺和碳酸氢钠。 加热回流反应2h,反应完成后,蒸除体系中的溶剂,加入二氯甲烷与水萃取。 有机相用无水Na2SO4干燥后,过滤、浓缩即得化合物8,产率94%。 化合物8 可不经纯化,直接用于下步反应。
白 色 固 体, 产 率:96%;m.p.42.2-44.0℃;1H NMR(400MHz,CDCl3):δ0.77 (s,3H),0.84-1.09(m,4H),1.10(s,3H),1.18(s,3H),1.20-1.23(m,2H),1.26(t,J=7.1Hz,3H),1.39-1.48(m,4H),1.57-1.89(m,7H),2.00(m,1H),2.17(m,1H),2.97(m,1H),4.08(m,2H);IR(KBr,cm-1):ν 575,722,792,849,929,1028,1097,1152,1179,1233,1299,1320,1377,1450,1723,2847,2939,3306;HR-MS(m/z):calcd.for C22H35NO3Na[M+Na]+384.2515,found 384.2512。
2.2.2.6 化合物9 的合成与表征
将化合物5 溶于甲醇中,溶解完全后,向体系中加入三氧化钼。 冰浴搅拌条件下,向其中分批加入硼氢化钠,加毕,撤掉冰浴,室温反应过夜。 抽滤,并用少量甲醇洗涤滤渣;将滤液浓缩,向其中加入二氯甲烷和水,充分振摇后转入分液漏斗,分出有机相,水相用二氯甲烷萃取,合并有机相,无水硫酸钠干燥后,过滤、浓缩即得产品。 此步产品可不经纯化,直接用于下步反应。
白 色 固 体,收 率:77%;m.p.186-5-188.0℃;=-47.4 (c0.56,EtOH);1HNMR (400MHz,CDCl3)δ0.73(s,3H),0.84(s,3H),0.97-1.05(m,4H),1.16(s,3H),1.25(t,J=7.2Hz,3H),1.31-1.36 (m,6H),1.56-1.81 (m,9H),2.14-2.17 (m,1H),2.87-2.91 (m,1H),4.06-4.11(m,2H);13C NMR(CDCl3):δ 13.3,14.0,18.9,20.5,21.7,24.9,28.9,33.3,38.0,40.0,41.5,41.7,41.8,42.9,43.6,55.7,56.5,57.1,59.8,61.1,177.5,178.0;IR (KBr,cm-1):1048,1094,1151,1177,1231,1374,1451,1661,1722,2845,2939,3355;HR-MS(m/z):calcd.for C29H43N2O6[M+H]+348.2903,found 348.2904。
2.2.2.7 化合物10 的合成与表征
将化合物6 溶于乙醇中,溶解完全后,加入二硫化碳和三乙胺,室温搅拌30min。然后在冰浴条件下,依次向体系中快速加入Boc2O 和DMAP,搅拌反应5min 后,室温反应。 TLC 监测至反应完全后,浓缩体系得粗品,经柱层析分离(乙酸乙酯/石油醚)得纯品。
2.2.2.8 化合物11 的合成与表征
将L-缬氨酸甲酯2 和异硫氰酸酯10 溶于二氯甲烷中,室温搅拌反应过夜。 TLC 监测至反应完全后,直接浓缩体系得粗品,柱层析(硅胶,乙酸乙酯/石油醚)分离得纯品为白色固体。
2.2.2.9 化合物12 的合成
将化合物11 溶于四氢呋喃中,加入10%的NaOH 水溶液,室温搅拌5h。 浓缩体系,用稀盐酸调节pH<3,然后用乙酸乙酯萃取,合并有机相,并用饱和食盐水洗涤至水相呈中性;无水Na2SO4干燥后,过滤、浓缩即得产品,产率83%。
2.2.2.10 化合物13 的合成与表征
将化合物12 和5 溶于二氯甲烷中, 冰浴搅拌条件下,依次向体系中加入DCC 和DMAP(1%),反应过夜。 过滤,浓缩滤液得粗品,柱层析(硅胶,乙酸乙酯/石油醚)分离得纯品为白色固体。
2.2.2.11 伯胺-硫脲催化剂的合成与表征
将化合物13 加入乙醇中,而后加入水合肼,加热至回流反应2h。 反应完毕后,将体系降至室温,加入乙醚使邻苯二甲酰亚肼析出,过滤,滤液浓缩;再向其中加入少量乙醚,过滤,浓缩得产品。
3 结论
将异斯特维醇的优秀手性骨架,引入双功能手性胺-硫脲类催化剂的分子结构中,合成并予以表征。
[1]Metz,A.E.;Kozlowski,M.C.,Recent Advances in Asym metric Catalytic Methods for the Formation of Acyclic α,α -Disubstituted α-Amino Acids.J.Org.Chem.2015,80 (1),1-7.
[2]Zou,G.-F.;Pan,F.;Liao,W.-W.,Lewis base catalyzed asymmetric substitution/Diels-Alder cascade reaction: a rapid and efficient construction of enantioenriched diverse tricyclic heterocycles.Org.Biomol.Chem.2013,11 (41),7080-7083.
[3]Okino,T.;Hoashi,Y.;Takemoto,Y.,Enantioselective Mic hael Reaction of Malonates to Nitroolefins Catalyzed by Bifunctional Organocatalysts.J.Am.Chem.Soc.2003,125 (42),12672-12673.
[4]Wang,J.;Li,H.;Duan,W.;et al.Organocata lytic Asym metric Michael Addition of 2,4-Pentandione to Nitroo lefins.Org.Lett.2005,7 (21),4713-4716.
[5]Dong,X.-Q.;Fang,X.;Wang,C.-J.,Organocatalytic Asy mmetric Sulfa-Michael Addition of Thiols to 4,4,4-Trifluorocroto nates.Org.Lett.2011,13 (16),4426-4429.
[6]Wang,C. -J.,Dong,X. -Q.,Zhang,Z. -H.,et al.Highly anti-Selective Asymmetric Nitro-Mannich Reactions Catalyzed by Bifunctional Amine-Thiourea-Bearing Multiple Hydrogen-Bonding Donors.J.Am.Chem.Soc.2008,130 (27),8606-8607.

