毛细管柱气相色谱法测定水中碘化物
王琴琴 高帅鹏 李冬峰
(河南广电计量检测有限公司,河南 郑州 450001)
碘是一种重要的生物元素,是人体不可缺少的微量元素之一[1],研究表明,碘含量过高和过低都会造成机体不同性质及不同程度的生物学效应,即低碘、高碘的摄入都会致病[2-4]。目前,我国对碘化物的测定方法主要有硫酸铈催化分光光度法、高浓度碘化物比色法、高浓度碘化物容量法和气相色谱法[5]。比色法和容量法的检出限较高,适用于高浓度的样品,且所需试剂较多,过程繁琐。《生活饮用水标准检验方法》(GB/T 5750-2006)中的气相色谱法采用填充柱进行分离,柱效较低,分离效果不理想[6]。本文采用衍生化处理,毛细管气相色谱法,用电子捕获检测器(ECD)建立了一种水中碘化物的测定方法。
1 材料与方法
1.1 原理
在酸性条件下,水中碘化物与重铬酸钾发生氧化还原反应,析出的碘与丁酮生成3-碘-2-丁酮,用气相色谱法电子捕获检测器进行外标定量测定。
1.2 仪器和试剂
Agilent Technologies 7820A 气相色谱仪,电子捕获检测器(ECD),DB-1701石英毛细管色谱柱(30m×0.25mm×0.25μm),Sartorius pro-UV-T-TOC超纯水系统。
碘化钾、硫代硫酸钠、无水硫酸钠、重铬酸钾均为基准试剂;丁酮、硫酸为优级纯;实验用水均为无碘的去离子水。
1.3 色谱条件
DB-1701 石英毛细管色谱柱,载气(高纯氮气,纯度≥99.99%);柱流速为1.5ml/min;
柱温:由初始柱温60℃,以10℃/min 的速率升高至120℃保持1min;进样口温度为220℃,检测器的温度为320℃。进样方式:分流进样,分流比为10∶1,进样量:1μl。
1.4 测定方法
1.4.1 标准溶液的配置
100mg/L 碘化物储备液的配置:称取在105℃条件下烘干至恒重的碘化钾0.1308g,用无碘的去离子水溶解定容至1000ml,保存于棕色试剂瓶中。临用前将此储备液配置为100g/L的标准使用液。
1.4.2 工作曲线的配置
取5个60ml 的分液漏斗,分别加入0.10ml,0.30ml,0.50ml,0.70ml,1.00ml的标准使用液,再分别加去离子水至10ml,然后分别依次加入0.2ml 0.5g/L 的硫代硫酸钠,2.5mol/L 的硫酸0.1ml,1ml 0.5g/L 的重铬酸钾溶液,0.5ml的丁酮溶液。混匀后,放置20min,用10ml的环己烷分两次萃取后,合并萃取液并用无水硫酸钠脱水,定容至10ml待测。
1.4.3 水样的处理
摇匀水样,取均匀水样10ml 置于60ml 的分液漏斗中,处理方法同1.4.2 中工作曲线的处理方法,对水样进行衍生化处理。
2 结果与讨论
2.1 衍生剂的条件
2.1.1 衍生剂的选择
对丙酮与丁酮衍生化处理进行了对比分析,实验结果表明在相同条件下丁酮与碘的衍生物响应值较高,与文献结果一致,所以选择丁酮为衍生剂,衍生后产物为稳定的3-碘-2-丁酮[7,9]。
2.1.2 衍生剂浓度的选择
在酸性条件下,水中碘化物被重铬酸钾氧化为I2,I2与丁酮反应生成3-碘-2-丁酮[8]。重铬酸钾浓度对实验结果影响很大,浓度过高,Cr6+的存在可能会造成污染;浓度过低,碘化物不能被完全氧化为I2,造成试验误差。本文以10ug/L 的碘化物为基准,研究了重铬酸钾浓度对实验结果的影响,见图1。结果表明,在实验浓度范围内,随着重铬酸钾浓度的升高,目标物的峰面积也随之增大,而当浓度大于5g/L 后,目标物的峰面积增大显著放缓。综合考虑,本实验选择用5g/L的重铬酸钾进行实验。

图1 重铬酸钾浓度对3-碘-2-丁酮峰面积的影响
2.1.3 衍生化时间的影响
本文以10ug/L 的碘化物为基准,研究了衍生时间对目标物的影响,结果表明,随着衍生时间的延长,目标物3-碘-2-丁酮的面积增大,而当时间大于20min 后,目标物的峰面积基本不再增大。综合考虑,选择衍生化时间为20min。

图2 衍生时间对3-碘-2-丁酮峰面积的影响
2.2 色谱条件的选择
本实验采用的进样口温度为220℃,检测器的温度为320℃,尾吹气流量为25ml/min,对HP-5和DB-1701两种石英毛细柱在同等条件下的目标物分离效果进行对比测试,结果显示DB-1701毛细柱对目标峰分离度良好,干扰较少,响应值较高,故采用DB-1701毛细管柱进行实验分析。通过实验分析,发现当分流比为10:1 时,目标物3-碘-2-丁酮的峰形对称、尖锐,响应较高,出峰时间适宜。目标物3-碘-2-丁酮的色谱图见图3,保留时间为7.119min,溶剂环己烷的保留时间为2.022min。

图3 3-碘-2-丁酮的气相色谱图
2.3 线性范围与检出限
取1.3.2 中配制的标准系列,对前文所述的色谱条件测定3-碘-2-丁酮的峰面积作图,得到线性回归方程y=1057.8x+450.8。线性相关系数R=0.9996,线性范围1.0~10.0μg/L,以三倍信噪比计,本方法的检出限为0.001ng。
2.4 精密度与回收率
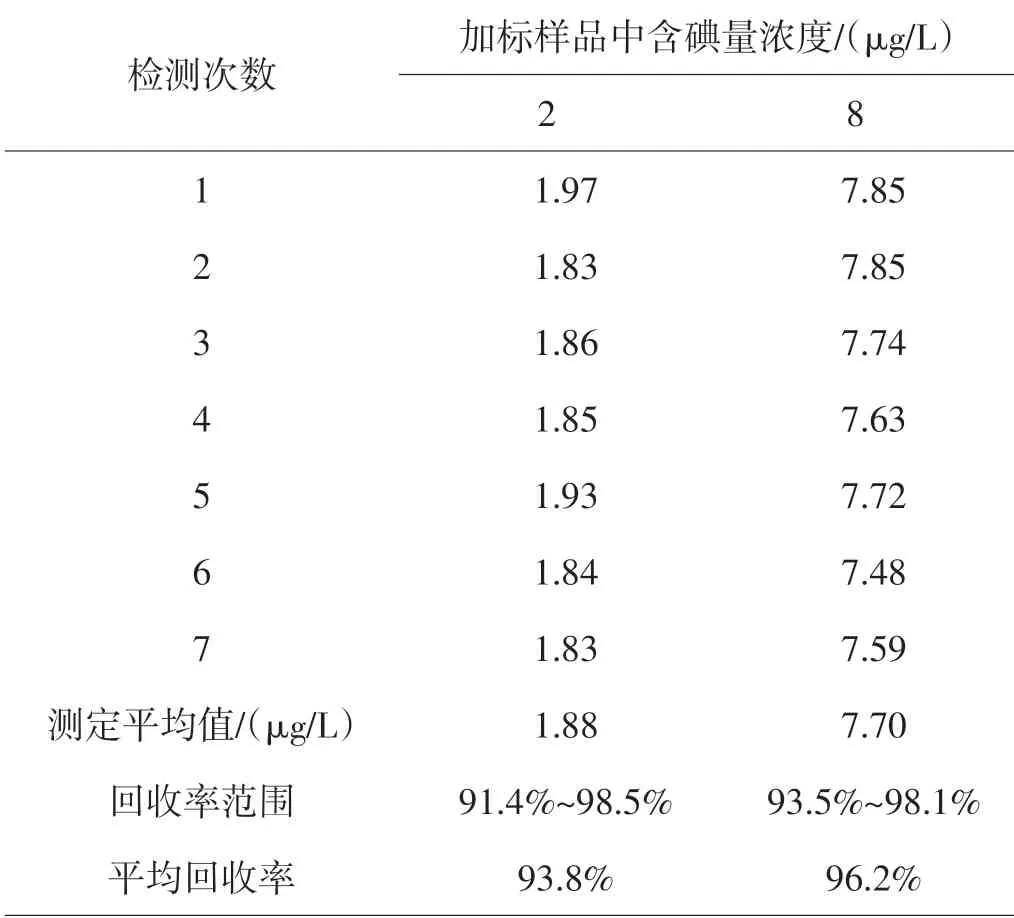
表1 毛细管柱气相色谱法测定水中碘化物回收率结果(n=7)

表2 毛细管柱气相色谱法测定水中碘化物精密度结果(n=7)
按照1.3.3 的方法同一水样分别进行两个不同浓度的加标衍生处理回收,回收率为91.4%~98.5%,见表1。连续测定7次的峰面积的相对标准偏差(RSD)为1.68%~2.44%,见表2。
3 结语
本文建立了丁酮衍生化处理水样,毛细管气相色谱和电子捕获检测器测定水中碘化物的实验方法。实验结果表明,该方法检出限为1μg/L,线性相关系数R=0.9996,相对标准偏差RSD 范围1.68%~2.44%,加标回收率范围为91.4%~98.5%。该方法检测限低,线性范围合理,操作简单、方便,适合水中碘化物的检测。
[1]何光涛,赵秋香,陈福强,等.高效液相色谱法测定碘盐中碘化物的含量[J].广州化工,2010,38(11):151-152.
[2]徐健.过量碘对甲状腺的影响及硒的干预作用研究[D].武汉,华中科技大学,2006.
[3]Peter L,Charlotte C,Lone B R,et al. Iodine intake as a determinant of thyroid disorders in populations[J]. Best Practice & Research Clinical Endocrinology & Metabolism,2010,24(1):13-27.
[4]Bernhard M,Heidi w. Charaterization of a rapid and reliable method for iodide biomonitoring in serum and urine based on ion chromatography-ICP-mass spectrometry[J].Journal of Trace Elements in Medicine and Biology,2015,29:63-68.
[5]国家环境保护总局.水和废水监测分析方法(第四版增补版)[M].北京:中国环境出版社,2013:197-199.
[6]中华人民共和国卫生部.生活饮用水标准检验方法[M].北京:中国标准出版社,2007:36-43.
[7]顾晓梅,王顺荣.以酮类为衍生剂气相色谱法测定碘的研究[J].中国科学院研究生院学报,1995,12(2):171-177.
[8]邓莲芬.气相色谱-电子捕获检测器法(GC-ECD)测定食品中的碘化物[J].中国卫生检验杂志,2008,18(8):1551-1627.
[9]Phillip SC,Purnendu K,Dasgupta. Review of analytical methods for the quantification of iodine in complex matrices[J].Analytica chimica acta,2011,702:16-36.

