丙二醛通过抑制Nrf2/ARE促进肾小球系膜细胞凋亡
赵 璐,孙俊波,金小琴
(河南中医学院第三附属医院 内分泌科, 河南 郑州 450008)
研究论文
丙二醛通过抑制Nrf2/ARE促进肾小球系膜细胞凋亡
赵 璐,孙俊波*,金小琴
(河南中医学院第三附属医院 内分泌科, 河南 郑州 450008)
目的探索丙二醛(MDA)对糖尿病肾病的影响机制。方法用终浓度为0、1、5、10和50 μmol/L的MDA处理肾小球系膜细胞(GMC),MTT法检测细胞活性,AnnexinV-FITC法检测细胞凋亡, RT-PCR和Western blot法检测Nrf2,HO- 1和γGCL表达。结果MDA 剂量依赖的抑制肾小球系膜细胞的活性。MDA浓度为5 μmol/L可诱导细胞内大量活性氧(ROS)产生(P<0.05),抗氧化剂tBHQ可缓解MDA诱导的细胞活性的下降。MDA抑制了抗氧化反应原件(ARE)HO- 1和γGCL的表达,以及Nrf2的表达水平(P<0.05)。结论MDA可通过抑制Nrf2/ARE来调控ROS生成,抑制肾小球系膜细胞的活性。
丙二醛;糖尿病肾病;肾小球系膜细胞;活性氧;Nrf2
肾小球系膜细胞(glomerular mesangial cell,GME)对维持肾小球毛细血管网的结构和功能的完整性具有重要的作用。肾小球硬化是导致糖尿病肾病(diabetic nephropathy,DN)的主要原因,然而GME的活性下降可加速肾小球硬化,是糖尿病肾病主要的发生机制[1- 3]。近期研究显示,在糖尿病肾病患者体内MDA水平上升,且与DN的发生和发展有密切联系[4]。MDA对肾小球系膜细胞的影响以目前
尚无报道。
1 材料与方法
1.1 材料
肾小球系膜细胞(GMC),接种自中国协和医科大学细胞保藏室。DMEM培养液(Gibco公司),胎牛血清(FCS)(杭州四季青公司)。丙二醛二乙缩醛、四甲基偶氮唑盐(MTT)和二甲基亚砜(DMSO)(Sigma公司)。
1.2 方法
1.2.1 细胞培养: 将GMC悬液接种于含有10%胎牛血清DMEM培养液的培养瓶中, 37 ℃、5% CO2培养箱培养。当细胞生长增殖至80%以上汇合时,可进行细胞传代。
1.2.2 丙二醛的配置: 丙二醛二乙缩醛,通过水解得到10 mmol/L母液。随后取0.125 mL,与2 mL浓度为1 mol/L的HCl充分混匀,并于40 ℃加热2 min。然后加入6 mol/L的NaOH,将pH定到7.4。
1.2.3 MTT检测细胞活性: 用液体培养基将细胞浓度调为1×104个/mL,然后于96孔板分别培养,每孔加入100 μL培养液。在96孔板中,细胞液中按照浓度为0、1、5、10和50 μmol/L的浓度加入MDA,每个梯度重复做3组,细胞培养96 h后,每孔中加20 μL MTT后继续培养3 h。将培养液离心后,弃上清,加人150 μL的培养液,于室温振荡10 min充分混匀,然后于490 nm波长下用酶标仪测定吸光度值(A)。每次实验平行重复3次。
1.2.4 Anex V-FITC检测细胞凋亡: 采用Annexin V-FITC法检测细胞凋亡,用0.25%胰蛋白酶消化肾小球系膜细胞,随后用PBS洗涤2次,3 000 r/min离心4 min,(1~5)×105个/L收集细胞。用700 μL结合缓冲液重悬,加5 μL Annexin V-FITC混匀,再加5 μL Propidium Iodide混匀。室温、避光孵育10~15 min,使用流式细胞仪分析结果。
1.2.5 ROS水平的测定: 取培养的细胞加入DMEM培养液中,培养24 h,根据需要将不同浓度的MDA加入24孔板48 h,PBS清洗后,加入含有DCFH-DA(2′, 7′-dichlorofluorescein diacetate) (10 μmol/L)探针的无血清培养基,避光孵育1 h。弃掉培养基,PBS清洗3遍,随后用含有MDA的培养液继续培养30 min。弃掉培养液,将细胞置于激发波长485 nm,发射波长530 nm处观察结果。
1.2.6 Western blot法检测: 将细胞弃去培养基,用4 ℃预冷的PBS缓冲液洗涤,加入200 μL预冷的裂解液,冰上放置20 min,4 ℃,12 000×g离心10 min,收集上清测即为总蛋白。取200 μg总蛋白,加入上样缓冲液至总体积为30 μL,SDS-PAGE电泳。半干转法将蛋白转移至聚偏二氟乙烯膜(PVDF)上,用5%脱脂奶粉在4℃下过夜孵育,随后用TBST洗涤3次,加入一抗37℃孵育1 h,再次用TBST洗3次,加入二抗。ECLA底物显色,红外线灯照射显影。
1.2.7 RT-PCR检测: 用Trizol试剂提取各组细胞总RNA,经反转录合成cDNA。随后用SYBR Green试剂盒进行反转录PCR,各组实验均重复3次并取其均值,具体操作步骤如下,1 μL 的cDNA,分别加入2 μL Nrf2,HO- 1和γGCL的上下游引物,加入缓冲液后,将终浓度定为10 μL,程序为,首次95 ℃预变性10 min,随后进行94 ℃变性10 s,58 ℃下15 s,72 ℃延伸15 s,循环30次,并以β-actin作为对照,结果以目的基因与内参吸光度的比值表示。Nrf2、HO- 1和γGCL的上下游引物分别为Nrf2: 5′-TCTC CTCGCTGGAAAAAGAA-3′,5′-ATTTCGTGTCGGTCG TGTAA-3′;HO- 1: 5′-CTGTGTAACCTCTGCTGTTCC-3′,5′-CCACACTACCTGAGTCTACC-3′;γGCL:5′-C CTTCTGGCACAGCACGTTG-3′,5′-TAAGACGGCATC TCGCTCCT-3′。
1.2.8 构建Nrf2过表达细胞: 首先将Nrf2全基因连接到穿梭载体,取对数期增殖的GMC配置细胞悬液,加入6孔板(约5×104个/孔),37 ℃,5% CO2培养1 h,加入含有Nrf2完整基因的腺病毒共培养3 d。取出,加入嘌呤霉素继续培养2 d筛选过表达Nrf2的细胞。含有Ad-GFP的空载体作为对照,并用基因测序进行鉴定。
1.3 统计学分析
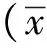
2 结果
2.1 MDA 剂量依赖的抑制GMC的活性
MDA剂量依赖的抑制GMC的活性(图1A,B)。与对照组(12%)相比,50 μmol/L MDA显著诱导了细胞的凋亡(41%)(图1C,D)。
2.2 MDA通过诱导ROS产生降低细胞活性
MDA剂量依赖的诱导活性氧(ROS)产生,MDA浓度大于5 μmol/L时,ROS生成量约为对照的1.7倍(P<0.05)(图2A)。在50 μmol/L MDA刺激细胞培养36 h时,ROS生成开始显著升高(P<0.05)(图2B)。MDA和tBHQ同时作用下,细胞活性显著上升(83%)(P<0.05)(图2C)。
2.3 MDA抑制抗氧化反应原件HO- 1和γGCL
MDA诱导下,HO- 1和γGCL表达下降(图3A)。此外,HO- 1和γGCL的mRNA 水平明显低于对照组(图3B)。
2.4 MDA通过抑制 Nrf2/ARE影响细胞活性
MDA诱导条件下,Nrf2的表达水平明显下降(图4A,B)。过表达Nrf2的细胞在MDA诱导条件下HO- 1和γGCL表达升高(P<0.05)(图4C)。过表达Nrf2能够明显抑制MDA诱导的活性氧的上升(图4D)。

A.MDA inhibits glomerular mesangial cell viability in a dose-dependent manner; B.MDA inhibits glomerular mesangial cell viability in a time-dependent manner; C.cell apoptosis was detected via PI staining and the annexin Ⅴ method after MDA stimulation, followed by flow cytometry; D.columns show the mean of data obtained from three independent experiments;*P<0.05 compared with control
图1 MDA剂量依赖的抑制GMC的活性和促进凋亡
Fig 1 MDA dose-dependently inhibits glomerular mesangial cell viability and promote apoptosis

A.MDA promotes ROS regeneration in a dose-dependent manner; B.MDA promotes ROS regeneration in a time-dependent manner; C.MDA inhibits cell viability;*P<0.05 compared with control
图2 MDA通过诱导ROS产生降低细胞活性
Fig 2 MDA inhibites cell viability by induction of ROS regeneration
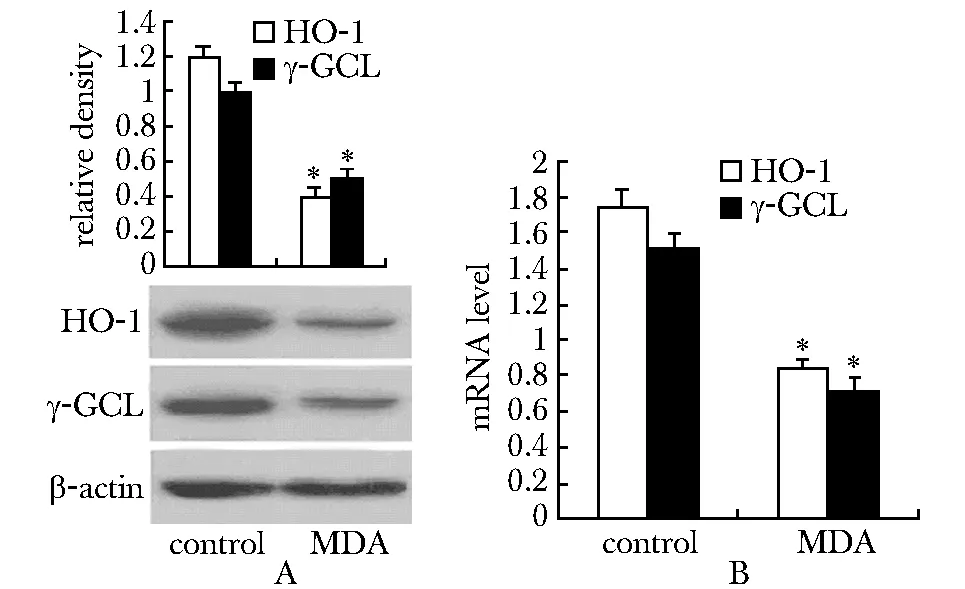
A.MDA inhibits the protein expression levels of HO-1 and γ-GCL; B.MDA inhibits the mRNA expression levels of HO-1 and γ-GCL;*P<0.05 compared with control图3 MDA抑制抗氧化反应原件HO- 1和γGCLFig 3 MDA inhibits expression of two antioxidant responsive elements-HO- 1 and γGCL
3 讨论
DN是糖尿病重要的并发症之一,是终末期肾衰以及糖尿病致死的主要原因之一[5]。近期研究发现,糖尿病患者MDA水平升高与糖尿病各种并发症的发生具有密切联系,是DN的独立危险因素[6]。但是MDA在DN发生和发展中的具体作用目前尚不清楚。
糖尿病肾病的主要原因之一是肾小球硬化,GMC活性的降低甚至凋亡是造成肾小球硬化的主要原因[7]。本研究发现MDA能够剂量依赖和时间依赖的抑制GMC的活性,并促进肾小球系膜细胞凋亡,提示MDA可通过影响GMC的活性,进而促进DN的发生。
氧化应激产物的过度表达常常是引起细胞DNA 损伤,细胞下降甚至凋亡的重要原因[8]。本研究发现MDA剂量依赖的诱导了ROS的产生,并且随着时间延长,ROS含量上升,加重细胞内氧化应激,提示MDA可通过加重细胞氧化应激影响细胞活性。tBHQ作为一种高效的抗氧化剂,能够有效降低细胞内ROS活性,且无细胞毒性作用。 tBHQ能够缓解MDA对细胞活性的抑制作用,提示MDA通过促进ROS,加重氧化应激抑制了细胞活性。
血红素氧化酶-1(HO- 1)能够通过抗氧化应激保护细胞免受氧化应激的损伤[9]。谷氨酰半胱氨酸合成酶(γ-GCS)对机体的抗氧化损伤具有重要调控作用[10]。在体内和体外,抗氧化反应原件(ARE)HO- 1和γGCL表达的上调,能够有效的保护ROS对细胞的氧化应激损伤[11]。本研究发现,MDA能够抑制HO- 1和γGCL表达,提示MDA通过抑制ARE,限制了细胞对氧化应急损伤的保护。

A.MDA inhibits the protein expression level of Nrf2; B.MDA inhibits the mRNA expression level of Nrf2; C.the protein expression levels of HO-1 and γ-GCL in MDA group and MDA+Nrf2 group; D.the ROS regeneration in MDA group and MDA+Nrf2 group;*P<0.05 compared with control图4 MDA通过抑制 Nrf2/ARE影响细胞活性Fig 4 MDA impacts cell viability by inhibition of Nrf2/ARE pathway
核因子NFE2相关因子2 Nrf2是机体在应对ROS损害重要的反应蛋白,具有激活ARE的作用[12]。本实验证实MDA显著抑制了Nrf2的表达水平,而过表达Nrf2可以缓解MDA对HO- 1和γGCL表达的抑制作用,同时提高细胞的活性,因而提示MDA主要通过抑制Nrf2表达,抑制了HO- 1和γGCL的表达,促进了细胞内ROS的产生。
综上,本实验证实MDA可通过抑制Nrf2/ARE通路促进ROS生成,诱导了GMC的凋亡。因此,本研究将为DN可能的发生机制提供线索,并为DN的防治提供可能的分子靶标。
[1] Rooney B, O’Donovan H, Gaffney A,etal. CTGF/CCN2 activates canonical Wnt signalling in mesangial cells through LRP6: implications for the pathogenesis of diabetic nephropathy[J]. FEBS Lett, 2011, 585, 531- 538.
[2] Taniguchi K, Xia L, Goldberg HJ,etal. Inhibition of Src Kinase Blocks High Glucose-Induced EGFR Transactivation and Collagen Synthesis in Mesangial Cells and Prevents Diabetic Nephropathy in Mice[J]. Diabetes, 2013, 62, 3874- 3886.
[3] Gopalakrishnan I, Iskandar SS, Daeihagh P,etal. Coincident idiopathic focal segmental glomerulosclerosis collapsing variant and diabetic nephropathy in an African American homozygous for MYH9 risk variants[J]. Hum Pathol, 2011, 42, 291- 294.
[4] 肖园园, 曾朝阳, 田晓年, 等. 2 型糖尿病肾病患者血清脂联素, 血管内皮生长因子水平与氧化应激的相关性[J]. 武汉大学学报: 医学版, 2012, 33, 228- 231.
[5] 李晓东, 周敏杰, 孙乐, 等. 灯盏细辛联合坎地沙坦酯对糖尿病肾病 Ⅳ 期中等量蛋白尿的疗效观察[J]. 中国中西医结合肾病杂志, 2009, 1101- 1102.
[6] Kaefer M, De Carvalho J, Piva S J,etal. Plasma malondialdehyde levels and risk factors for the development of chronic complications in type 2 diabetic patients on insulin therapy[J]. Clin Lab, 2011, 58, 973- 978.
[7] Barisoni L. Podocyte biology in segmental sclerosis and progressive glomerular injury[J]. Ad Chronic Kidney Dis, 2012, 19, 76- 83.
[8] 潘华珍, 冯立明, 许彩民,等. 丙二醛对红细胞的作用[J]. 生物化学与生物物理进展, 1984, 2, 34- 35.
[9] He M, Siow RC, Sugden D,etal. Induction of HO- 1 and redox signaling in endothelial cells by advanced glycation end products: a role for Nrf2 in vascular protection in diabetes[J]. Nutr, Metab Cardiovasc Dis, 2011, 21, 277- 285.
[10] Lu SC. Regulation of glutathione synthesis[J]. Mol Aspects Med, 2009, 30, 42- 59.
[11] Bergamo P, Maurano F, D’Arienzo R,etal. Association between activation of phase 2 enzymes and down-regulation of dendritic cell maturation by c9, t11-conjugated linoleic acid[J]. Immunol Lett, 2008, 117, 181- 190.
[12] Kim J, Cha YN, Surh YJetal. A protective role of nuclear factor-erythroid 2-related factor-2 (Nrf2) in inflammatory disorders[J]. Mutat Res/Fundam Mol Mech Mutagenesis, 2010, 690, 12- 23.
新闻点击
每天2餐有助减肥
据英国《BBC新闻》(BBC NEWS)2013-06-25报道,您也许曾听说“少量多餐”有助于减肥。但是现在有证据表明,“少量多餐”也许不是降低食欲的好方法,对有些人反而会导致增重。
美国糖尿病学会会议上发表的一项研究表明,患有二型糖尿病的患者如果每天只吃2餐,会比那些吃6顿饭但摄入相同热量的人减下更多体质量。
该研究的主持人卡列奥娃(Hana Kahleova)供职于布拉格临床与实验医学研究所。在她指导下,54名患者在12周内遵守两种不同的餐饮计划。一种是6顿饭,另外一种是2顿饭(早餐和中餐),但是患者摄入同样的营养和热量。
两种计划的参与者都减轻了体质量。但是只吃两餐的人减重更多。他们的身高体质量比(BMI)平均下降了1.23。每天吃6餐的人也减重,但是他们的平均BMI只下降了0.82。正常人的BMI应在18.5~24.9之间。在此研究中,平均BMI为32.6。
MDA accelerates the glomerular mesangial cell apoptosis through inhibition of Nrf2/ARE
ZHAO Lu, SUN Jun-bo*, JING Xiao-qin
(Dept. of Endocrinology, the Third Affiliated Hospital of Henan College of Traditional Chinese Medicine, Zhengzhou 450008, China)
Objective To explore the function of MDA on diabetic nephropathy. Methods Glomerular mesangial cells (GMC) were pretreated with MDA at a final concentrations of 0 μmol/L, 1 μmol/L, 5 μmol/L, 10 μmol/L and 50 μmol/L. MTT assay was used to examine the viability of GMC). AnnexinV-FITC was used to evaluate effect of MDA on cell apoptosis. RT-PCR and western blot were used to analyze the expression of Nrf2, HO- 1 and γGCL. Results MDA treatment inhibited GMC viability in a dose-dependent manner. MDA at the concentration of more than 5 μmol/L induced mass production of ROS in GMC (P<0.05). In addition, antioxygen of tBHQ may relieve MDA-induced reduction of cell viability. MDA inhibited the expression of HO- 1, γGCLand Nrf2 (P<0.05).Conclusions MDA inhibites GMC viability and promotes the cell apoptosis by ROS production through inhibiting Nrf2/HO- 1-γGCL.
malondialdehyde; diabetic nephropathy; glomerular mesangial cell; ROS; Nrf2
2014- 04- 01
2014- 08- 25
1001-6325(2015)01-0069-05
R363
A
*通信作者(corresponding author):13838099075@139.com

