miRNA- 449a在人肺癌及癌旁组织中的差异表达
林剑勇,邓益斌,罗艳红,陆小婵,黄永秩
(右江民族医学院 附属医院 1.呼吸内科; 2.检验科; 3.临床病理科, 广西 百色 533000)
研究论文
miRNA- 449a在人肺癌及癌旁组织中的差异表达
林剑勇1,邓益斌2*,罗艳红2,陆小婵3,黄永秩3
(右江民族医学院 附属医院 1.呼吸内科; 2.检验科; 3.临床病理科, 广西 百色 533000)
目的探讨miRNA- 449a在人肺癌及癌旁组织中的表达差异及其临床意义。方法右江民族医学院附属医院2011- 01- 01—2013- 06- 30收治的肺癌患者58例,对照组为癌旁正常组织,病例组为鳞癌组织和腺癌组织,并根据miRNA- 449a序列结构设计合成miRNA- 449a模拟物,设10和20 mg/mL两个不同浓度,以0 mg/mL为阴性对照,用real-time PCR检测肺癌及其对应癌旁组织中miRNA- 449a的表达; 化学发光技术检测细胞内荧光素酶基因表达; 四甲基偶氮唑蓝法检测细胞活性。结果鳞癌组和腺癌组的miRNA- 449a的表达量为1.48±1.63和1.52±1.54,均显著低于癌旁正常对照组的2.74±1.55(P<0.01),且与瘤体大小有关(P<0.05)。10和20 mg/mL 组细胞内的平均荧光强度为2 115±168和1 352±159,均显著低于阴性对照组的4 975±115(P<0.01),且抑制作用随浓度增加呈递增趋势。结论miRNA- 449a在肺癌组织中呈低表达,可下调细胞内荧光蛋白表达和诱导细胞凋亡。
肺肿瘤; miRNA- 449a; 肿瘤标志; 聚合酶链反应; 荧光定量
肺癌是中国及全球范围内发病率最高的恶性肿瘤之一[1- 2]。绝大部分患者被发现时已是中晚期,经治疗后5年生存率不到20%[3- 5],主要原因是缺少早期诊断方法。microRNA(miRNA)是近年来新发现的一种内源性、非编码单链小分子RNA,长度约为20~25个核苷酸,主要与靶基因mRNA的非编码区或编码区不完全互补结合,促使靶基因mRNA降解或抑制转录后蛋白翻译过程有关,并在细胞的生长、增殖、凋亡和分化方面扮演着重要角色[6- 7]。miRNA 的异常表达与肿瘤的发生发展密切相关,可作为新的肿瘤标志物[8]。miRNA- 449a是5号染色体上miRNA- 449的编码产物之一,有资料表明其与结直肠癌、肝癌和卵巢癌等癌症显著相关[9],但其在肺癌组织中的表达情况及其意义尚不清楚,因此,本研究拟采用real time PCR检测肺癌及其对应癌旁组织中miRNA- 449a的表达量,并采用荧光电子显微镜技术和MTT实验检测其模拟物对人肺癌细胞系95D细胞凋亡的影响,进一步探讨其临床应用价值。
1 材料与方法
1.1 标本来源
收集2011- 01- 01—2013- 06- 30右江民族医学院附属医院收治并确诊的肺癌患者58例作为研究对象,年龄32~73岁,平均年龄52.5岁,中位年龄56岁。男40例,女18例。鳞癌22例,腺癌36例; 年龄≥50岁42例,年龄<50岁16例; 瘤体≥5 cm 38例,瘤体<5 cm 20例,取肺癌组织及远端对照正常组织(距癌组织>5 cm)。所有肺癌患者术前均未做放疗、化疗及其他针对肿瘤的治疗。标本留取前已经医院伦理委员会批准,并由患者签署知情同意书。全部标本手术后30 min内保存于液氮中。
1.2 细胞培养
人肺癌细胞系95D细胞(ATCC细胞库)用10%胎牛血清(含氨基酸和葡萄糖)的培养基于37 ℃、5% CO2湿化培养箱中培养。
1.3 主要试剂
Tizol试剂盒和LipofectaminTM2000等(Invitrogen公司); 反转录荧光定量PCR试剂盒(上海生工生物工程股份有限公司); Annexin V-FITC细胞凋亡检测试剂盒(南京凯基生物技术有限公司); 引物及miRNA- 449a模拟物的设计与合成(上海生工生物工程股份有限公司);化学发光试剂盒(Bright-GloTM荧光素酶分析系统)(Promega公司)。
1.4 RT-PCR检测miRNA- 449a
1)RNA提取:从液氮中取组织约500 mg,采用Tizol试剂提取总RNA,利用紫外分光光度计检测提取RNA浓度和纯度,当A260/A280比值为1.8~2.1认为提取的RNA纯度合格。并采用1%琼脂糖凝胶电泳法鉴定RNA的完整性,当28 S/18 S亮度比值>2.0认为提取的RNA完整性良好。
2)miRNA- 449a表达检测:采用real time PCR技术,以U6为内参。U6反转录引物为5′-GTCGT ATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATAC GACAAAATATGGAACTGC-3′,上游引物为5′-GGG TGCTCGCTTCGGCAGC-3′,下游引物为5′-CAGTGC AGGGTCCGAGGT-3′。采用反转录引物,把总RNA反转录为cDNA,其反应体系为:10×反转录缓冲液1.5 μL,100 nmol/L dNTPs 0.15 μL,反转录酶1.0 μL,RNase抑制剂0.19 μL,反转录引物3.0 μL,总RNA 5.0 μL,加DEPC(焦碳酸二乙酯)水至15 μL,轻轻混匀后,16 ℃,30 min; 42 ℃,60 min; 85 ℃,5 min; 4 ℃,保存。荧光定量PCR检测反应体系为:2×PCR缓冲液10 μL,20×miRNA- 449a特定引物和荧光探针1 μL,反转录产物1 μL,加DEPC水至20 μL,置ABI 7500荧光PCR仪上按照95 ℃ 5 min,95 ℃ 15 s,60 ℃ 45 s反应40个循环,采集数据分析结果。
1.5 化学发光技术检测细胞内荧光素酶基因表达
采用化学发光技术检测,严格按照试剂和仪器说明书操作,输出值以每秒周数(CPS)表示。
1.6 MTT法检测miRNA- 449a模拟物对细胞的毒性
采用四甲基偶氮唑盐(MTT)比色法检测miRNA- 449a模拟物对细胞活性的影响。
1.7 统计学分析
2 结果
2.1 RNA纯度与miRNA- 449a的表达
A260/A280比值为2.06,A260/A230比值为2.21,28 S、18 S条带清晰,28 S/18 S亮度比值大于2.0(图1)。鳞癌组和腺癌组的miRNA- 449a表达量分别为1.48±1.63和1.52±1.54,均显著低于癌旁正常对照组的2.74±1.55(P<0.05)。

图1 RNA琼脂糖凝胶电泳图Fig 1 RNA agarose gel electrophoresis
2.2 miRNA- 449a表达与临床病理特征关系
miRNA- 449a表达与瘤体大小有关(P<0.05),与其他病理特征无关(表1)。
表1 miRNA- 449a表达与临床病理特征关系

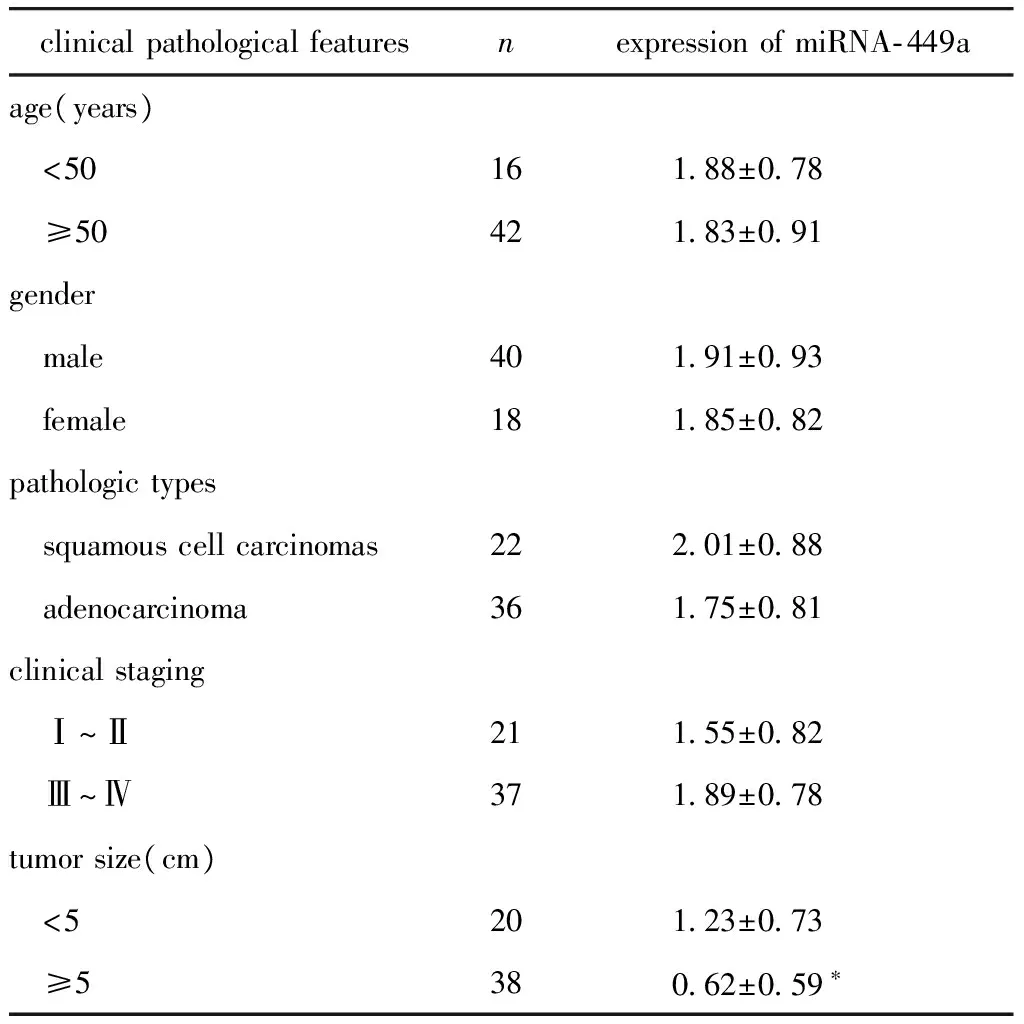
clinicalpathologicalfeaturesnexpressionofmiRNA⁃449aage(years) <5016188±078 ≥5042183±091gender male40191±093 female18185±082pathologictypes squamouscellcarcinomas22201±088 adenocarcinoma36175±081clinicalstaging Ⅰ~Ⅱ21155±082 Ⅲ~Ⅳ37189±078tumorsize(cm) <520123±073 ≥538062±059∗
*P<0.05 compared with tumor size <5 cm.
2.3 miRNA- 449a模拟物对细胞内荧光素酶基因表达的影响
10和20 mg/mL 组细胞内的平均荧光强度为2 115±168和1 352±159,均显著低于阴性对照组(4 975±115)(P<0.05),且抑制作用随浓度增加呈递增趋势。
2.4 miRNA- 449a模拟物对细胞活性的影响
转染48 h后,采用MTT比色法测定各组吸光度值A,结果显示:10 和20 mg/mL组的A值分别为0.71±0.54和0.45±0.38,均明显低于阴性对照组的1.35±1.02(P<0.05)。
3 讨论
肺癌是一种多基因疾病,其发生、发展是多因素参与、多种相关基因失活共同作用的结果,是高发病率和高死亡率的癌症之一,也是预后较差的癌症之一。miRNA是一类长约20~23 nt的可调控基因表达的高度保守非编码小RNA,在肿瘤发生、发展和转移中起着促进或抑制的作用。miRNA- 145、miRNA- 34a、miRNA- 212和miRNA- 182等可通过上调凋亡蛋白的表达,诱导肿瘤细胞凋亡,从而阻遏肿瘤细胞的生长[10- 13]。此外,还发现肺癌患者血清中miRNA- 21的表达显著高于良性肺部疾病患者及健康体检者[14]。据此推测,miRNA可能作为一种潜在的肿瘤基因诊断与治疗研究的靶标[9]。
本研究结果表明,miRNA- 449a在肺癌组织中的表达水平显著低于癌旁正常组织,且与瘤体大小有关,与年龄、性别、临床病例类型等无关,提示miRNA- 449a参与了肺癌的发生、发展过程,可能是一个潜在的抑癌因子。阳离子脂质体介导体miRNA- 449a模拟物转染肺癌细胞系95D细胞,发现miRNA- 449a模拟物能有效下调细胞内荧光蛋白的表达强度,且呈剂量效应。同时,荧光电子显微镜下观察还发现,miRNA- 449a模拟物能够明显诱导肺癌细胞的凋亡,且随剂量增高细胞凋亡数呈上升趋势,提示miRNA- 449a可能通过下调靶蛋白表达及诱导细胞凋亡来发挥抑制癌细胞增殖的作用。但miRNA- 449a作为肺癌的早期诊断标志,仍有待于进一步利用ROC曲线来评价其诊断肺癌的灵敏度和特异度。鉴于本研究所纳入样本量有限,仍存在偶然误差的可能,因此,有待进一步在动物实验中加以验证。
综上所述,miRNA- 449a可能通过下调肺癌细胞内靶蛋白的表达及诱导细胞凋亡来发挥抑制癌细胞增殖的作用,其可能成为肺癌早期诊断与治疗的靶分子。
[1] Jemal A, Bray F, Center M. Global cancer statistics [J]. Cancer J Clin, 2011, 61: 69- 90.
[2] Chen WQ, Zheng RS, Zhang SW,etal. Report of incidence and mortality in china cancer registries, 2008 [J]. Chin J Cancer Res,2012,24: 171- 180.
[3] Voon PJ, Chul Cho B, Yeo WL,etal. The role of epidermal growth factor receptor tyrosine kinase inhibitors in the treatment of advanced stage non-small cell lung cancer [J]. J Thorac Dis, 2010, 2:144- 153.
[4] Carillio G, Montanino A, Costanzo R,etal. Cetuximab in non-small cell lung cancer [J]. Expert Rev Anticancer Ther, 2012, 12:163- 175.
[5] Vander Drift MA, Karim-Kos HE, Siesling S,etal. Progress in standard of care therapy and modest survival benefits in the treatment of non-small cell lung cancer patients in the Nether-lands in the last 20 years [J]. J Thorac Oncol, 2012, 7: 291- 298.
[6] Guo H, Ingolia NT, Weissman JS,etal. Mammalian microRNAs predominantly act to decrease target mRNA levels [J]. Nature, 2010, 466: 835- 840.
[7] Lujambio A, Lowe SW. The microcosmos of cancer [J]. Nature, 2012, 482: 347- 355.
[8] Chin LJ, Slack FJ. A truth serum for cancer-microRNAs have major potential as cancer biomarkers [J]. Cell Res, 2008, 18:983- 984.
[9] Yang X, Feng M, Jiang X,etal. MiRNA- 449a and miRNA- 449b are direct transcriptional targets of E2F1 and negatively regulate pRb-E2F1 actively through a feedback loop by targeting CDK6 and CDC25A [J]. Genes Dev, 2009, 23: 2388- 2393.
[10] Cho WC, Chow AS, Au JS. Restoration of tumor suppressor has-miR- 145 inhibits cancer cell growth in lung adenocarcinoma patients with epidermal growth factor receptor mutation [J]. Eur J Cancer, 2009, 45:2197- 2206.
[11] Duan W, Gao L, Wu X,etal. MicroRNA- 34a is an important component of PRIMA- 1-induced apoptotic network in human lung cancer cells [J]. Int J Cancer, 2010, 127: 313- 320.
[12] Incoronato M, Garofao M, Urso L,etal. MiR- 212 increase tumor necrosis factor-related apoptosis-inducing ligand sensitivity in non-small cell lung cancer by targeting the anti-apoptotic protein PED [J]. Cancer Res, 2010, 70: 3638- 3646.
[13] 徐彪,夏伟,邵宁生,等. 肺鳞癌组织Has-miR- 182差异表达的研究 [J].中华肿瘤防治杂志,2013,20:1225- 1228.
[14] 胡俊庭,鲍蕴文,白艳,等. 肺癌患者血清miRNA- 21表达临床意义探讨 [J]. 中华肿瘤防治杂志,2014,21:39- 42.
Different expression of miRNA- 449a in lung cancer and precancerous tissue
LIN Jian-yong1, DENG Yi-bin2*, LUO Yan-hong2, LU Xiao-chan3, HUANG Yong-zhi3
(1.Dept. of Respiratory Medicine; 2.Central Laboratory; 3.Dept. of Clinical Pathology, Affiliated Hospital of Youjiang Medical College for Nationalities, Baise 533000, China)
Objective To investigate the expression and biological function of miRNA- 449a in lung cancer. Methods A case-control study was conducted in 58 patients diagnosed with lung cancer(carcinoma and adenocarcinoma) and normal tissue closely adjacent to tumor. MiRNA- 449a simulation was designed and synthesized, was dissolved into two different concentrations as 10 and 20 mg/mL. The expression of miRNA- 449a in lung cancer tissues and matched normal tissues were detected by Real time PCR. The expression of luciferase gene was detected by chemiluminescence technique. MiRNA- 449a mimics on cell apoptosis was evaluated by MTT assay. Results The mean tissues expression levels of miRNA- 449a in squamous carcinoma group and adenocarcinoma group were 1.48±1.63 and 1.52±1.54 respectively, and were significantly lower than in control group(2.74±1.55)(P<0.01). The average intensity of fluorescent protein in 10 mg/mL group and 20 mg/mL group were 2 115±168 and 1 352±159 respectively, and were significantly lower than that in control group(4 975±115)(P<0.01). Conclusions MiRNA- 449a was down-regulated expression in lung cancer and induced apoptosis.
lung neoplasms; miRNA- 449a; tumor biomarker; polymerase chain reaction; fluorogenic quantitative
2014- 06- 20
2014- 08- 25
广西自然科学基金(2011GXNSFA0198215)
1001-6325(2015)01-0044-04
R961
A
*通信作者(corresponding author):dengyb75@163.com

