茶多酚对卵巢癌SKOV3细胞自噬水平的影响及相关机制研究
詹 欣 张玲云 王志华
茶多酚对卵巢癌SKOV3细胞自噬水平的影响及相关机制研究
詹 欣 张玲云 王志华
目的研究茶多酚(EGCG)对人卵巢癌SKOV3细胞自噬水平的影响及相关机制。方法用EGCG处理SKOV3细胞,Western blot检测自噬相关蛋白LC3-II及蛋白激酶B(PKB)信号通路相应蛋白表达变化。结果EGCG处理SKOV3细胞后,自噬相关蛋白LC3-II表达上调,并呈一定的时间浓度依赖性。EGCG处理SKOV3细胞后,AKT的磷酸化水平下调,AKT激活剂胰岛素样生长因子1(IGF-1)预处理后,自噬相关蛋白LC3-II高表达被抑制。结论EGCG通过AKT介导的信号通路诱导SKOV3细胞自噬水平升高。
卵巢癌;SKOV3细胞;茶多酚;PKB;自噬
茶多酚是从茶叶中提取的主要活性成分之一,目前研究表明其具有多种药理作用[1]。自噬(autophagy)是细胞在应激状态下通过降解损伤细胞器或代谢产物促进细胞存活的防御机制[2],自噬水平升高时,胞浆型微管相关蛋白1的轻链3(microtubule-associated protein 1 light chain 3,LC3),即 LC3-I,会转变为膜型LC3,即LC3-II,故本研究以自噬相关蛋白LC3-II作为评估自噬水平高低的标准。自噬在肿瘤的发生发展及治疗过程中起着非常重要的作用[3]。研究[4]表明,茶多酚能够诱导卵巢癌细胞凋亡率增加。本研究观察茶多酚对卵巢癌SKOV3细胞自噬水平的影响及其相关信号通路,为临床卵巢癌治疗提供新的思路及靶点。
1 材料与方法
1.1 药物与试剂 人卵巢癌SKOV3细胞购自上海中科院细胞研究所;抗LC3-B多克隆抗体购自Novus公司;蛋白激酶 B(protein kinase B,PKB)多克隆抗体、磷酸化蛋白激酶B(phospho-protein kinase B,p-AKT)多克隆抗体均购自Cell Signaling公司;抗GAPDH单克隆抗体购自Santa Cruz公司;IMDM培养基、胰蛋白酶购自美国HyClone公司;胰岛素样生长因子(IGF-1)购自R&D公司;胎牛血清购自四季青公司;3-MA购于Sigma公司。
1.2方 法
1.2.1 人卵巢癌SKOV3细胞培养 人卵巢癌SKOV3细胞用含10%胎牛血清的IMDM培养基,在37℃,5%CO2的培养箱中常规培养。0.25%胰酶(含EDTA)消化传代。培养24h后进行实验处理。
1.2.2 Western blot检测蛋白量变化 Western blot检测蛋白LC3、p-AKT、AKT的变化。收集SKOV3细胞后,用RIPA裂解液冰上裂解30min,13 000g离心10min,吸取上清,BCA法蛋白定量。与5×样品缓冲液混合后,煮沸 6min。取样品(40μg)进行 SDS-聚丙烯凝胶电泳,然后转印至PVDF膜上。5%脱脂牛奶封闭1h,相应的一抗4℃孵育过夜,TBS-T洗10min×3次,加入含辣根过氧化物酶标记的二抗室温孵育1h,ECL法显色曝光,图像采用LAS-4000-mini化学发光成像系统进行灰度值分析。
1.3 统计学方法 应用SPSS16.0软件进行统计分析,组间比较采用单因素方差分析,两组之间比较采用t检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 EGCG诱导SKOV3细胞自噬 用不同浓度(0、10、20μg/mL)EGCG 处理 SKOV3 细胞 2h,0μg/mL 组作为对照组,可以观察到自噬相关蛋白LC3-II的表达量增加,并呈一定浓度依赖性(n=3,P<0.05,见图1A)。在不同时点(0、1、2、6h)20μg/mL EGCG 处理SKOV3细胞,以0h为对照组,随着时间变化,自噬相关蛋白LC3-II的表达量先升高后下降,峰值出现在1~2h(n=3,P<0.05,见图 1B)。以上结果表明 EGCG能诱导SKOV3细胞自噬水平升高,并呈一定的浓度和时间依赖性。
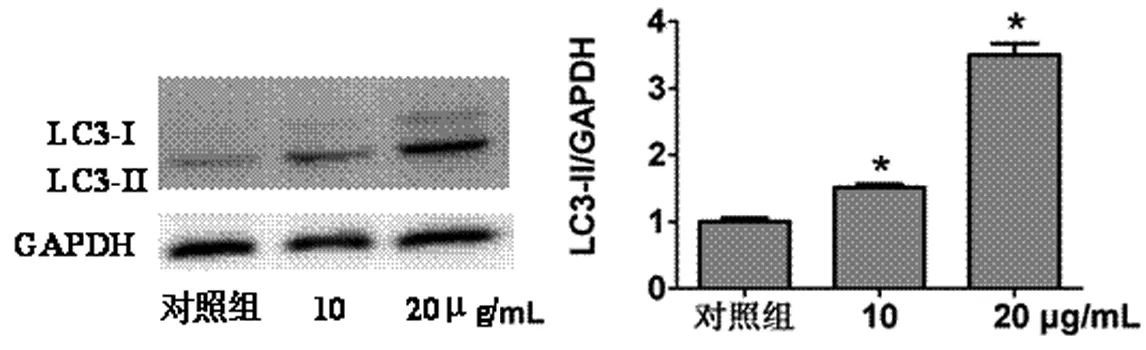
图1A EGCG诱导SKOV3细胞自噬相关蛋白LC3-II表达量与浓度的关系
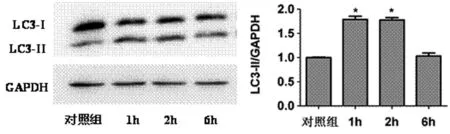
图1B EGCG诱导SKOV3细胞自噬相关蛋白LC3-II表达量与时间的关系
2.2 AKT信号通路在EGCG诱导SKOV3细胞自噬过程中的作用 EGCG刺激SKOV3细胞之后,p-AKT和的表达水平随着作用时间的延长而下降,并在30或 60min时达最低值(n=3,P<0.05,见图 2A,以0min为对照组)。表明在SKOV3细胞中,EGCG可以抑制AKT信号通路。为进一步明确AKT信号通路在EGCG诱导的内皮细胞自噬中的作用,用AKT激活剂 IGF-1(insulin-like growth factor 1,200ng/mL)激活AKT信号通路,以未处理为对照组,IGF-1对SKOV3细胞LC3-Ⅱ的表达无影响(n=3,P>0.05,见图2B),EGCG处理组LC3-II的表达明显增加(n=3,P<0.05,见图2B),IGF-1提前2h预处理组能显著抑制EGCG诱导的SKOV3细胞自噬相关蛋白LC3-Ⅱ的表达(n=3,P<0.05,见图 2B),表明 AKT 信号通路在 EGCG 诱导SKOV3细胞自噬的过程中起着重要作用。

图2A EGCG抑制AKT信号通路与时间的关系
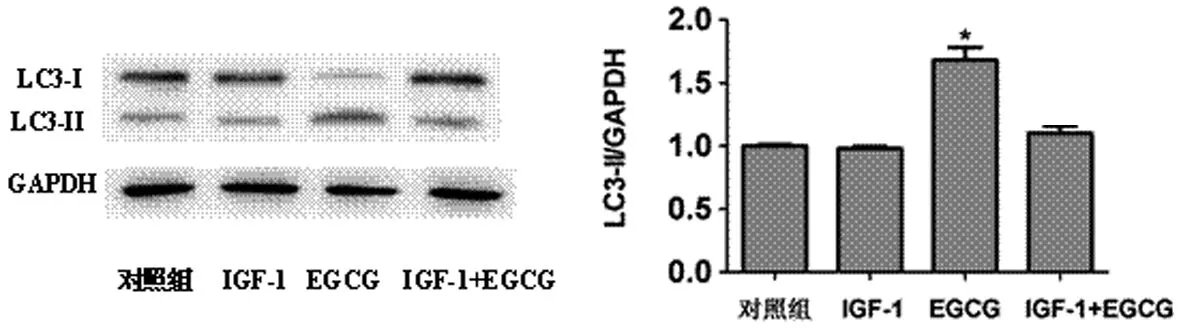
图2B AKT信号通路在EGCG诱导SKOV3细胞自噬中的作用
3 讨 论
茶多酚是从茶叶中提取的重要活性成分之一,研究[5]表明,其具有抗肿瘤作用,能够促进肿瘤细胞凋亡,抑制其增殖和迁移。付春红等[4]研究表明,茶多酚对SKOV3细胞的生长有明显抑制作用并能够诱导SKOV3细胞凋亡,推测活性氧(reactive oxygen species,ROS)水平的增高可能是导致卵巢癌SKOV3细胞凋亡的原因。
自噬是广泛存在的一种生命现象,细胞在应激状态下形成自噬体膜,包裹损伤细胞器或代谢产物,并与溶酶体结合成自噬溶酶体,最后降解包裹内容物,以维持细胞本身代谢需要及细胞器的更新,对细胞在不利环境下的存活有重要意义[6]。有多条信号通路参与了对自噬的调节,各条信号通路之间又相互交联,极其复杂[7]。目前研究较多的为mTOR(mammalian target of rapamycin)信号通路[8]。一般情况下mTOR处于活化状态,磷酸化抑制自噬的发生。但是在细胞氧化应激、缺血缺氧、炎症刺激等应激状态下,AMP/ATP(一磷酸腺苷/三磷酸腺苷)比值增加,增强 AMPK(Adenosine 5‘-monophosphate(AMP)-activated protein kinase,AMP依赖的蛋白激酶)活性,从而抑制mTOR的磷酸化水平,促进细胞自噬。
自噬与凋亡之间关系密切,其上游多条信号通路基本相同[9]。多种抗肿瘤药物在诱导肿瘤细胞凋亡的同时诱导了肿瘤细胞的自噬,但自噬在肿瘤细胞凋亡中的作用一直存在争议,部分学者认为过度的自噬导致肿瘤细胞发生了自噬性死亡,并称为II型程序性细胞死亡[10],但部分学者认为自噬仅为肿瘤细胞凋亡过程中的伴随现象,而非自噬介导的死亡[11]。Satoh等[12]报道茶多酚能够诱导人间皮瘤细胞凋亡及自噬水平均升高,但抑制自噬能明显增加茶多酚诱导的人间皮瘤细胞凋亡率,说明自噬在茶多酚诱导间皮瘤细胞凋亡过程中起应激性保护作用。本研究结果表明,茶多酚能够诱导人卵巢癌SKOV3细胞自噬水平升高,并呈一定的时间浓度依赖性,随着茶多酚浓度增加,SKOV3细胞自噬水平逐渐升高,以一定浓度EGCG刺激SKOV3细胞,其自噬水平先升高,后下降,在1~2h达到顶峰。EGCG刺激之后,p-PKB的表达水平随着作用时间的延长而下降,说明EGCG抑制了PKB信号通路的表达,但使用PKB激活剂IGF-1激活PKB信号通路后,明显抑制了EGCG诱导的SKOV3细胞自噬水平,这表明PKB信号通路在EGCG诱导SKOV3细胞自噬的过程中起着重要作用。但EGCG诱导的SKOV3细胞自噬在EGCG诱导的SKOV3细胞凋亡中所起的作用尚不明确,有待进一步研究。
[1] Yoon AJ,Shen J,Santella RM,et al.Topical Application of Green Tea Polyphenol-Epigallocatechin-3-gallate(EGCG)for Prevention of Recurrent Oral Neoplastic Lesions[J].J O-rofac Sci,2012,4(10):43-50.
[2] Eskelinen EL,Saftig P.Autophagy:a lysosomal degradation pathway with a central role in health and disease[J].Biochimica et biophysica acta,2009,1793(4):664-673.
[3]Kubisch J,Turei D,Foldvari-Nagy L,et al.Complex regulation of autophagy in cancer-integrated approaches to discover the networks that hold a double-edged sword[J].Semin Cancer Biol,2013,23(4):252-261.
[4]付春红,张秦,刘锦霞,等.茶多酚诱导卵巢癌SKOV3细胞凋亡及其机制的研究[J].医学研究生学报,2012,25(11):1146-1150.
[5]张晓梦,倪艳,李先荣.茶多酚的药理作用研究进展[J].药物评价研究,2013,36(2):157-160.
[6]Eskelinen EL,Saftig P.Autophagy∶A lysosomal degradation pathway with a central role in health and disease[J].Bba-Mol Cell Res,2009,1793(4):664-673.
[7] Ge L,Baskaran S,Schekman R,et al.The protein-vesicle network of autophagy[J].Current opinion in cell biology,2014,29(8):18-24.
[8]Blagosklonny MV.Hypoxia,MTOR and autophagy:Converging on senescence or quiescence[J].Autophagy,2013,9(2):260-262.
[9]Liu M,Li CM,Chen ZF,et al.Celecoxib regulates apoptosis and autophagy via the PI3K/Akt signaling pathway in SGC-7901 gastric cancer cells[J].International journal of molecular medicine,2014,33(6):1451-1458
[10]Berry DL,Baehrecke EH.Autophagy functions in programmed cell death[J].Autophagy,2008,4(3):359-360.
[11]Xiao M,Li L,Li C,et al.Role of Autophagy and Apoptosis in Wound Tissue of Deep Second-degree Burn in Rats[J].Acad Emerg Med,2014,21(4):383-391.
[12] Satoh M,Takemura Y,Hamada H,et al.EGCG induces human mesothelioma cell death by inducing reactive oxygen species and autophagy[J].Cancer cell international,2013,13(1):19.
(收稿:2014-04-12 修回:2014-08-04)
Effect of EGCG-induced Autophagy on Human Ovarian Cancer Cell Line SKOV3 and the UnderlyingMechanism
ZHAN Xin,ZHANG Lingyun,WANG Zhihua.Department of Obstetrics&Gynecology,Hangzhou First People's Hospital,Hangzhou(310006),China
Objective To investigate the effect of EGCG-induced autophagy on human ovarian cancer cell line SKOV3 and to explore the mechanism.MethodsHuman ovarian cancer cell SKOV3 were treated with EGCG,then autophage-associated protein LC3-II and AKT protein expression on the cells was detected by Western blot.ResultsAfter EGCG treatment,the level of LC3-II was up-regulated in a dose dependent manner,while the level of phospho-AKT was decreased.Pretreatment with AKT activator insulin-like growth factor 1,the EGCG-induced LC3-II expression was suppressed.ConclusionEGCG can induce autophagy in huaman ovarian cancer cell SKOV3 through AKT signaling pathway.
ovarian cancer;SKOV3 cells;epigallocatechin-3-gallate;PKB;autophagy
杭州市第一人民医院妇产科(杭州 310006)
王志华,Tel:15868189500

