绞股蓝总皂苷对糖尿病肾病大鼠nephrin、VEGF表达及肾功能的影响
王雁秋黄 平邓 旻
绞股蓝总皂苷对糖尿病肾病大鼠nephrin、VEGF表达及肾功能的影响
王雁秋1黄 平2邓 旻1
目的观察绞股蓝总皂苷对糖尿病肾病(DN)大鼠nephrin、VEGF表达的影响,探讨其降低尿蛋白、保护肾脏的作用机制。方法采用单侧肾切除加链脲佐菌素注射法改良复制大鼠DN模型,实验分为正常组、模型组、绞股蓝总皂苷高、中、低剂量组和缬沙坦组,每组8只。药物干预4周后测定24h尿蛋白、内生肌酐清除率、足细胞相关分子nephrin及足细胞分泌的VEGF蛋白在肾脏组织的表达。结果绞股蓝总皂苷高剂量组24h尿蛋白明显低于模型组[(77.04±16.63)mg比(110.56±46.88)mg,P<0.05],内生肌酐清除率高于模型组[(1.47±0.24)mL·min-1比(1.25±0.23)mL·min-1,P<0.05]。高剂量组 nephrin 蛋白表达水平较模型组明显上调(0.4250±0.02 比 0.3388±0.02,P<0.01),VEGF 表达明显抑制(0.2588±0.03 比 0.3521±0.01,P<0.01),且效果类似缬沙坦组。结论绞股蓝总皂苷能降低DN大鼠尿蛋白,改善肾功能和足细胞相关蛋白的异常表达。
大鼠;糖尿病肾病;足细胞;绞股蓝总皂苷;nephrin;VEGF
糖尿病肾病(DN)是终末期肾衰竭的常见原因,目前确切的发病机制尚未阐明。足细胞是维持肾小球滤过膜最后屏障与结构的主要细胞。足细胞损伤在DN进展中发挥重要作用。本实验在前期研究的基础上通过检测实验大鼠肾功能、24h尿蛋白及足细胞nephrin、VEGF蛋白的表达,观察绞股蓝总皂苷对早期糖尿病肾病的影响,进一步探讨相关作用机制。
1 实验材料
1.1 动 物 健康SPF级SD雄性大鼠60只,体质量200~240g,浙江中医药大学实验动物中心提供并饲养,动物合格证号:SYXK(浙)2008-0115。
1.2 试 剂 绞股蓝总苷片(安康正大制药有限公司,国药准字:Z10970130);缬沙坦胶囊(北京诺华制药有限公司,国药准字:H20040217);链脲佐菌素STZ(美国Sigma公司);即用型鼠SP检测试剂盒(SP-9002)、即用型兔 SP检测试剂盒(SP-9001)(北京中杉金桥生物技术有限公司)
2 实验方法
2.1 DN模型制作及分组 模型复制参照杨俊伟等[1]单侧肾切除加STZ注射法。成模标准[2]为血糖>16.7mmol/L,尿量>对照组的50%,24h尿蛋白>对照组的50%。随机将成模大鼠分为5组,每组8只:即绞股蓝总皂苷高剂量组(1g/kg)、绞股蓝总皂苷中剂量组(0.5g/kg)、绞股蓝总皂苷低剂量组(0.25g/kg)、缬沙坦(8mg/kg)、模型组(予等体积生理盐水灌胃)。正常对照组为8只正常大鼠(予等体积生理盐水灌胃)。大鼠血糖升高1周后(第8天)开始固定时间空腹灌胃给药,1天1次,干预时间持续4周。实验期间大鼠自由饮水和摄食。
2.2 大鼠血、尿检测 各组大鼠均于治疗前及治疗28天后提前一天以代谢笼留取24h尿液标本测定24h尿蛋白、尿肌酐;治疗28天后腹腔麻醉,空腹取静脉血测定血肌酐、尿素氮。
2.3 免疫组化测定nephrin、VEGF表达及半定量分析 nephrin采用即用型兔检测试剂盒(SP-9001),VEGF采用鼠SP检测试剂盒(SP-9002):肾组织经脱蜡水化,PBS冲洗后浸入枸橼酸盐缓冲液抗原修复,按照说明书要求滴加一抗原,次日PBS冲洗后DAB显色,苏木素核复染,中性树胶封片。以肾小球内棕黄色颗粒且染色强度高于背景者为阳性表达,阴性不显色。每例标本随机选取10个不重叠肾小球视野(×400),分别检测肾小球内阳性表达信号的平均光密度和面积,用Image-pro-plus6.0软件进行半定量分析。
3 实验结果
3.1 24h尿蛋白比较 药物干预4周后,绞股蓝总皂苷中、高剂量组,缬沙坦组大鼠24h尿蛋白较治疗前下降(P<0.05),且均低于模型组(P<0.05)。绞股蓝总皂苷低剂量组大鼠尿蛋白较前增多,与模型组比较差异无统计学意义(P>0.05),见表1。
表1 各组大鼠24h尿蛋白比较(mg,±s)
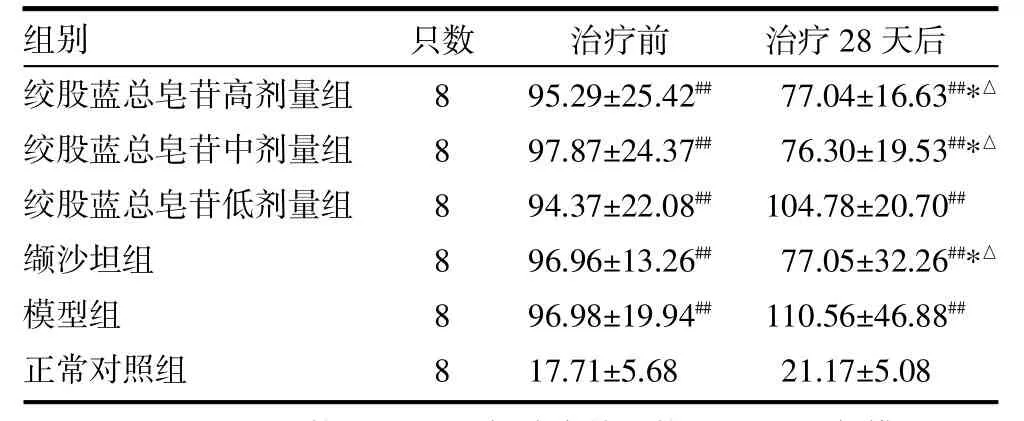
表1 各组大鼠24h尿蛋白比较(mg,±s)
注:与正常对照组比较,##P<0.01;与治疗前比较,△P<0.05;与模型组比较,*P<0.05
只数组别绞股蓝总皂苷高剂量组绞股蓝总皂苷中剂量组绞股蓝总皂苷低剂量组缬沙坦组模型组正常对照组8 8 8 8 8 8治疗前95.29±25.42##97.87±24.37##94.37±22.08##96.96±13.26##96.98±19.94##17.71±5.68治疗28天后77.04±16.63##*△76.30±19.53##*△104.78±20.70##77.05±32.26##*△110.56±46.88##21.17±5.08
3.2 肾功能指标比较 各组大鼠内生肌酐清除率较正常对照组明显下降(P<0.05),绞股蓝总皂苷低剂量组、模型组两组之间无差异(P>0.05),绞股蓝总皂苷高、中剂量组和缬沙坦组明显高于模型组(P<0.05),见表2。
表2 各组大鼠内生肌酐清除率比较(±s)
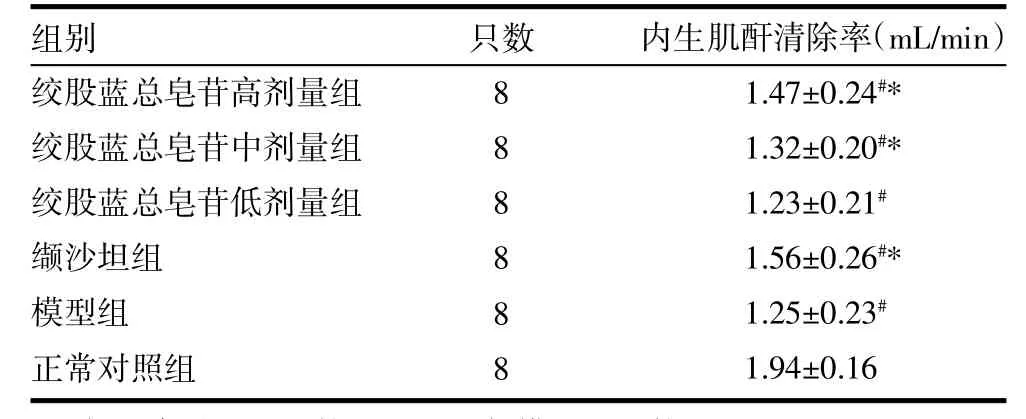
表2 各组大鼠内生肌酐清除率比较(±s)
注:与正常对照组比较,#P<0.05;与模型组比较,*P<0.05
只数组别绞股蓝总皂苷高剂量组绞股蓝总皂苷中剂量组绞股蓝总皂苷低剂量组缬沙坦组模型组正常对照组8 8 8 8 8 8内生肌酐清除率(mL/min)1.47±0.24#*1.32±0.20#*1.23±0.21#1.56±0.26#*1.25±0.23#1.94±0.16
3.3 肾脏nephrin、VEGF蛋白表达比较 nephrin表达:正常对照组可见nephrin连续、线性分布在肾小球毛细血管畔足细胞侧,且表达较强(图1,插页);模型组上述阳性表达明显减弱,且分散不均一(P<0.01)(图 2,插页);各治疗组 nephrin表达较模型组表达均上调(P均<0.01)(图 3~6,插页),见表 3。VEGF表达:正常对照组大鼠肾小球及肾小管均未见或少见VEGF蛋白表达颗粒(图7,插页);模型组大鼠肾小球内VEGF表达明显增强(P<0.01),同时在肾小管上皮细胞也呈阳性(图8,插页);各治疗组大鼠VEGF表达均有一定程度的抑制(P<0.01或P<0.05)(图 9~12,插页)。其中绞股蓝总皂苷高、中剂量组之间无明显差异,见表3。
表3 各组大鼠nephrin、VEGF蛋白表达比较(±s)
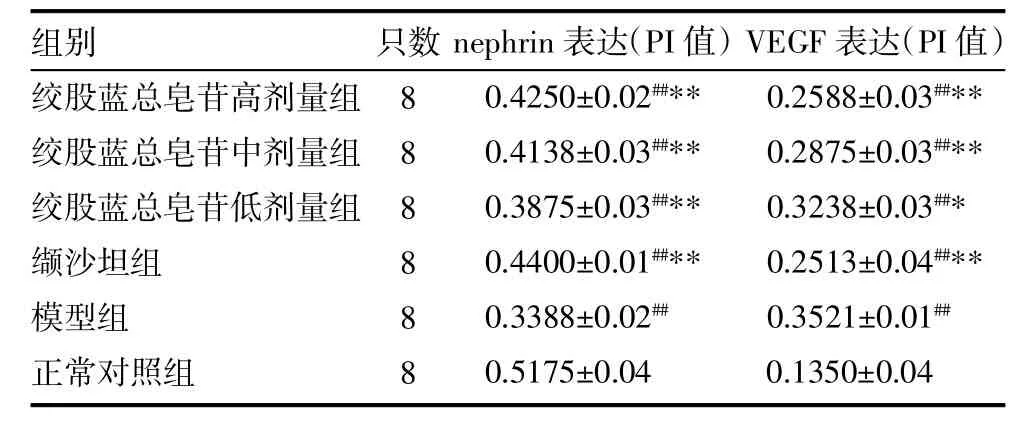
表3 各组大鼠nephrin、VEGF蛋白表达比较(±s)
注:与正常对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
组别绞股蓝总皂苷高剂量组绞股蓝总皂苷中剂量组绞股蓝总皂苷低剂量组缬沙坦组模型组正常对照组只数8 8 8 8 8 8 nephrin表达(PI值)0.4250±0.02##**0.4138±0.03##**0.3875±0.03##**0.4400±0.01##**0.3388±0.02##0.5175±0.04 VEGF表达(PI值)0.2588±0.03##**0.2875±0.03##**0.3238±0.03##*0.2513±0.04##**0.3521±0.01##0.1350±0.04
4 讨 论
足细胞是肾小球滤过屏障的重要组成部分,通过足突黏附于基底膜,与内皮细胞、基底膜共同维持正常的肾小球滤过作用。目前已证实,DN时,高糖本身、糖基化终末产物、氧化应激、血管紧张素II、转化生长因子β等多种因素作用于足细胞,导致足细胞损伤[3]。
足细胞足突间相互连接形成指状交叉的拉链结构成为裂孔,其上覆盖着裂孔膜(SD)具有大小和电荷选择性滤过作用。nephrin是主要的SD蛋白之一,它在肾脏特异性表达于足细胞,研究[4]证实nephrin正常表达是SD拉链结构的的必要条件。研究[5]发现高糖环境抑制DM小鼠nephrin表达,并随病程的延长抑制作用加强;且DN患者体内高糖环境引起大量氧自由基积聚[6]、肾素-血管紧张素系统(RAS)活化,这将导致nephrin的正常表达被强烈抑制,nephrin 表达降低[7-8]。
VEGF是一种增强血管通透性的细胞因子,参与微血管病变的病理过程。在生理情况下主要由足细胞表达和合成,病理状态下系膜细胞、内皮细胞以及远端小管上皮细胞也可合成。VEGF通过与受体结合后发挥重要的生理作用:肾脏结构的发育;维持肾小球滤过屏障功能与结构的完整性;肾脏血管的再生与修复。而损伤的足细胞释放大量VEGF,使得肾小球滤过膜通透性升高,最终导致蛋白尿的产生。VEGF通过影响肾小球足细胞裂SD分子而发挥抗足细胞凋亡的作用,但当nephrin缺失时,抑制作用消失。VEGF的表达受多种因素的调控如缺氧、高糖、血管紧张素、糖基化终末产物等[9]。
绞股蓝的主要药效成分为绞股蓝皂苷,有降血脂、调节免疫力、清除氧自由基等药理作用。研究表明,绞股蓝有一定的降血糖及改善糖尿病并发症的作用[10]。本实验表明绞股蓝总皂苷能上调足细胞nephrin的表达,下调VEGF的过表达,降低尿蛋白,一定程度上改善肾功能。结合本课题组既往实验结果[11-13]可以推论绞股蓝能上调SD分子nephrin表达,维持裂孔隔膜完整性,同时抑制VEGF过表达,发挥其抗足细胞凋亡作用;下调晚期糖基化终末产物,降低血管紧张素II受体含量,抑制转化生长因子β过表达,从而减少足细胞损伤,降低尿蛋白。
[1]杨俊伟,黎磊石.大黄治疗糖尿病肾病的实验研究[J].中华内分泌代谢杂志,1993,9(4):222-224.
[2]张翥,黄颂民,冯敏,等.糖尿病早期白蛋白尿与Megalin的表达变化[J].中国中西医结合肾病杂志,2006,7(4):197.
[3]戴厚永,范亚平.足细胞损伤与糖尿病肾病关系的研究进展[J].医学综述,2013,19(17):3073.
[4]Tryggvason Karl,Patrakka Jaakko,Wartiovaara Jorma.Hereditary proteinuria syndromes and mechanisms of proteinuria[J].The New England journal of medicine,2006,354(13):1387-1401.
[5] Zhang Z,Sun L,Wang Y,et al.Renoprotective role of the vitamin D receptor in diabetic nephropathy[J].Kidney international,2008,73(2):163-171
[6] Whaley-Connell Adam,Habibi Javad,Nistala Ravi,et al.Attenuation of NADPH oxidase activation and glomerular filtration barrier remodeling with statin treatment[J].Hypertension,2008,51(2):474-480.
[7]Kanwar Yashpal S,Wada Jun,Sun Lin,et al.Diabetic nephropathy:mechanisms of renal disease progression[J].Experimental biology and medicine,2008,233(1):4-11.
[8]Wolf Gunter,Ziyadeh Fuad N.Cellular and molecular mechanisms of proteinuria in diabetic nephropathy[J].Nephron Clinical practice,2007,106(2):26-31.
[9]钟晓容,庄永泽.血管内皮生长因子及其受体在肾脏疾病中的研究进展[J].中国中西医结合肾病杂志,2009,10(7):642-643.
[10]刘美玉,刘铜华.绞股蓝抗糖尿病作用研究进展[J].中国中医药信息杂志,2009,15(3):97-98.
[11]陶利花,黄平,钱康,等.绞股蓝总皂苷对糖尿病肾病大鼠肾皮质基因表达谱的影响[J].中国中西医结合肾病杂志,2007,8(12):718-719.
[12]金李君,黄平.绞股蓝皂苷对糖尿病肾病大鼠肾组织转化生长因子β1表达的影响[J].中华中医药学刊,2007,25(9):1922-1925.
[13]黄平,金李君,钱康.绞股蓝颗粒对糖尿病肾病大鼠肾脏血管紧张素及内皮素表达的影响[J].中国中西医结合肾病杂志,2009,10(9):765-768.
(收稿:2014-06-24 修回:2014-08-04)
Effect of Gypenoside on Nephrin,VEGF Expression and the Renal Function of diabetic Nephropathy Rats
WANG Yanqiu1,HUANG Ping2,DENG Min1.1 Emergency Unit,Hangzhou Red CrossHospital,Hangzhou(310003),China;2 Department of Endocrinology,Zhejiang Provincial Hospital of TCM,Hangzhou(310006),China
Objective To investigate the effect of gypenoside on the expressions of nephrin,vascular endothelial growth factor(VEGF)in rats with diabetic nephropathy(DN)and to explore its mechanism underlying the reduction of proteinuria and renal protection.MethodsDN model was established by uninephrectomized and induced with streptozotocin,then randomly divided into model group and treatment groups(groups of high,medium,low dose of gypenoside,and valsartan group),with normal rats as control group,8 rats in each group.After the treatment for 4 weeks,24-hour proteinuria and clearance of creatinine(Ccr) were determined and the expression of nephrin,VEGF protein in renal tissues was examined by immunohistochemistry.ResultsCompared with model group,the level of 24-hour proteinuria decreased (77.04±16.63mg vs 110.56±46.88mg,P<0.05),the Ccr increased (1.47±0.24mg vs 1.25±0.23mg,P<0.05),the expression of nephrin protein was upregulated(0.4250±0.02 vs 0.3388±0.22,P<0.01),and the expression of VEGF was significantly reduced(0.2588±0.03 vs 0.3521±0.01,P<0.01)in high-gypenoside group.The results of high-gypenoside group were similar to valsartan group.ConclusionGypenoside can reduce proteinuria,improve the renal function,and recover the expression of podocyte's associated proteins.
rats;diabetic nephropathy;podocyte;gypenoside;nephrin;VEGF
p
浙江省中医药科技计划项目(No.2010ZB046)
1杭州市红十字会医院急诊科(杭州 310003);2浙江省中医院内分泌科(杭州 310006)
王雁秋,Tel:13666683220;E-mail:157292318@qq.com

