雨生红球藻提取物对糖尿病小鼠血糖及血脂水平的干预和调节作用
黄河儒,王姗姗,倪晓锋,陈日萍,张佳莉,陈翼翔,沈生荣*
(1.浙江大学生物系统工程与食品科学学院,杭州310058;2.浙江省医学科学院,杭州310013;3.浙江传媒学院电子信息学院,杭州310018)
雨生红球藻提取物对糖尿病小鼠血糖及血脂水平的干预和调节作用
黄河儒1,2,王姗姗1,倪晓锋1,陈日萍2,张佳莉2,陈翼翔3,沈生荣1*
(1.浙江大学生物系统工程与食品科学学院,杭州310058;2.浙江省医学科学院,杭州310013;3.浙江传媒学院电子信息学院,杭州310018)
通过造小鼠糖尿病模型并给予不同剂量的雨生红球藻提取物,研究其对糖尿病造模小鼠糖耐量和胰岛素耐量的影响、血脂的调节情况及改善糖尿病病情的可能的作用机制.通过四氧嘧啶腹腔注射的方式建立糖尿病小鼠模型,灌胃给予不同剂量的雨生红球藻提取物,给药期为28d,每7d记录1次小鼠空腹血糖及体质量;给药期末进行耐糖量和胰岛素耐量实验,并测定血清甘油三酯(triglyceride,TG)、血清总胆固醇(serum total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)含量.结果表明:造模后小鼠毛色杂乱暗淡,出现明显多饮、多食、多尿的“三多"症状,小鼠体质量明显减轻.试验组给予不同剂量雨生红球藻提取物28d后,高、中、低剂量组的体质量与模型对照组比较均有统计学上的显著差异(P<0.01,P<0.05,P<0.05),高、中剂量组的血糖与模型组比较均有统计学上的显著差异(P<0.05,P<0.05),且以高剂量组最为明显.在糖耐量实验中,各组小鼠的血糖值均在糖负荷30min时达到峰值,30min后血糖值随着时间的增加呈下降趋势;高剂量组和中剂量组血糖值在120min时明显低于模型对照组(P<0.01).在胰岛素耐量实验中,腹腔注射0.8U/kg胰岛素15min后,高剂量组血糖值较基础值降低20.9%,而低剂量组仅降低0.6%;3个剂量组在90min时均降低至最低值,血糖分别降低53.6%、23.9%和17.9%,模型组血糖降低5.3%;120min时血糖已上升,但雨生红球藻提取物高剂量组血糖值仍显著低于模型对照组(P<0.01).雨生红球藻提取物高剂量组血清TC、TG及LDL-C含量明显低于模型对照组,差异具有统计学意义(P<0.05,P<0.01,P<0.05).总之,雨生红球藻提取物可显著降低造模糖尿病小鼠的血糖水平,缓解多饮、多食、多尿及体质量减轻症状,显著改善病鼠机体的糖耐量及胰岛素耐量,提升其对葡萄糖的利用能力,有效调节病鼠的血脂紊乱,改善血液环境,且对正常小鼠的血糖、血脂无显著影响.在实验所用的3个剂量中,以高剂量(8g/kg)效果最佳.
雨生红球藻提取物;四氧嘧啶;糖尿病小鼠;糖耐量;胰岛素耐量
Journal of Zhejiang University(Agric.&Life Sci.),2015,41(6):641-649
SummaryDiabetes was generally recognized as a critical issue in global public health,and has become the third noninfectious disease after angiocardiopathy and cancer.So far,the combination of applying insulin and controlling diet,as well as changing the way of living were the major therapeutic method for treating diabetes.Recently,the adjuvant therapy of natural extracts has been the research highlight in this field.
To observe the intervention effect of Haematococcus pluvialis extract on blood glucose tolerance,insulin tolerance,lipid adjustment and the possible functional mechanism of improving diabetic patients’condition,the diabetic mouse models were induced by alloxan through intraperitoneal injection,and given by gavage with different doses of H.pluvialis extract for 28days.The contents of fasting blood glucose and their body masses were detected at 7-day intervals.The capability of blood glucose tolerance and insulin tolerance was measured during later period of administration.Meanwhile,the contents of triacylglycerol(TG),serum total cholesterol(TC),high density lipoprotein cholesterol(HDL-C)and low density lipoprotein cholesterol(LDL-C)were detected.
After modeling,the mice had dark and messy hair,and the typical diabetic symptoms including polydipsia,polyphagia and polyuria along with significant mass loss.Compared with the model group,by giving different doses of H.pluvialis extract in 28dfor experimental groups,the high,middle and low dose groups had statistically significant differences between the body masses and blood glucose contents,respectively(P<0.01,P<0.05,P<0.05).The difference between high dose group and model group was most evident.During the experiment of blood glucose tolerance,the blood glucose level of each group reached the peak in 30min of glucose loading.The glucose levels appeared downtrend after 30min,of which the high dose group and middle dose group were much lower than the model group in 120min(P<0.01).In the insulin experiment,after injecting 0.8U/kg insulin for 15min,the blood glucose level of high dose group reduced by 20.9%compared with the basic level,while the low dose group only reduced by 0.6%.Three dose groups had the lowest blood glucose levels which reduced by 53.6%,23.9%and 17.9%respectively in 90min,while the model group reduced by 5.3%.The blood glucose increased in 120min;however,the level in the high dose group of H.pluvialis extract was still much lower than that of model group(P<0.01).The TC,TG and LDL-C contents of the high dose group of H.pluvialis extract were much lower than the model group,which were statistically significant differences(P<0.05,P<0.01,P<0.05).
Haematococcus pluvialis extract has remarkable effect of decreasing blood glucose level,relieving the symptoms of polydipsia,polyphagia,polyuria and mass loss,improving the glucose tolerance and insulin tolerance,increasing the utilization of glucose and regulating blood lipid level on diabetic mice.However,it has no effect on the blood glucose and lipids of normal mice.Among the three dose groups,the high dose group(8g/kg)has the best effect.
糖尿病是由遗传和环境因素相互作用引起的胰岛素分泌异常,伴有或不伴有胰岛素抵抗,而导致以慢性血葡萄糖水平增高为特征的代谢性疾病,成为继心血管和肿瘤之后的第三大非传染性疾病,已被公认为愈来愈严重的存在于全球范围内的公共卫生问题[1].随着生活方式西方化和人口老龄化,中国肥胖发生率和糖尿病患病率呈迅猛增长趋势.据统计,目前全世界糖尿病人数为3.66亿,预计到2030年将达到5.52亿[2];在中国14个省市进行的糖尿病流行病学调查显示,我国20岁以上的成年人糖尿病患病率为9.7%[3].目前治疗糖尿病的方法主要是运用胰岛素配合饮食控制以及生活方式的改变.天然提取物的辅助治疗已成为该领域的研究热点.雨生红球藻提取物是一种含虾青素的天然抗氧化剂,它具有抗氧化作用,可增强细胞再生能力,维持机体平衡和减少衰老细胞的堆积,由内而外保护细胞.有文献报道,虾青素可保护胰腺β细胞、抗氧化、抗感染、改善胰岛素抵抗[2-6],在改善糖尿病并发症方面有一定作用[7-15],同时,它还具有防止肝损伤、降血压、降眼压、抗胃溃疡、抗疲劳、抗骨质疏松、抗辐射等生物活性[16-22].但是对雨生红球藻提取物的降血糖、调节血脂的作用还鲜见报道.本文通过建立小鼠糖尿病模型并给予不同剂量的雨生红球藻提取物,观察其对糖尿病造模小鼠糖耐量和胰岛素耐量的影响、血脂的调节情况及改善糖尿病病情的可能的作用机制,为该提取物的进一步开发提供科学依据.
1 材料与方法
1.1 材料
1.1.1实验动物 ICR成年健康雄性小鼠,体质量(22±2)g,由浙江省实验动物中心提供(实验动物合格证号:SCXK(浙)2014-0001).所有动物实验均在浙江省实验动物中心屏障环境内完成(动物使用许可证号:SYXK(浙)2014-0008).饲养条件:供试小鼠均在屏障系统实验室内饲养,万级空气洁净度,换气次数10~20次/h,温度20~26℃,相对湿度40%~70%,昼夜温差≤3℃.小鼠饮用超滤水,饲喂60Co处理的营养配合饲料,所有笼器具、垫料等均经过脉动真空灭菌器以121℃、40min高压灭菌处理.
1.1.2材料与试剂 四氧嘧啶(alloxan),美国Sigma化学公司产品,批号068K1131;盐酸二甲双胍片,中美上海施贵宝制药有限公司,批号1408092;胰岛素,江苏万邦生化医药股份有限公司,批号3350189;葡萄糖,江西红星药业有限公司,批号S140829;OneTouch SureStep血糖试纸,美国强生LifeScan公司;雨生红球藻提取物,北京绿色金可生物科技有限公司,批号AO141201.
1.1.3仪器与设备 MD-M4多功能酶标仪,美国Molecular Devices公司;5804R离心机,德国Eppendorf股份公司;AB204-E电子天平,瑞士Mettler-Toledo公司;稳豪型血糖仪,美国强生公司.
1.2 实验方法
1.2.1四氧嘧啶诱导小鼠糖尿病给药剂量的确定从浙江省实验动物中心领取ICR小鼠,适应性培养后记录空腹血糖.分别腹腔注射四氧嘧啶100、200和400mg/kg,当空腹血糖≥11.1mmol/L时,视为造模成功.试验期间小鼠死亡数不计入成模率内.成模率=空腹血糖≥11.1mmol/L的未死亡小鼠/实验小鼠总数.由于注射100、200和400mg/kg剂量的四氧嘧啶死亡率分别是0%、12.5%和62.5%,成模率分别是62.5%、87.5%和37.5%,故选用200mg/kg作为四氧嘧啶造模剂量.
1.2.2造模 取90只雄性健康ICR小鼠,用普通饲料适应性喂养3d,选其中65只按200mg/kg腹腔注射四氧嘧啶,5d后测定空腹血糖,选50只血糖浓度达到11.1mmol/L以上且其浓度分布在13~28 mmol/L之间的小鼠进行下一步处理.
1.2.3雨生红球藻提取物处理 造模后重新称质量.将上述50只造模成功的小鼠按血糖浓度分成5组,每组10只;从剩余25只正常对照小鼠中挑选20只体质量接近者分为2组,每组10只.
雨生红球藻提取物的人体推荐剂量为1.1g/d,本实验设置的低、中、高剂量分别为人体推荐剂量的10倍、20倍和40倍,即2、4和8g/kg[23].
雨生红球藻提取物高剂量组(H):造模成功后,按照8g/kg剂量每日灌服雨生红球藻提取物;
雨生红球藻提取物中剂量组(M):造模成功后,按照4g/kg剂量每日灌服雨生红球藻提取物;
雨生红球藻提取物低剂量组(L):造模成功后,按照2g/kg剂量每日灌服雨生红球藻提取物;
阳性药物组(PD):造模成功后,按照200mg/kg剂量每日灌服二甲双胍;
模型对照组(DM):造模成功后,灌服生理盐水;
空白对照组(NC):与模型组同期灌服生理盐水;
雨生红球藻提取物正常对照组(NC-H):与模型组同期灌服8g/kg雨生红球藻提取物.
1.2.4标本采集及处理 每天观察动物1次,包括动物精神状况、行为和毛色有无异常.每周称量并记录动物体质量1次.造模成功后于每周固定时间测定空腹血糖.4周后,眼球取血(约500μL),将全血以3 000r/min离心10min后收集血清,-20℃保存.1.2.5葡萄糖耐量试验 在标本采集前1天进行糖耐量试验,各组动物禁食3~4h,测定空腹血糖即给葡萄糖前(0h)血糖值.剂量组给予不同浓度雨生红球藻提取物,模型对照组、空白对照组不做处理,15~20min后各组经口给予葡萄糖2.5g/kg体质量,分别测定30、60和120min血糖值.若模型对照组0.5h血糖值≥11.1mmol/L,或模型对照组在30、60和120min任一时间点血糖比空白对照组显著升高,判定模型糖代谢紊乱成立,观察模型对照组与雨生红球藻剂量组空腹血糖以及给予葡萄糖30、60和120min后的血糖变化.
1.2.6胰岛素耐量试验 各组小鼠在胰岛素耐量试验前需禁食6h后用血糖仪检测尾静脉空腹血糖,然后腹腔注射0.8U/kg胰岛素,分别于15、30、60、90和120min后用血糖仪检测尾静脉血糖值.
1.2.7小鼠血脂测定 用GOD-PAP酶法[24]配合多功能酶标仪检测血清总胆固醇(serum total cholesterol,TC)和甘油三酯(triglyceride,TG)含量,用双试剂直接法[24]配合多功能酶标仪检测血清高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)含量.
1.2.8统计分析 结果用平均值±标准差表示.采用SPSS 9.0统计软件包的单因素方差分析(oneway ANOVA)进行组间比较.
2 结果与分析
2.1小鼠一般体征及体质量变化
造模后小鼠毛色杂乱暗淡,出现明显的多饮、多食、多尿的“三多"症状,小鼠体质量明显减轻.试验组给予不同剂量雨生红球藻提取物28d后,各组小鼠症状均有不同程度的改善.其中,与模型对照组(DM)比较,雨生红球藻高、中、低组小鼠体质量在第28d时差异均有统计学意义(P<0.01,P<0.05,P<0.05),以高剂量组差异最为明显(表1).另外,模型组随着时间的延长体质量有所下降,表现出糖尿病典型的“一少(体质量减轻)"症状,各给药组随着时间的增加体质量变化不明显.
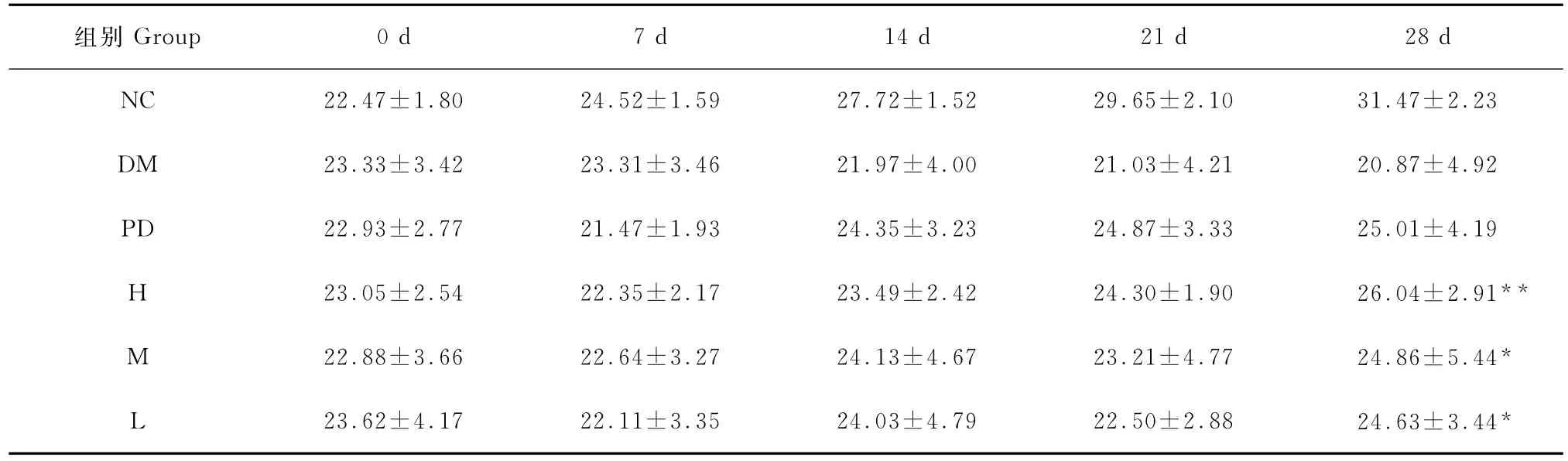
表1 雨生红球藻提取物对造模糖尿病小鼠体质量的影响Table 1 Effects of Haematococcus pluvialis extracts on body mass of alloxan-induced diabetic mice g
2.2 雨生红球藻提取物对小鼠血糖浓度的影响
从表2可以看出:与模型组比较,按4和8g/(kg爛d)雨生红球藻提取物灌胃糖尿病小鼠28d后,其血糖值显著降低(P<0.05),并呈现一定的剂量-效应关系;与阳性药物组(PD)比较,雨生红球藻提取物高剂量组在7、14、21和28d时血糖值存在统计学上的显著差异(P<0.01,P<0.01,P<0.05,P<0.05);而雨生红球藻提取物对正常小鼠血糖没有显著影响.
2.3 雨生红球藻提取物对小鼠口服葡萄糖耐量的影响
从表3可以看出:各组小鼠的血糖值均在糖负荷30min时达到峰值,30min后血糖值随着时间的增加呈下降趋势;雨生红球藻高剂量组和中剂量组血糖值在120min时明显低于模型组(P<0.01);高剂量组血糖值在0和30min时与阳性药物组比较差异有统计学意义(P<0.05),在60和120min时与阳性药物组比较没有显著差异;中剂量组血糖值在0、30、60和120min时与阳性药物组比较差异有高度统计学意义(P<0.01).说明雨生红球藻提取物能明显降低小鼠的血糖值,提高小鼠的糖耐量,并且高剂量组效果比中剂量组好.

表2 雨生红球藻提取物对造模糖尿病小鼠血糖浓度的影响Table 2 Effects of H.pluvialis extracts on blood glucose concentration of alloxan-induced diabetic mice mmol/L

表3 雨生红球藻提取物对造模糖尿病小鼠口服葡萄糖耐量的影响Table 3 Effects of H.pluvialis extracts on blood glucose concentration of alloxan-induced diabetic mice in the oral glucose tolerance test
2.4 雨生红球藻提取物对小鼠胰岛素耐量的影响
从表4可以看出:小鼠的胰岛素耐量在一定时间内呈下降趋势,模型对照组血糖在30min时达到最低点,在120min时血糖快速升高,其余组小鼠血糖在60~90min时达到最低点,90min后均有所增加,但增加幅度不大.说明糖尿病模型组小鼠的胰岛素耐量明显增加,自身产胰岛素明显不足.
从表4还可以看出:腹腔注射0.8U/kg胰岛素15min后,高剂量组血糖值较基础值降低20.9%,而低剂量组仅降低0.6%,3个剂量组在90 min时均降低至最低值,血糖分别降低53.6%、23.9%和17.9%,模型组血糖降低5.3%;120min时血糖上升,但雨生红球藻提取物高剂量组血糖值仍显著低于模型组(P<0.01).与阳性药物组比较,雨生红球藻高剂量组在60和90min时对胰岛素耐量在统计学上都具有显著差异(P<0.05,P<0.01).说明高剂量雨生红球藻提取物可明显增加小鼠对葡萄糖的利用能力,降低糖尿病小鼠的胰岛素耐量,并且效果优于阳性药物.
2.5 雨生红球藻提取物对小鼠血脂的影响
从表5可以看出:与空白对照组(NC)比较,模型组TG、TC和LDL-C含量均显著增高(P<0.01,P<0.01,P<0.05),说明模型动物存在高脂血症;雨生红球藻提取物高剂量组血清TC、TG及LDL-C含量明显低于模型对照组(P<0.05,P<0.01,P<0.05),中剂量组血清TC、TG含量明显低于模型对照组(P<0.05),低剂量组血清TG含量明显低于模型对照组(P<0.05),同时,雨生红球藻高、中、低剂量组与阳性药物组比较没有显著差异.说明雨生红球藻提取物具有调节小鼠血脂的作用.

表4 雨生红球藻提取物对造模糖尿病小鼠胰岛素耐量的影响Table 4 Effects of H.pluvialis extracts on blood glucose concentration of alloxan-induced diabetic mice in the insulin tolerance test
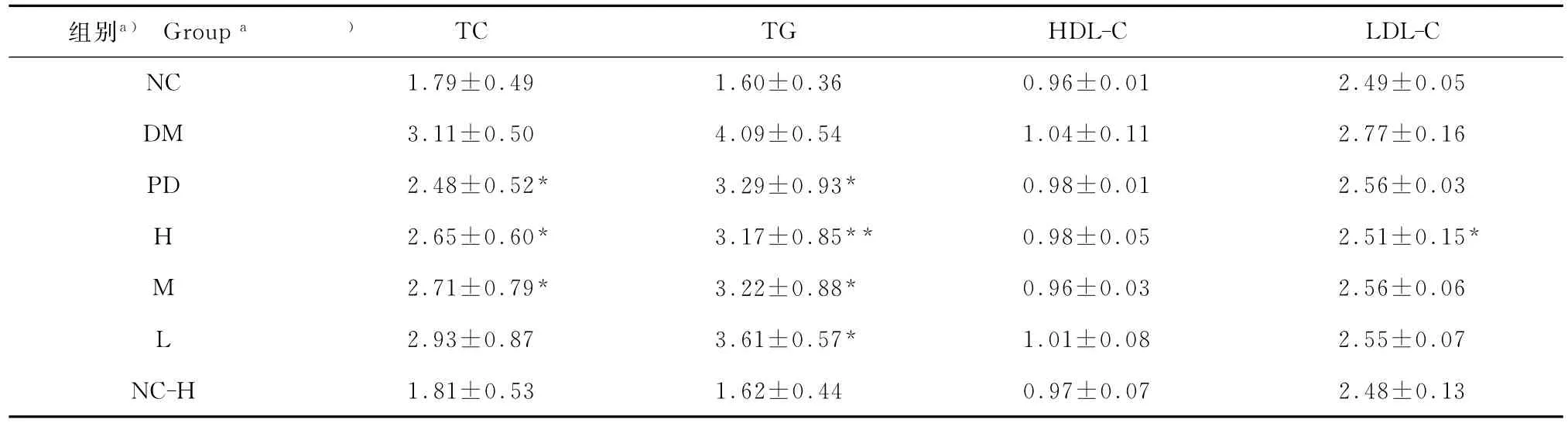
表5 雨生红球藻提取物对造模糖尿病小鼠血清血脂浓度的影响Table 5 Effects of H.pluvialis extracts on serum lipid concentration of alloxan-induced diabetic mice mmol/L
3 讨论
本研究所用雨生红球藻提取物中含有≥6%的虾青素有效成分.虾青素(astaxanthin,ASX)即3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素,为萜烯类不饱和化合物,化学分子式为C10H52O4,分子结构中有2个β-紫罗兰酮环,11个共轭双键,这些结构都具有比较活泼的电子效应,能向自由基提供电子或吸引自由基的未配对电子,是本实验的主要功效成分之一.
有研究表明,虾青素具有改善造模动物血糖水平的功能.Bhuvaneswari等[4]和Arunkumar等[5]将供试鼠给予高糖高脂饮食后诱导Ⅱ型糖尿病动物模型,并将实验鼠分为对照组和虾青素给药组,给药结束后观察虾青素对肝脏的胰岛素信号和葡萄糖代谢的作用,发现虾青素能通过调节代谢酶和胰岛素信号通路进而改善葡萄糖代谢作用.陈志强等[12]用四氧嘧啶制备糖尿病小鼠模型,评估虾青素对糖尿病小鼠的降血糖作用,发现虾青素能降低糖尿病小鼠的血糖水平.Cicero等[13]用小檗碱联合甘蔗脂肪醇以及两者配以红酵母提取物、虾青素分别治疗高脂血症受试者,发现后者能更有效地降低TG、TC、LDL-C含量,提高HDL-C含量.本实验采用雨生红球藻提取物以2、4、8g/(kg爛d)灌胃糖尿病小鼠,用四氧嘧啶造模后小鼠毛色杂乱暗淡,出现明显多饮、多食、多尿并伴有体质量减轻症状,给予不同剂量雨生红球藻提取物28d后,各组小鼠以上症状均有不同程度的改善,以高剂量雨生红球藻提取物组最为明显;用药后体质量下降减缓的原因可能是雨生红球藻提取物降低了病鼠血糖,提高了肌体糖耐量和对葡萄糖的利用率,调节了肌体的糖代谢及脂代谢,致使肌体对脂肪消耗减少,同时降血糖作用缓解了肌体在高血糖下的渗透性利尿,减少了肌体水分流失.本研究供试提取物虾青素含量≥6%,实验结果表明雨生红球藻提取物降血糖效果虽不及传统的经典降糖药二甲双胍,但仍可显著降低小鼠空腹血糖浓度,并呈现剂量-效应关系,同时对正常小鼠血糖没有显著影响,功效作用与其主要成分及含量有关.糖耐量实验结果表明:各组小鼠的血糖值均在糖负荷30min时达到峰值,120min时的血糖值基本回落;雨生红球藻提取物高剂量组糖负荷后在各个时间点的血糖值明显低于模型组(P<0.01),表明两组小鼠糖耐量具有极显著差异;高剂量组血糖值在0和30min时与阳性药物组比较差异有统计学意义(P<0.05),在60和120min时与阳性药物组比较没有显著差异,中剂量组血糖值在0、30、60和120min时与阳性药物组比较差异有高度统计学意义(P<0.01),表明雨生红球藻高剂量组比中剂量组在降低小鼠血糖值、改善糖耐量方面更接近阳性药物组.胰岛素耐量实验结果表明:腹腔注射0.8 U/kg胰岛素15min后,高剂量组血糖值较基础值降低20.9%,而低剂量组仅降低0.6%;高、中、低3个剂量组在90min时均降低至最低值,血糖值分别降低53.6%、23.9%和17.9%,模型组血糖降低5.3%,120min时血糖已上升,但高剂量组的血糖值仍显著低于模型组(P<0.01);高剂量组在60和90min时与阳性药物组比较差异有统计学意义(P<0.05,P<0.01).说明高剂量雨生红球藻提取物明显增加了小鼠对葡萄糖的利用能力并且效果优于阳性对照,但其作用机制是增加胰岛素敏感性还是降低胰岛素抵抗有待进一步研究.血脂测定结果表明:与空白对照组比较,模型组TG、TC和LDL-C含量均显著增高(P<0.01,P<0.01,P<0.05),说明模型动物存在高脂血症;雨生红球藻提取物高剂量组血清TC、TG及LDL-C含量明显低于模型组(P<0.05,P<0.01,P<0.05),中剂量组血清TC、TG含量明显低于模型组(P<0.05),低剂量组血清TG含量明显低于模型组(P<0.05),同时,雨生红球藻高、中、低剂量组与阳性对照组比较没有显著差异.说明雨生红球藻提取物能有效降低高脂血症小鼠血清中的TC、TG及LDL-C含量,可以干预调节糖尿病小鼠的高脂血症,且浓度越高越有效.
在降糖机制研究方面,Bhuvaneswari等[4]和Arunkumar等[5]在高糖高脂饮食后诱导Ⅱ型糖尿病动物模型实验中,小鼠显示出明显的胰岛素抵抗,而经虾青素处理后的高糖高脂饮食小鼠的胰岛素敏感性参数有明显的改善,同时观察到酪氨酸磷酸化增加,胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)和胰岛素受体底物-2(IRS-2)的丝氨酸磷酸化减少,由高糖高脂饮食诱导的c-Jun氨基末端激酶1(c-Jun N-terminal kinase 1,JNK-1)和细胞外信号调节激酶2(extracellular signalregulated kinase 2,ERK-2)也显著降低.近年来的研究表明,虾青素能促进受IRS-1诱导的葡萄糖转运蛋白4的转位和葡萄糖的吸收,并抑制JNK的活化从而减轻对胰岛素信号通路的损伤,此外,还检测到虾青素能有效改善由肿瘤坏死因子α(tumournecrosis factorα,TNF-α)和游离脂肪酸诱导的胰岛素抵抗[6].上述研究证明虾青素改善氧化应激也是调节血糖的机制之一.另外,流行病学调查结果证明虾青素可以调节脂质代谢从而调节血糖代谢.
在本实验中雨生红球藻提取物也具有降血糖和调节血脂的作用.经检测,该天然提取物中虾青素含量占总含量的6%以上,若不计赋形剂,则虾青素含量占总含量的24%以上,故猜测虾青素是该提取物的主要功效成分之一.该产品为天然提取物,除了其赋形剂是天然食品及成分以外,是否还有其他同类活性成分,有待进一步研究.
综上所述,雨生红球藻提取物可显著降低造模糖尿病小鼠的血糖水平,缓解多饮、多食、多尿及体质量减轻症状,显著改善病鼠机体的糖耐量及胰岛素耐量,提升其对葡萄糖的利用能力,有效调节病鼠的血脂紊乱,改善血液环境,且对正常小鼠的血糖和血脂无显著影响.在实验所用的3个剂量中,以8g/kg高剂量雨生红球藻提取物效果最佳.雨生红球藻提取物能在一定程度上调节造模糖尿病小鼠的血糖和血脂水平,作为食物营养补给剂或调节剂,该提取物具有一定的应用价值,但其作用机制有待深入研究.本次实验仅收集了雨生红球藻改善糖尿病的基础数据,随着日后研究的深入,将着手进行分子生物学水平的研究,探讨雨生红球藻改善糖尿病的机制.此外,笔者研究发现雨生红球藻提取物可以改善病鼠肠道菌群结构,提高肠道益生菌比例(数据未发表),而肠道菌群是影响肌体血糖及血脂的重要因素,故推测肠道菌群可能是雨生红球藻改善糖尿病的途径之一.
(References):
[1] 邹欣蓉,刘琼,毛玉山,等.虾青素与Ⅱ型糖尿病研究进展.中国海洋药物,2014,33(3):91-93.Zou X R,Liu Q,Mao Y S,et al.Processes of astaxanthin on typeⅡdiabetes.Chinese Journal of Marine Drugs,2014,33(3):91-93.(in Chinese with English abstract)
[2] Guariguata L,Whiting D,Weil C,et al.The International Diabetes Federation diabetes atlas methodology for estimating global and national prevalence of diabetes in adults.Diabetes Research and Clinical Practice,2011,94(3):322-332.
[3] Yang W,Lu J,Weng J,et al.Prevalence of diabetes among men and women in China.New England Journal of Medicine,2010,362(12):1090-1101.
[4] Bhuvaneswari S,Yogalakshmi B,Sreeja S,et al.Astaxanthin reduces hepatic endoplasmic reticulum stress and nuclear factor-kappa B-mediated inflammation in high fructose and high fat diet-fed mice.Cell Stress and Chaperones,2014,19(2):183-191.
[5] Arunkumar E,Bhuvaneswari S,Anuradha C V,et al.An intervention study in obese mice with astaxanthin,a marine carotenoid,effects on insulin signaling and pro-inflammatory cytokines.Food &Function,2012,3(2):120-126.
[6] Ishiki M,Nishida Y,Ishibashi H,et al.Impact of divergent effects of astaxanthin on insulin signaling in L6cells.Endocrinology,2013,154(8):2600-2612.
[7] Kim Y J,Kim Y A,Yokozawa T.Protection against oxidative stress,inflammation,and apoptosis of highglucose-exposed proximal tubular epithelial cells by astaxanthin.Journal of Agricultural and Food Chemistry,2009,57(19):8793-8797.
[8] Dong L Y,Jin J,Lu G,et al.Astaxanthin attenuates the apoptosis of retinal ganglion cells in db/db mice by inhibition of oxidative stress.Marine Drugs,2013,11(3):960-974.
[9] Otsuka T,Shimazawa M,Nakanishi T,et al.Protective effects of a dietary carotenoid,astaxanthin,against lightinduced retinal damage.Journal of Pharmacological Sciences,2013,123(3):209-218.
[10] Zhao Z W,Cai W,Lin Y L,et al.Ameliorative effect of astaxanthin on endothelial dysfunction in streptozotocininduced diabetes in male rats.Arzneimittel-Forschung,2011,61(4):239-246.
[11] Chan K C,Pen P J,Yin M C,et al.Anticoagulatory and antiinflammatory effects of astaxanthin in diabetic rats.Journal of Food Science,2012,77(2):76-80.
[12] 陈志强,任璐,王昌禄,等.虾青素对四氧嘧啶致糖尿病小鼠降血糖作用研究.天然产物研究与开发,2008,20(6):1064-1087.Chen Z Q,Ren L,Wang C L,et al.Hypoglycemic effect on alloxan diabetic mice.Natural Product Research and Development,2008,20(6):1064-1087.(in Chinese with English abstract)
[13] Cicero A F,Rovati L C,Setnikar I,et al.Eulipidemic effects of berberine administered alone or in combination with other natural cholesterol-lowering agents.A single-blind clinical investigation.Arzneimittel-Forschung,2007,57(1):26-30.
[14] Jacobsson L S,Yuan X M,Ziedén B,etal.Effects ofαtocopherol and astaxanthin on LDL oxidation and atherosclerosis in WHHL rabbits.Atherosclerosis,2004,173(2):231-237.
[15] 罗仁勇,曾永兰.天然虾青素软胶囊降血脂功能的实验研究.现代预防医学,2009,36(4):731-732.Luo R Y,Zeng Y L.Effects of astaxanthin on blood fat in rats.Modern Preventive Medicine,2009,36(4):731-732.(in Chinese with English abstract)
[16] Curek G D,Cort A,Yucel G,et al.Effect of astaxanthin on hepatocellular injury following ischemia/reperfusion.Toxicology,2010,267(1):147-153.
[17] Monroy-Ruiz J,Sevilla M A,Carrón R,et al.Astaxanthinenriched-diet reduces blood pressure and improvescardiovascular parameters in spontaneously hypertensive rats.Pharmacological Research,2011,63(1):44-50.
[18] Cort A,Ozturk N,Akpinar D,et al.Suppressive effect of astaxanthin on retinal injury induced by elevated intraocular pressure.Regulatory Toxicology and Pharmacology,2010,58(1):121-130.
[19] 杨琼,张真,朱铉,等.虾青素对大鼠乙酸性胃溃疡的治疗作用.药学学报,2009,44(5):558-560.Yang Q,Zhang Z,Zhu X,et al.Therapeutic effect of astaxanthin on acetic acid-induced gastriculcer in rats.Acta Pharmaceutica Sinica,2009,44(5):558-560.(in Chinese with English abstract)
[20] 陈东方,王海玉,李立,等.天然虾青素缓解体力疲劳作用的实验研究.中国现代医学杂志,2010,20(17):2567-2569.Chen D F,Wang H Y,Li L,et al.Alleviative effect of natural astaxanthin on physical fatigue.China Journal of Modern Medicine,2010,20(17):2567-2569.(in Chinese with English abstract)
[21] 裴凌鹏,惠伯棣.虾青素抗去势雌性大鼠骨质疏松症实验研究.南京医科大学学报:自然科学版,2008,85(3):249-252.Pei L P,Hui B D.Effects of astaxanthin on osteoporosis in ovariectomized rats.Acta Universitatis Medicinalis Nanjing:Natural Science,2008,85(3):249-252.(in Chinese with English abstract)
[22] Santocono M,Zurria M,Berrettini M,et al.Influence of astaxanthin,zeaxanthin and lutein on DNA damage and repair in UVA-irradiated cells.Journal of Photochemistry and Photobiology B:Biology,2006,85(3):205-215.
[23] 徐叔云,卞如濂,陈修,等.药理实验方法学.3版.北京:人民卫生出版社,2001:203-204.Xu X Y,Bian R L,Chen X,et al.Experimental Methodology of Pharmacology.3rd ed.Beijing:People’s Medical Publishing House,2001:203-204.(in Chinese)
[24] 叶应妩,王毓三.全国临床检验操作规程.3版.南京:东南大学出版社,2006:474,479,485.Ye Y W,Wang Y S.National Guide to Clinical Laboratory Procedures.3rd ed.Nanjing:Southeast University Press,2006:474,479,485.(in Chinese)
欢迎订阅《浙江大学学报(农业与生命科学版)》
《浙江大学学报(农业与生命科学版)》是浙江大学主办的全国性、综合性、学术性期刊.主要刊登农业基础科学和应用科学研究论文.内容涵盖农业和生命科学各个领域,包括作物遗传育种爛种质资源;植物保护;生理生态;作物栽培;土壤肥料;园艺;农产品的贮藏爛保鲜爛加工;畜牧爛兽医;以及生命科学方面的专论,研究论文,快讯等.读者对象主要是国内外农业科学研究人员,农业院校的教师和研究生,以及综合性大学等有关农业科学的研究与管理人员.本刊近年的影响因子、总被引频次2项重要指标均名列全国农业高校学术期刊的前列;2001年入选中国期刊方阵;2004年在教育部全国高校科技期刊评比中荣获壹等奖,全国优秀农业期刊评比壹等奖;2005年获第三届国家期刊奖百种重点期刊奖;2006年再次荣获全国农业期刊评比壹等奖,首届中国高校优秀科技期刊奖;荣获中信所2008年度“中国百种杰出学术期刊"称号;2009年荣获“高校科技期刊优秀编辑质量奖";2010年获“第三届中国高校精品科技期刊奖";2011年获中信所“第二届中国精品科技期刊"和第二届“RCCSE中国权威学术期刊"称号;2012年获“第四届中国高校精品科技期刊奖";2014年获“第五届中国高校优秀科技期刊奖"、中信所“第三届中国精品科技期刊"和“浙江省优秀科技期刊特等奖"等;现为北京大学图书馆全国综合性农业科学类核心期刊.目前被美国《化学文摘》(CA),英国《国际农业与生物科学研究中心文摘》(CABI),俄罗斯《文摘杂志》(AJ),英国《动物学记录》(ZR),英国《食品科技文摘》(FSTA),联合国粮农组织农业索引(AGRIS),美国《乌利希期刊指南》(Ulrichsweb)及中国科学引文数据库,《中国学术期刊文摘》,中国期刊网《中国学术期刊(光盘版)》数据库,万方数据资源系统数字化期刊群数据库等国际国内重要检索系统收录.
《浙江大学学报(农业与生命科学版)》为双月刊,A4开本,128页,国内外公开发行.国内统一刊号:CN 33-1247/S,国际标准刊号:ISSN 1008-9209,邮发代号:32-48,国外代号:BM4108.定价每期30.00元/人民币,全年定价180.00元/人民币.
Intervention and regulation effect of Haematococcus pluvialis extract on blood glucose and lipid of diabetic mice.
Huang Heru1,2,Wang Shanshan1,Ni Xiaofeng1,Chen Riping2,Zhang Jiali 2,Chen Yixiang3,Shen Shengrong1*
(1.College of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310058,China;2.Zhejiang Academy of Medical Sciences,Hangzhou 310013,China;3.School of Electronics and Information,Zhejiang University of Media and Communications,Hangzhou 310018,China)
Haematococcus pluvialis extract;alloxan;diabetic mice;glucose tolerance;insulin tolerance
R 282.71;R 587.1;R 446.11+2
A
10.3785/j.issn.1008-9209.2015.05.121
浙江省重大科技专项(2014CO3015);浙江省医学科学院青年基金计划项目(2015Y005);浙江省科技厅公益性技术应用研究计划项目(2014C32006).
沈生荣(http://orcid.org/0000-0003-4096-1693),E-mail:shrshen@zju.edu.cn
联系方式:黄河儒(http://orcid.org/0000-0001-9976-2037),E-mail:zhudeluoji@126.com
2015-05-12;接受日期(Accepted):2015-07-03;< class="emphasis_bold">网络出版日期
日期(Published online):2015-11-18
URL:http://www.cnki.net/kcms/detail/33.1247.s.20151118.1814.020.html

