Cd2+对淡水底栖硅藻Nitzschiaamplectens生长的影响
李娅 支崇远 孙翠翠等

摘要:对不同浓度Cd2+中淡水底栖硅藻Nitzschia amplectens的存活数、叶绿素a含量及运动速度进行测定,以探索硅藻对重金属毒性的响应规律,为硅藻监测水体污染提供科学依据。纯化培养Nitzschia amplectens,生长数量达到7万个/mL时,加入不同浓度的Cd2+进行急性毒性和亚急性毒性胁迫培养。在急性毒性试验中,Nitzschia amplectens的存活数在96 h的EC50值为4.989 mg/L。在亚急性毒性试验中,培养15 d后Cd2+浓度为0.625、0 mg/L的Nitzschia amplectens运动平均速度为2.5、5.56 μm/s,其余试验组无运动迹象;培养13 d后,Cd2+浓度与叶绿素a含量呈负相关(P<0.05)。Cd2+浓度对Nitzschia amplectens的生长、运动速度和叶绿素a含量有明显影响,所以Nitzschia amplectens具监测水体重金属Cd2+污染潜力。
关键词:Nitzschia amplectens;重金属Cd2+;培养;生长;运动;叶绿素a;水质监测;指示生物
中图分类号: Q945.78;X832 文献标志码: A
文章编号:1002-1302(2015)03-0305-03
镉是一种生物毒性很强的重金属,能在有机体内积蓄,通过食物链传递富集可引起生物体生长缓慢甚至死亡[1]。随着工业的发展,大量的Cd2+向环境中排放,使得环境中的Cd2+污染加重。中国水体镉污染时有发生,2012年1月15日广西龙江河宜州拉浪段发现重金属镉超标,至1月21日18时污染事件已造成约28.1万尾鱼死亡。目前镉已被美国毒理管理委员会(ATSDR)列为第6位危及人体健康的有毒物质,被联合国组织确定为优先检测的环境污染物[2]。
底栖硅藻是一种单细胞生物,分布很广,是水体中的初级生产者,在光合作用下它们吸收水中的无机盐和二氧化碳,制造有机物[3-4],它们对净化水质具有重要意义。2000年欧共体水框架指南(Water Framework Directive of the European Union)推荐硅藻为水体监测生物指标。底栖硅藻对许多环境变量(pH值、光、盐度、温度、无机营养浓度等)敏感[5-6],它们与水体重金属关系的研究已有一些报道。Nitzschia amplectens Hustedt是中国西南地区河流中常见淡水底栖硅藻,其与重金属关系的系统研究报道甚少。探索Nitzschia amplectens与Cd2+的关系,可为生物监测水质增加新的内容。
1 材料与方法
1.1 藻种
藻种Nitzschia amplectens Hustedt采集于贵州省乌江上游毕节市七星关区层台镇玉龙乡河流中段。
1.2 仪器设备
主要仪器有显微镜(NIKON EOLIPSE 50i)、生化培养箱(SPX-250)、水浴锅、超净工作台、离心机和微量移液器等。
1.3 底栖硅藻自制培养基
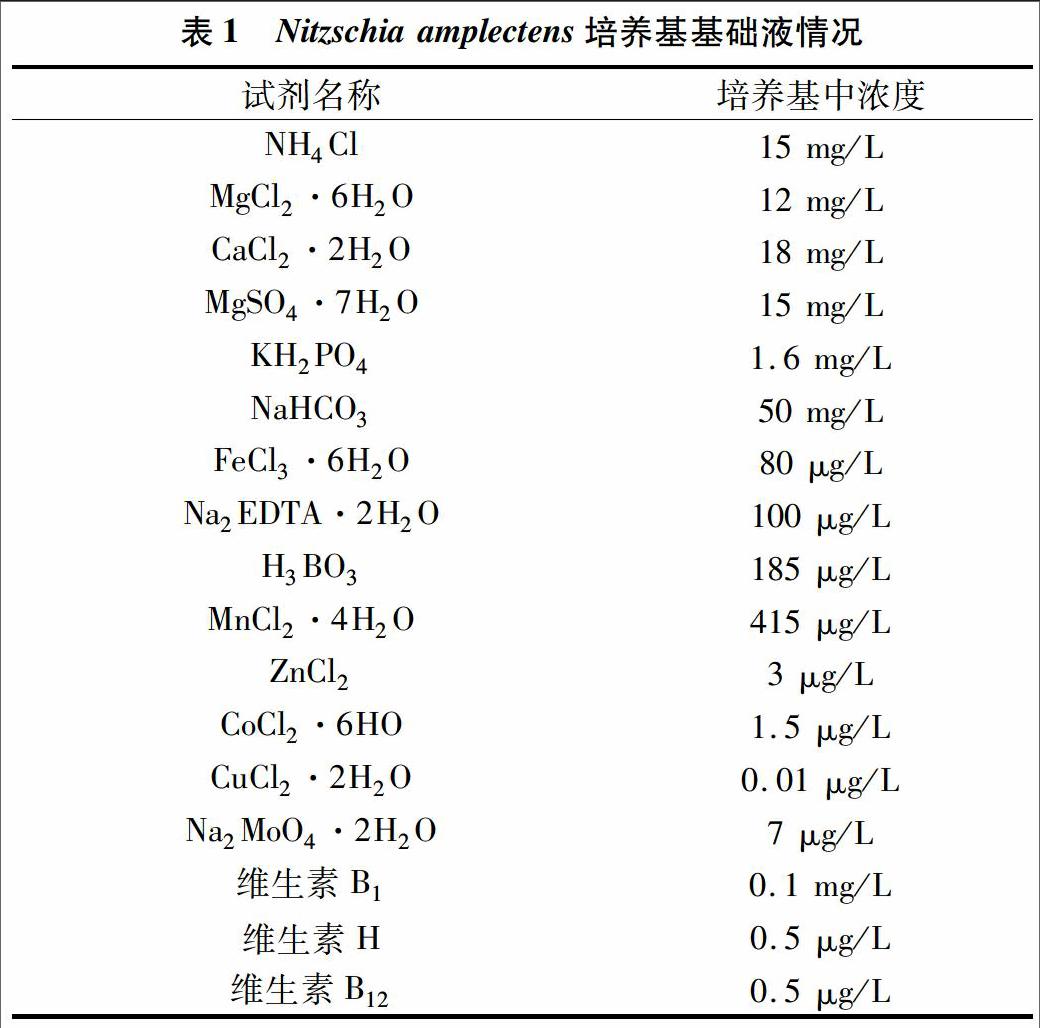
1.3.1 培养基基础液 培养基基础液配制见表1。
1.3.2 土壤浸出液配制 称取500 g土壤(土壤采集于贵州省贵阳市相宝山地区),去离子水1 L,混合后用塑料薄膜封口,沸水浴加热1 h,冷却,离心,过滤,取上清液,加蒸馏水至总体积1 000 mL,置于10.1 MPa高温下灭菌30 min,保存于 4 ℃ 备用。
1.3.3 Nitzschia amplectens培养基 将配制好的培养基基础液与土壤浸出液以一定的比例混合,用NaOH液将pH值调至7.5±0.5,经0.2 μm滤膜,灭菌,得到Nitzschia amplectens培养基。
1.4 纯化培养和胁迫培养
1.4.1 Nitzschia amplectens的分离及纯化培养 将野外采集的硅藻样品带回实验室,用50目的筛绢过滤水样,放于显微镜下观察,采用微吸管分离法,通过多次抓取,将Nitzschia amplectens藻种分离出来,即可将此放入自制培养基中在培养箱中培养。
培养条件:温度(24±1) ℃,光照周期12 h ∶12 h,光照度1 800 lx。每天12:00和19:00摇动藻液1 min,以防硅藻附在玻璃壁上。
1.4.2 Cd2+急性毒性胁迫培养 09:00—10:00在显微镜下用血球计数板统计藻密度,当藻种数量达到约7万个/mL时,用 500 mL 的培养瓶分装藻液,进行扩大培养,培养条件同“1.4.1”节。
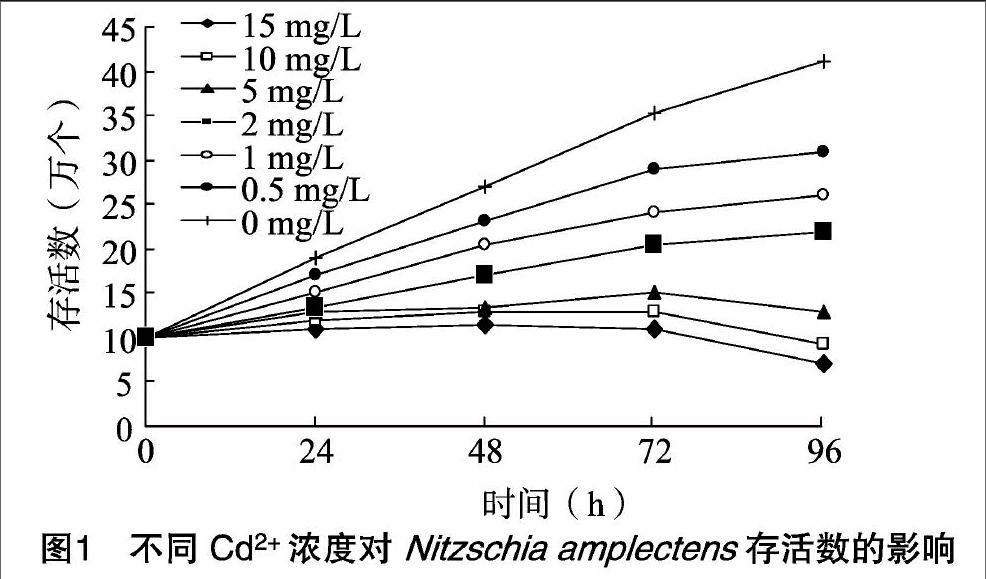
取7个100 mL培养瓶(1个对照组+6个试验组),加入藻液40 mL,藻液密度为7万个/mL,再分别在各培养瓶中滴加 Cd2+液,7个瓶中Cd2+浓度最终调节依次为0、0.5、1、2、5、10、15 mg/mL,重复3次。按“1.4.1”节培养条件培养,在培养后0、24、48、72、96 h取样,用血球计数板计数,所得数值通过计算得出96 h EC50值。先算出抑制率X:X=(I0-I)/I×100%(式中:I0为Cd2+浓度为0时的特定生长率;I为试验组特征生长率),通过SPSS的Probit分析计算得出EC50。
1.4.3 Cd2+亚急性毒性胁迫培养 取5个500 mL培养瓶(1对照组+4试验组),放入藻液200 mL,藻液密度7万个/mL,试验组Cd2+浓度梯度设置为96 h EC50、96 h EC50/2、96 h EC50/4、96 h EC50/8[7],对照组为空白。进行亚急性毒性培养(培养条件同“1.4.1”节)。观察期为15 d,前3 d每天09:00取样1次,之后每隔2 d取样1次,每次取样为10 mL,共计9次,对所取藻液进行叶绿素a含量的测定及对硅藻运动情况观测。endprint
随着Cd2+胁迫培养时间的延长,Cd2+对Nitzschia amplectens生长的抑制作用增强。96 h的EC50值为4.989 mg/L,根据藻类生长抑制毒性分级标准[9]可知,Cd2+对Nitzschia amplectens属于高毒,对其生长的抑制作用较大。
2.2.2 Cd2+浓度对Nitzschia amplectens运动状态的影响 由于硅藻的生殖方式为二分裂生殖,藻的体积会减小,运动情况也会受到影响,所以总体运动趋势处于缓慢下降。由图2可知,经过15 d的Cd2+胁迫培养,Cd2+浓度对Nitzschia amplectens的运动的抑制作用十分明显。1 d后,藻的运动速度与Cd2+浓度呈负相关关系,其一元回归线性方程为y=-0.409x+3.584(P<0.05),在Cd2+浓度为2.495 mg/L的藻液中,所有藻就已停止运动(Cd2+浓度为4.989 mg/L的藻液中,所有藻停止运动,未在图2中标出);在Cd2+浓度为1247 mg/L的藻液中培养7 d后,藻也停止了运动。由此可见,Cd2+浓度对Nitzschia amplectens的运动速度有很大的影响。
2.2.3 Cd2+对Nitzschia amplectens叶绿素a含量的影响
藻类的光合作用与其体内叶绿素的含量密切相关,叶绿素的含量若受到影响,则会影响藻细胞的生长,因此有必要对在Cd2+胁迫培养下的菱形藻的叶绿素a含量进行测定。由图3可知,在不同浓度Cd2+的条件下对藻培养15 d,前3 d 叶绿素a的总含量变化不是很大;培养后5 d,Cd2+浓度为4.989 mg/L的生长抑制率达到最大,叶绿素a总含量下降。5 d后,Cd2+浓度为4.989、2.495、1.247 mg/L藻液中的叶绿素a含量基本不再增加,对照组的叶绿素a含量则明显增加,说明Cd2+对该种菱形藻的的叶绿素a含量有一定影响。计算13 d后叶绿素含量与Cd2+浓度相关系数r=-0.797,呈负相关关系,一元回归线性方程为y=-0.251x+4.782(P<0.05),说明Cd2+浓度对藻光合作用能力有一定影响,且随着培养时间和Cd2+作用时间的延长而增加影响力度。
3 结论与讨论
生物监测是理化监测的重要补充,用生物监测进行配合,充分利用指示生物对污染物毒性反应的敏感性,便能较准确地反映真实的污染状况[10]。菱形藻为污水藻,本试验对象选取菱形藻属中的Nitzschia amplectens,该种生物对重金属响应的报道极少,而它又是中国西南河流中常见的硅藻种。因此,希望通过本试验可以提供一些科学数据。在预试验培养时使用f/2培养基、土壤浸出液以及土壤浸出液和培养基基础液混合液作为培养基,经观察得出使用土壤浸出液与培养基础液按一定比例混合后用作培养基中的藻数量增长最快,藻的运动情况较好,因此,将其作为本试验中Nitzschia amplectens的培养基。将通过分离和纯化培养得到纯种Nitzschia amplectens用于不同浓度的Cd2+藻液中进行急性毒性试验和亚急性毒性胁迫培养试验,测定96 h EC50、叶绿素a含量及其运动的平均速度,并对这些测定数据进行分析。藻液中的Cd2+浓度与对该藻生长呈负相关关系,且随着时间的延长,特别是亚急性毒性胁迫培养试验5 d后,Cd2+浓度对该藻的叶绿素a含量及运动状况的影响程度明显逐渐增强,该反应可用于水环境的检测。
目前,国内外已对多种硅藻受单一重金属胁迫的影响进行了大量研究[11],将20世纪90 年代之后微藻受单一重金属胁迫的LC50或EC50值进行总结,但尚未见Nitzschia amplect的EC50研究报道。若对比该藻种在Cd2+胁迫培养与其他硅藻[如三角褐指藻(Pheodactylum tricornutum)、新月菱形藻Nitzschia closterium等]的96 h EC50值,其值明显较大[12],说明Nitzschia amplectens对Cd2+耐受程度较弱,对Cd2+浓度变化反应敏感,可用于监测水体中的重金属Cd2+含量。
一般情况下,重金属对藻类生理、生化功能的影响主要表现在抑制光合作用、减少细胞色素、导致畸变以及改变天然环境中藻类的组成。此外,有关藻类的DNA、RNA、蛋白质合成及酶活性等方面也有报道[13]。本试验对Nitzschia amplectens在 15 d 内进行不同浓度Cd2+亚急性毒性胁迫培养,结果显示,藻的叶绿素a含量的增加受到明显抑制。邱昌恩研究发现,重金属离子能通过阻碍光合作用电子传递,抻串4蛋白质合成,对藻细胞线粒体形成损伤使叶绿体变形[14],如叶绿体收缩、类囊体膨胀、基粒结构解体、基质减少、质体小球大量增加等现象[15-16],从而降低了藻细胞中的叶绿素a的含量。藻细胞生存生长的能量来源于光合作用,而光合作用发生在叶绿体片层中。类囊体膜上含有各种光台色素,光合片层基质中含有光合作用暗反应所需的酶系统,光合片层受损,意味着光合作用酶系统受到影响,能量转化无法顺畅完成,导致细胞生长受到影响,从而必定会影响藻的运动。
通过多次试验观察发现,在09:00—10:00期间,Nitzschia amplectens 最活跃,因此将试验情况观察时间定在这一时段。Cd2+浓度为4.989、2.495 mg/L时,所有藻停止运动,因此Cd2+浓度最高点设定在2.495 mg/L。通过观测运动情况发现,Cd2+对Nitzschia amplectens运动速度有很大的影响,可能是胞外蛋白聚糖(EPS)与硅藻运动有关[17-18]。今后可以深入开展Nitzschia amplectens胞外产物与运动情况相关的试验。
参考文献:
[1]张征田,庞振凌,夏 敏,等. 镉污染对不同生境拟水狼蛛氧化酶和金属硫蛋白应激的影响[J]. 生态学报,2011,31(16):4579-4585.endprint
[2]张乃星,曹丛华,任荣珠,等. 胶州湾外海洋倾倒区表层沉积物中的重金属及其潜在生态风险[J]. 环境科学,2011,32(5):1315-1320.
[3]王 倩. 黔、桂珠江水系底栖硅藻群落分布特征及其与环境变量间的相关性研究[D]. 贵阳:贵州师范大学,2009.
[4]Kelly M G,Cazaubon A,Coring E,et al. Recommendations for the routine sampling of diatoms for water quality assessments in Europe[J]. J Applied Phycol,1998,10:215-224.
[5]Whitton B A,Rott E. Use of Algae for monitoring rivers:Ⅱ[M]. Innsbruck:Institutfür Botanik,Universitt Innsbruck,1996,196.
[6]邢荣莲. 海洋底栖硅藻的筛选、培养和应用研究[D]. 大连:大连理工大学,2007.
[7]周启星,孔繁翔,朱 琳. 生态毒理学[M]. 北京:科学出版社,2004.
[8]姚南瑜. 藻类生理学[M]. 大连:大连工学院出版社,1987:120-121.
[9]国家环境保护总局,《水和废水监测分析方法》编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:721.
[10]路艳君. 重金属离子对盐藻和新月菱形藻的生长的影响[D]. 烟台:烟台大学,2010.
[11]油秋平,支崇远,王 璐,等.赤水河底栖硅藻多样性及其与重金属相关性分析[J].江苏农业科学,2013,41(10):347-349.
[12]Sun B Y,Ya P,Shi Z L,et al. Effects of chromium(Ⅵ) on the growth phytoplankton in sea water[J]. J Ocean Univ Qingdao,1990,20(4):1-8.
[13]姜彬慧,林碧琴. 重金属对藻类的毒性作用研究进展[J]. 辽宁大学学报:自然科学版,2000,27(3):281-287.
[14]邱昌恩. 六种常见重金属对藻类的毒性效应概述[J]. 重庆医科大学学报,2006,31(5):776-778.
[15]Li R C. Effects of cadmium and Lead on physiological and ultrastructural features in tobacco leaves[J]. Acta Phytoecologica Sinica,2000,24(2):238-242.
[16]Fernandes J C,Henriques F S. Biochemical,physiological,and structural effects of excess copper in plants[J]. The Botanical Review,1991,57(3):246-273.
[17]Gordon R,Drum R W. A capillarity mechanism for diatom gliding locomotion[J]. Proc Natl Acad Sci USA,1970,67:338-344.
[18]Edgar L A,Pickett-Heaps J D. Diatom locomotion[J]. Prog Phycol Res,1984,3:47-88.endprint

