农杆菌浸种对甘蓝种子萌发及幼苗生长的影响
李光远 王凤华 蒋燕
摘要:采用不同D600 nm值的农杆菌菌液浸泡甘蓝种子,研究农杆菌浸种对甘蓝种子萌发及幼苗生长发育的影响,并检测其转化效果。结果发现,农杆菌浸种对甘蓝种子的发芽率、发芽指数、活力指数均有抑制作用,且D600 nm值越高,抑制作用越明显。此外,农杆菌浸种对甘蓝幼苗的株高、叶面积、根茎比、鲜质量均有显著抑制作用。叶绿素含量随D600 nm值增大,呈先增加后降低的趋势,D600 nm为0.8时,叶绿素含量最高,为7.86 mg/g,D600 nm 为1.6时,叶绿素含量最低,为5.64 mg/g。农杆菌浸种不影响SOD活性,但POD、CAT活性均随着D600 nm值的升高而升高。农杆菌浸种能获得一定的PPT抗性苗,其中D600 nm 为0.8时获得的抗性苗最多,达到10.32%。PCR结果显示农杆菌浸种能实现基因的转化,其中D600 nm 为1.6时转化率最高,达到2.33%。
关键词:甘蓝;农杆菌浸种;种子萌发;幼苗;转化
中图分类号: S635.04 文献标志码: A
文章编号:1002-1302(2015)03-0139-03
农杆菌介导的遗传转化是目前较广泛应用的转基因方法,但是常规的农杆菌介导法依赖于组织培养[1-2],导致其应用受到一定的限制。农杆菌浸种法是近年诞生的一种转基因方法,是将萌发的种子直接浸在农杆菌菌液中,利用农杆菌的浸染特性和植物细胞自身的物质转运系统把外源基因导入受体细胞并整合到基因组中稳定表达,从而实现遗传转化[3],如Feldmann等首次利用农杆菌浸种法将npt[QX(Y15]Ⅱ[QX)]基因导入了拟南芥[4],该方法后来相继在水稻、小麦、黄瓜、番茄、中华结缕草等植物遗传转化中取得了成功[5-8]。甘蓝的遗传转化研究起步早,目前已相继导入抗虫基因Bt、蛋白酶抑制剂基因、育性基因、抗病基因、生长素基因等[9]。纵观甘蓝的遗传转化,最常采用的方法还是依赖于组织培养的农杆菌介导的遗传转化,笔者所在实验室采用该传统的转化方法获得了部分激活标签突变体[10],但是转化效率低下,且需要在无菌条件下进行离体操作。因此,本研究将采用农杆菌浸种法,将含激活标签pSKI015的农杆菌转化甘蓝,调查浸种对甘蓝种子萌发及幼苗生长的影响,并探讨其转化效果,以期获得一种甘蓝激活标签突变体材料的简便转基因方法。
1 材料与方法
1.1 供试材料
供试甘蓝为夏光种子,供试农杆菌为GV3101(含质粒pSKI015)。
1.2 农杆菌的培养
用LB培养基接种农杆菌,28 ℃、220 r/min振荡培养过夜,分光光度计测定600 nm下的D值。
1.3 农杆菌浸种
取成熟饱满发芽率85%以上的种子,用0.4% KMnO4浸种6 min,无菌水冲洗3~4次,25 ℃催芽。待种子80%露白时,再用无菌水冲洗干净,加入农杆菌液,农杆菌菌液D600 nm分别为0(未加入农杆菌的LB溶液,对照)、0.4、0.8、1.2、1.6。浸种2 h,倒掉菌液,25 ℃黑暗条件下培养2 d后转入铺有滤纸的培养皿(滤纸使用1 mg/L的PPT浸湿,适时补加),置于 20 ℃、14 h/d光照的培养箱中培养,观察记载发芽情况。
1.4 幼苗移栽
种子发芽后统计发芽率、发芽势、活力指数。用自来水将幼苗冲洗干净,移栽于穴盘培养。
1.6 生理指标测定
取移栽30 d的苗,测定各生理指标[11]。采用丙酮提取法测定叶绿素含量,氮蓝四唑光化还原法测定超氧化物歧化酶(SOD)活性,紫外吸收法测定过氧化氢酶(CAT)活性,愈创木酚法测定过氧化物酶(POD)活性。
1.7 PPT抗性苗筛选
浸种后的种子播种在含1 mg/L PPT的培养皿中发芽,移栽穴盘后后喷施10 mg/L Basta溶液。
1.8 PCR检测
CTAB提取PPT抗性苗叶片基因组DNA,以BarF (5′-TCGACTCTAGCGAATTC)和BarR(5′-ATAGGCGTCTCGCATATCTC)为引物扩增长度为700 bp的bar基因,未转化的甘蓝为阴性对照,pSKI015为阳性对照,扩增方法和程序参照王爱荣等的方法[12]。PCR 反应总体积 25μL。扩增程序:5 ℃ 预变性5 min;95 ℃变性 30 s,60 ℃退火 30 s,72 ℃延伸 35 s,30 个循环;72 ℃延伸 5 min。取扩增产物10 μL于1% 琼脂糖凝胶上电泳。
1.9 数据处理
用SPSS系统软件进行数据处理,Microsoft Excel软件作图,P<0.05作为显著性检测标准。
2 结果与分析
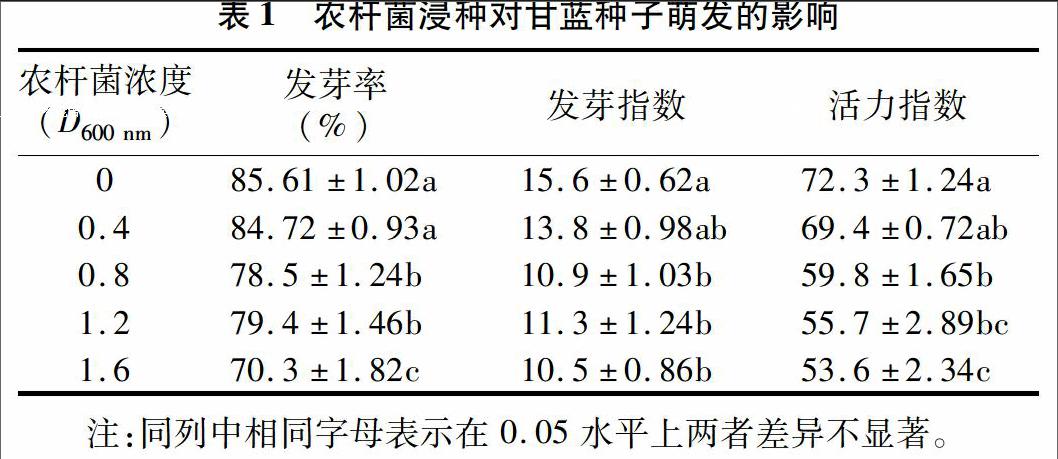
2.1 农杆菌浸种对甘蓝种子萌发的影响
由表1可知,随着农杆菌D600 nm的升高,甘蓝种子发芽率基本呈现下降趋势,其中D600 nm 为0.4时,与对照差异不显著,但是D600 nm为0.8、1.2、1.6时的发芽率显著低于对照,D600 nm为1.6时,发芽率最低,D600 nm为0.8 和D600 nm为1.2处理之间差异不显著。发芽指数的变化与发芽率的变化类似,随着D600 nm的升高而降低,除D600 nm为 0.4与对照差异不显著外,其他各处理的种子发芽指数均显著低于对照。种子活力指数的变化也是随着D600 nm的升高而降低。除D600 nm为 0.4与对照差异不显著外,其他各处理的种子活力指数均显著低于对照。不同的D600 nm之间也存在差异,其中D600 nm 为1.6处理下,种子的活力指数最低,仅为53.6%。由此可知,农杆菌的D600 nm过高,对甘蓝种子的萌发有抑制作用。
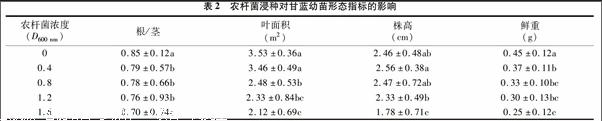
2.2 农杆菌浸种对甘蓝幼苗生长的影响
由表2可知,对照组的根茎比最大,且随着D600 nm值的增加,根茎比逐渐减小,所有处理的根茎比均显著低于对照,D600 nm为 0.4、0.8、1.2 3者之间差异不大,D600 nm为1.6处理时的根茎比最低,仅为0.70,比对照降低了约18%。因此,农杆菌浸种对甘蓝幼苗的根茎比有抑制作用。甘蓝幼苗的叶面积也随着D600 nm值的增加而降低,其中D600 nm为 0.4与对照差异并不显著,对照组的叶面积最大,D600 nm为 1.6的叶面积最小。由此可知,农杆菌浸种对甘蓝幼苗叶面积有抑制作用,在D600 nm高于0.8时开始表现较明显的抑制效应。株高的变化与根茎比和叶面积的变化有所不同,仅在D600 nm为1.2、1.6下表现抑制效应。在D600 nm达到1.6时,株高仅为对照的72%。所有单株鲜质量中,对照组最大,与各处理之间差异显著。D600 nm值为1.6时单株鲜质量最低,仅为对照的56%,D600 nm 为0.4、0.8、1.2 3组之间差异不显著。由此可见,农杆菌浸种对甘蓝幼苗生长存在一定的抑制作用。
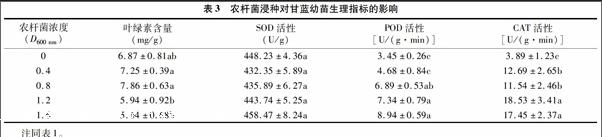
2.3 农杆菌浸种对甘蓝生理指标的影响
由表3可以看出,在农杆菌D600 nm低于0.8时,随D600 nm的增大,叶绿素含量增加,D600 nm为0.8时,叶绿素含量达到最大值,之后随着D600 nm的进一步增大,叶绿素含量开始下降,且明显低于对照,在D600 nm 达到1.6时,叶绿素含量最低。由此可知,高浓度农杆菌菌液浸种会降低甘蓝的叶绿素含量。
表3还显示,各处理之间SOD活性差异并不显著,说明农杆菌浸种并不影响SOD活性。POD活性均随着D600 nm值的增大而升高,对照组的POD活性最低,当D600 nm值大于0.8时POD活性显著提高,说明农杆菌已经对甘蓝造成胁迫,POD活性提高,其清除自由基的能力也提高,从而避免植株受到伤害。CAT活性的变化也是随着农杆菌菌液浓度升高而增加,当D600 nm大于0.4时,其与对照的差异已经达到显著水平。由此可见,农杆菌菌液浸种对甘蓝是一种胁迫,为了提高其适应逆境的能力,POD活性升高以清除产生的自由基。
2.4 农杆菌浸种对PPT抗性苗率及转化率的影响
由表4可以看出,采用农杆菌浸种甘蓝能获得一定的PPT抗性苗,其中D600 nm 为0.8时获得的抗性苗最多,PPT抗性苗率可以达到10.32%,D600 nm 为1.6时获得的抗性苗最少,仅为8.34%。
提取PPT抗性植株叶片的基因组 DNA,进行PCR 扩增,部分植株扩增到了长约为 700 bp的片段(图1-B、C、D、G、H),与从质粒Pski015扩增出的片段基本相同(图1-J),说明基因已经整合到了转化植株中,但也有例外,如图1-E扩增出的片段明显比对照大,具体原因有待进一步研究。
经PCR检测,统计转化率结果如表4。由表4可以看出,转化率的大小依次为D600 nm 0.4 3 讨论 植物在逆境条件下通常会表现出衰老症状,如叶绿素含量降低,蛋白质、核酸等大分子水解加速,原生质膜以及内膜系统发生过氧化,膜脂过氧化产物MDA含量增加,POD酶促防御系统活性下降等[13]。本研究结果表明甘蓝幼苗叶片中的叶绿素含量随菌液D600 nm值的增加成先升高后降低的趋势,在 D600 nm为0.8时,叶绿素含量达到最大值,之后开始下降,这与徐开杰等的研究结果[14]有所不同,他们发现随着农杆菌菌液浓度升高,小麦幼苗叶片中叶绿素含量呈下降趋势。徐开杰等的结果显示小麦POD活性随农杆菌菌液浓度升高呈先升后降的趋势[14],而本研究证实甘蓝的POD随着D600 nm的增加一直成上升趋势。本研究结果还表明随着农杆菌菌液浓度升高,甘蓝种子发芽率、发芽势、幼苗株高、鲜质量含量呈下降趋势,这与徐开杰等的结果[14]一致。因此,农杆菌浸种对甘蓝是一种胁迫作用,特别是高浓度的农杆菌会影响萌发和幼苗的生长代谢。 转化率是衡量转化效果的重要指标,本研究结果表明在低D600 nm值时(D600 nm<0.8),转化率为零,这与陈明利等的结果[15]类似,他们认为农杆菌浓度D600 nm值小于0.5时,即使采用长时间侵染,转化效率也不高。但是农杆菌菌液浓度也不宜过高,如本研究中在D600 nm为1.6时,获得的转化率虽然较高,但是在此处理下甘蓝幼苗生长严重受抑、甚至死亡。陈明利等发现,当农杆菌菌液D600 nm超过1.5时,对小麦种子萌发和幼苗生长发育产生了较为严重的伤害作用,小麦种子发芽率显著降低,幼苗出现生长减慢、停止甚至出现白化、最终死亡的现象[15]。他们认为从获得转基因植株的规模方面考虑,农杆菌菌液D600 nm不超过1.5,这与本研究结果是一致的。 目前,依赖于组织培养的农杆菌介导的遗传转化仍然是甘蓝转基因研究的主要手段。但是这种方法操作繁琐,需要高频率的再生系统,特别是组织培养要求无菌,而农杆菌本身又是一种细菌,这增加了无菌操作的难度。因此,探索一种简单、快捷、高效的遗传转化方法势在必行。种子浸泡法是最近诞生的一种用于植物转化的方法,已经取得了一定的成功。本研究证实采用农杆菌浸种甘蓝也可以实现基因的转移,虽然转化率仅为2.33%,但今后深入研究将有助于获得转化率更高的转基因转化体系。 参考文献: [1]刘 凡,王国英,曹鸣庆. 农杆菌介导的植物原位转基因方法研究进展[J]. 分子植物育种,2003,1(1):108-115.
[2]郑 杰. 农杆菌介导的高效水稻遗传转化体系的研究[J]. 湖南农业科学,2008(2):6-7,10.
[3]张庆祝,韩天富. 植物非组培遗传转化方法研究的进展[J]. 分子植物育种,2004,2(1):85-91.
[4]Feldmann K A,Marks M D. Agrobaterium mediated transformation of germinating seeds of Arabidopsis thaliana:a non-tissue culture approach[J]. Molecular & General Genetics,1987,208:1-9.
[5]许 耀,王 艇,李宝健. 根癌农杆菌介导的外源基因转化植物萌动种胚的研究[J]. 实验生物学报,1991,24(2):109-117.
[6]奚亚军,张启发,林拥军,等. 利用农杆菌浸种法将叶片衰老抑制基因PSAG12-IPT导入普通小麦的研究[J]. 中国农业科学,2004,37(8):1235-1238.
[7]雷江丽,王 丹,吴燕民,等. 农杆菌浸种法介导中华结缕草遗传转化体系的建立[J]. 农业生物技术学报,2009,17(5):865-871.
[8]林拥军. 农杆菌介导的水稻高效遗传转化体系的研究[D]. 武汉:华中农业大学,2001.
[9]秦耀国,雷建军,曹必好,等. 甘蓝类蔬菜遗传转化研究进展[J]. 中国蔬菜,2004(4):61-63.
[10]王凤华,陈双臣,李光远,等. 激活标签转化结球甘蓝的研究[J]. 西北植物学报,2009,29(5):905-909.
[11]张立军,樊金娟. 植物生理学实验教程[M]. 北京:中国农业大学出版社,2007.
[12]王爱荣,吴智芳,张丽丽,等. 影响拟南芥转化效率和激活标签丢失的因素分析[J]. 福建农林大学学报:自然科学版,2006,35(3):298-302.
[13]徐开杰,孟 敏,史丽丽,等. 农杆菌对大麦种子萌发及幼苗生长发育的影响[J]. 西北植物学报,2009,29(7):1408-1414.
[14]徐开杰,史丽丽,刘曙东,等. 农杆菌浸种处理对小麦种子萌发及幼苗生长发育的影响[J]. 西北植物学报,2011,31(5):985-994.
[15]陈明利,刘香利,唐广立,等. 农杆菌侵染小麦的优化方案[J]. 分子植物育种,2007,5(4):577-582.

