促红细胞生成素抑制TGF-β诱导的大鼠心肌成纤维细胞增殖
王丽萍,王丽君,王小君
(河北联合大学 基础医学院 1.生理学系; 2.唐山市慢性病临床基础研究重点实验室, 河北 唐山 063000)
研究论文
促红细胞生成素抑制TGF-β诱导的大鼠心肌成纤维细胞增殖
王丽萍1,2*,王丽君1,2,王小君1,2
(河北联合大学 基础医学院 1.生理学系; 2.唐山市慢性病临床基础研究重点实验室, 河北 唐山 063000)
目的探讨促红细胞生成素在大鼠心肌成纤维细胞(CFs)增殖中的作用。方法培养大鼠CFs。实验分为对照组(control)、TGF-β刺激组(TGF-β终浓度为5 μg/L)和重组人促红细胞生成素(rhEPO,5 000 U/L)干预组: 1 h后加入TGF-β。24 h后计数细胞并采用MTT法观察细胞增殖;免疫细胞化学及Western blot法检测α-SMA表达,观察细胞转化;羟脯氨酸定量检测细胞胶原含量;Western blot法检测细胞Ⅰ、Ⅲ型胶原蛋白及MMP- 2、MMP- 9表达。结果与对照组比较,TGF-β使细胞明显增殖(P<0.05),Ⅰ、Ⅲ型胶原蛋白合成(P<0.05)、α-SMA表达(P<0.05)、细胞MMP- 2、MMP- 9表达增多(P<0.05)。使用重组人促红细胞生成素(rhEPO)干预后,CFs增殖、α-SMA表达及Ⅰ、Ⅲ型胶原蛋白合成较TGF-β组均显著降低 (P<0.05),MMP- 2、MMP- 9表达进一步增多(P<0.05)。结论生理剂量EPO可抑制TGF-β诱导的大鼠CFs增殖、转化及胶原的合成,促进胶原降解。
促红细胞生成素;心肌纤维化;心肌成纤维细胞
心肌纤维化(myocardial fibrosis, MF)是心血管疾病发生发展到一定阶段的重要病理过程,是心室重塑持续发展和难于逆转的主要原因,其发生机制至今仍未明确。心肌成纤维细胞(cardiac fibroblasts,CFs)增殖、表型转化、分泌胶原增多及各型胶原比例失调是MF最主要的变化。但CFs增殖及迁移的原因及机制还不清楚。
促红细胞生成素(erythropoietin,EPO)主要由肾脏皮、髓质交界处的管周细胞合成,属造血生长因子家族。EPO通过与跨膜受体(erythropoietin-receptor,EPO-R)结合,调节红系祖细胞的分化、凋亡,刺激幼稚红细胞增生、分化和成熟。EPO还具有广泛的非造血作用。大量研究表明,EPO可通过抗细胞凋亡、抗氧化应激、抗感染和促进血管新生等,对心血管发挥保护作用[1- 2]。对CFs的研究发现,EPO与依那普利合用可通过降低心肌氧化应激反应而抑制CFs的增殖和血管疾病的发生[3]。但EPO在心肌重构中的作用及机制还未见明确报道。本研究以CFs为研究对象,旨在探讨EPO在心肌重构中的可能作用和机制。
1 材料与方法
1.1 实验动物和主要试剂
SPF级雄性SD大鼠,体质量220~250 g,动物合格证号SCXK(京2009- 0008)(河北联合大学实验动物中心)。
重组人促红细胞生成素(rhEPO)注射液(北京四环生物制药股份有限公司);转化生长因子-β(TGF-β)和MTT试剂(Sigma公司);免疫细胞化学试剂盒(碧云天生物试剂公司);Western blot 相关试剂(Amresco公司);兔抗α-SMA、collagen Ⅰ、collagen Ⅲ、MMP- 2、MMP- 9多克隆抗体(Abcom公司)
1.2 CFs原代培养
常规原代培养大鼠CFs[4],取第一代细胞用于实验。
1.3 实验分组
将细胞分成3组:1) 对照组; 2) TGF-β组:加入终浓度为5 μg/L的TGF-β;3)EPO组:终浓度为5 000 U/L EPO预孵育1 h后,加入终浓度为5 μg/L的TGF-β。
1.4 MTT法检测CFs增殖
将对数增殖期CFs均匀接种于96孔培养板中,细胞2×104个/孔。常规培养24 h后,用含0.5%胎牛血清的DMEM继续培养24 h后,进行分组加药。24 h后每孔加入20 μL MTT(5 g/L),孵育4 h后吸掉孔内培养液,加入100 μL DMSO,振荡,490 nm波长处测其吸光度A值。
1.5 免疫细胞化学法检测CFs表型转化
爬片细胞用4%多聚甲醛固定60 min后,加入1∶50的H2O2/甲醇,室温孵育30 min,去除过氧化物酶; 0.5% Triton X-100室温孵育30 min;5% 牛血清白蛋白室温封闭60 min;滴加稀释好的一抗(抗-α平滑肌肌动蛋白,1∶500),4 ℃过夜。37 ℃复温30 min,在细胞上滴加二抗(1∶150),37 ℃孵育30 min; 中性树脂封片,显微镜下观察。
1.6 Western blot法检测CFs中Ⅰ、Ⅲ型胶原蛋白及MMP- 2、MMP- 9的表达
取细胞培养上清液,10% 聚丙烯酰胺凝胶蛋白电泳分离蛋白,300 mA转膜2 h将蛋白转至硝酸纤维素膜。1% 牛血清白蛋白(BSA)封闭1 h。滴加一抗(抗-Ⅰ型胶原、抗-Ⅲ型胶原、抗-基质金属蛋白酶2、抗-基质金属蛋白酶9),4 ℃过夜;滴加二抗,室温1 h;化学发光试剂放射自显影。
1.7 统计学分析
2 结果
2.1 EPO对TGF-β介导的大鼠CFs增殖的影响
5 μg/L TGF-β作用24 h能明显刺激CFs增殖(P<0.01),EPO能明显抑制TGF-β的促增殖作用(P<0.05)(图1)。
2.2 EPO对TGF-β介导的大鼠CFs表型转化的影响
在TGF-β刺激CFs增殖的过程中,myoFb标志物α-SMA表达增强,而EPO干预使其表达明显回降(P<0.01)(图2)。
2.3 EPO对TGF-β介导的大鼠CFs中Ⅰ、Ⅲ型胶原蛋白表达的影响
TGF-β使CFs培养上清液中胶原含量及Ⅰ、Ⅲ型胶原蛋白的表达增强(P<0.01),EPO的干预使CFs胶原合成明显减少(P<0.05)(图3)。

A.CFS proliferation by cell counting; B.CFS proliferation by MTT(n=6),*P<0.05 compared with control;#P<0.05 compared with TGF-β group
图1 EPO对TGF-β介导的大鼠CFs增殖的影响
Fig 1 Effects of EPO on CFs proliferation induced by TGF-β(n=5)
A.α-SMA expression in CFS by immunocytochemical staining (×400); B.α-SMA expression in CFS by Western blots;*P<0.05 compared with control;#P<0.05 compared with TGF-β group
图2 EPO对TGF-β介导的大鼠CFs上α-SMA表达的影响
Fig 2 Effects of EPO on expression of α-SMA in CFs induced by TGF-β
2.4 EPO对TGF-β介导的大鼠CFs中MMP- 2、MMP- 9表达的影响
与对照组相比,TGF-β诱导CFs表达MMP- 2、MMP- 9增加(P<0.01),EPO组MMP- 2、MMP- 9表达较TGF-β组进一步增多(P<0.01)(图4)。

A.collagen expression in CFS by hydroxyproline kit; B.expression of Ⅰ,Ⅱ collagen in CFS by Western blot; *P<0.05 compared with control; #P<0.05 compared with TGF-β group图3 EPO对TGF-β介导的大鼠CFs中Ⅰ、Ⅲ型胶原蛋白表达的影响Fig 3 Effects of EPO on expression of collagenⅠand Ⅲ in CFs induced by TGF-β(n=5)
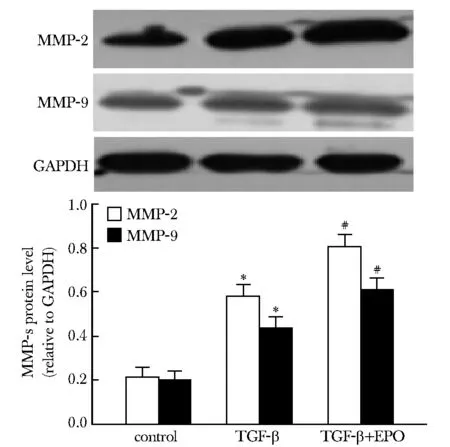
*P<0.05 compared with control; #P<0.05 compared with TGF-β group图4 EPO对TGF-β介导的大鼠CFs中MMP- 2、MMP- 9表达的影响Fig 4 Effects of EPO on expression of MMP- 2 and MMP- 9 in CFs induced by TGF-β(n=5)
3 讨论
研究结果显示,TGF-β导致大鼠CFs增殖、转化及胶原合成, EPO可使这些变化减轻。提示EPO可能有抑制MF发生的作用。
已有大量研究证实EPO对心肌的保护作用。EPO 与EPOR 相互作用可通过MAPK、P13K-AKT以及JAK2-STATS蛋白等途径,抑制心肌凋亡[5-9]。EPO参与心肌炎性反应。研究显示, rhEPO可显著减少中性粒细胞浸润,减弱缺血再灌注诱导的核因子-κB(NF-κB)和活化蛋白-1(AP- 1)的活性,减少炎性因子产生,增加抗炎因子生成,降低心肌炎性反应[10]。EPO还可上调血管内皮生长因子(vascular endothelial growth factor,VEGF)水平,促进梗死区周围血管生成,减少梗死面积[11- 12]。
EPO在心肌重构中的作用受到广泛重视。研究显示,EPO-R在心肌血管内皮细胞、CFs和心肌细胞中均有表达。灌注EPO可使心肌中MAP激酶P42/P44磷酸化,使缺血再灌注后心肌细胞损伤减轻,最大程度恢复左室舒张压和冠脉血流。在心肌梗死的C57BL/6小鼠,应用EPO干预治疗显著促进了左室的舒张过程,进而使左室射血分数维持稳定[9]。EPO还可抑制由Ang Ⅱ诱导的心肌成纤维细胞中TGF-β的生成及胶原的产生[13]。
本研究用TGF-β刺激大鼠CFs增殖后,发现生理剂量EPO可抑制TGF-β诱导的大鼠CFs增殖,减少myoFb标志物α-SMA的表达,说明其可能参与了抑制MF的过程。结果还显示, TGF-β诱导大鼠CFs上Ⅰ、Ⅲ型胶原合成增多, EPO则使其表达下降;同时,EPO使TGF-β诱导的大鼠CFs上MMP- 2及MMP- 9表达进一步增加,表明EPO可抑制TGF-β诱导的胶原合成,促进胶原降解。进一步提示EPO在MF发生发展过程中可能具有重要作用,但其具体机制有待深入研究。
[1] Mocini D, Leone T, Tubaro M,etal. Structure, production and function of erythropoietin: implications for therapetical use in cardiovascular disease[J]. Curr Med Chem, 2007, 14:2278- 2287.
[2] Sanchis-Gomar F, Garcia-Gimenez JL, Pareja-Galeano H,etal. Erythropoietin and the heart: physiological effects and the therapeutic perspective[J]. Int J Cardiol, 2014,171:116- 125.
[3] Gut N, Piecha G, Aldebssi F,etal. Erythropoietin combined with ACE inhibitor prevents heart remodeling in 5/6 nephrectomized rats independently of blood pressure and kidney function[J]. Am J Nephrol, 2013,38:124- 135.
[4] Wang LP, Wang Y, Zhao LM,etal. Angiotensin Ⅱ upregulates KCa3.1 channels and stimulates cell proliferation in rat cardiac fibroblasts[J]. Biochem Pharmacol, 2013,85:1486- 1494.
[5] Watson AJ, Gao L, Sun L,etal. Enhanced preservation of the rat heart after prolonged hypothermic ischemia with erythropoietin-supplemented Celsior solution[J]. J Heart Lung Transplant, 2013, 32:633- 640.
[6] Westenbrink BD, Ruifrok WP, Voors AA,etal. Vascular endothelial growth factor is crucial for erythropoietin-induced improvement of cardiac function in heart failure[J]. Cardiovasc Res, 2010, 87:30- 39.
[7] 赵玉伟, 李法琦, 李万玉,等. 促红细胞生成素对急性心肌梗死大鼠心脏的保护作用及抗凋亡信号机制[J]. 中国老年学杂志, 2013, 2:849- 851.
[8] Marzo F, Lavorgna A, Coluzzi G,etal. Erythropoietin in heart and vessels: focus on transcription and signalling pathways[J]. J Thromb Thrombolysis, 2008, 26:183- 187.
[9] Todica A, Zacherl MJ, Wang H,etal.Invivomonitoring of erythropoietin treatment after myocardial infarction in mice with [68Ga]Annexin A5 and [18F]FDG PET[J]. J Nucl Cardiol, 2014, 21:1191- 1199.
[10] Liu X, Xie W, Liu P,etal. Mechanism of the cardioprotection of rh-EPO pretreatment on suppressing the inflammatory responsein ischemia-reperfusion[J].Life Sci, 2006, 78: 2255- 2264.
[11] 陈晓光, 张新金, 李建美,等. 重组人促红细胞生成素对心肌梗死后大鼠心功能及梗死面积的影响[J]. 昆明医科大学学报, 2013,8: 5- 12.
[12] Xue J, Du G, Shi J,etal. Combined treatment with erythropoietin and granulocyte colony-stimulating factor enhances neovascularization and improves cardiac function after myocardial infarction[J]. Chin Med J(Engl), 2014, 127:1677- 1683.
[13] 赵金红, 王伟, 张新金,等. 促红细胞生成素抑制Ang Ⅱ诱导的大鼠心肌细胞肥大及其可能的信号通路[J], 基础医学与临床, 2014, 3:295- 300.
Erythropoietin inhibits the proliferation of rat cardiac fibroblasts induced by TGF-β
WANG Li-ping1,2*, WANG Li-jun1,2, WANG Xiao-jun1,2
(1.Dept. of Physiology; 2.Tangshan Key Laboratory for Preclinical on Chronic Diseases,School of Basic Medicine, Hebei United University, Tangshan 063000, China)
Objective To explore the effect of erythropoietin on the proliferation of rat cardiac fibroblasts (CFs) induced by TGF-β. Methods Cultivated rats CFs were divided into three groups: control group, TGF-β group: the final concentration of TGF-β was 5 μg/L, recombinant human erythropoietin (rhEPO) treatment group: added TGF-β after incubation with 5 000 U/L rhEPO for one hour. After 24 hours, CFs proliferation was determined by MTT assay and cell counting; Immunocytochemistry and Western blot were conducted to observe α-SMA expression; The hydroxyproline concentration of CFs was assessed by hydroxyproline kit; CollagenⅠ,Ⅲ and MMP- 2,MMP- 9 synthesis of CFs were deteched by Western blot. Results Compared with control group, TGF-β promoted the CFs proliferation and transformation (P<0.05); TGF-β increased synthesis of collagenⅠ and collagen Ⅲ as well as MMP- 2 and MMP- 9 in CFs (P<0.05); After EPO intervention, CFs proliferation and transformation were decreased (P<0.05), collagenⅠand collagen Ⅲ synthesis were reduced (P<0.05), but the secretion of MMP- 2 and MMP- 9 increased (P<0.05). Conclusions Physiological dose EPO inhibits rat CFs proliferation, transformation and collagen production, in addition, EPO promote collagen degradation.
erythropoietin; myocardial fibrosis; cardiac fibroblasts
2014- 10- 20
2014- 12- 29
1001-6325(2015)06-0797-05
R542.2
A
*通信作者(corresponding author):mywlpzjm@163.com

