抗中性粒细胞胞浆抗体诱导FcγRⅡa升高与血管炎相关细胞因子的关系
何建业,魏丹丹,林旭红,白春洋
(开封市儿童医院 检验科, 河南 开封 475000)
研究论文
抗中性粒细胞胞浆抗体诱导FcγRⅡa升高与血管炎相关细胞因子的关系
何建业,魏丹丹,林旭红,白春洋*
(开封市儿童医院 检验科, 河南 开封 475000)
目的探讨抗中性粒细胞胞浆抗体是否通过影响中性粒细胞膜上FcγRⅡa的表达参与疾病进程。方法用不同浓度的抗中性粒细胞胞浆抗体相关血管炎活动期血清,分别是抗髓过氧化物酶抗体及抗蛋白酶3抗体阳性血清刺激健康人中性粒细胞,以健康人血清刺激中性粒细胞作为对照组,用流式细胞术分析血液中FcγRⅡa的荧光强度,Western blot分析FcγRⅡa的表达,鲁米诺化学发光方法检测中性粒细胞中氧自由基生成,用酶联免疫吸附试验检测血清细胞因子TNF-α、IL- 6的水平及血清中抗髓过氧化物酶抗体及抗蛋白酶3抗体水平。结果伴随血清浓度的降低,FcγRⅡa荧光强度、FcγRⅡa蛋白的表达、中性粒细胞中氧自由基及其分泌的细胞因子TNF-α、IL- 6水平下降(P<0.05)。结论抗髓过氧化物酶抗体及抗蛋白酶3抗体可能均通过FcγRⅡa影响氧自由基生成及细胞因子TNF-α、IL- 6的水平,进而导致血管炎的发生。
ANCA相关性血管炎;Fcγ受体Ⅱa;细胞因子
抗中性粒细胞胞浆抗体相关性血管炎(antineutrophil cytoplasmic antibody-associated vasculitides, ANCA-AAV)是一类发病率及病死率较高的自身免疫性疾病,其基本病理改变为坏死性小血管炎[1]。抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibody, ANCA)是AAV的重要致病因子,其主要通过激发中性粒细胞及单核细胞的炎性反应,进而导致细胞功能改变,并释放一些炎性分子,即引起小血管炎性坏死[2- 4]。研究表明,有两种ANCA参与AAV病理过程,与韦格纳肉芽肿(Wegener’s granulomatosis, WG)相关的抗蛋白酶3抗体(anti-proteinase 3 antibody, anti-PR3)和与显微镜下多血管炎(microscopic polyangiitis, MPA)相关的抗髓过氧化物酶抗体(anti-myeloperoxidase antibody, anti-MPO)[2,5]。而Fcγ受体家族是IgG结合而发挥激活细胞作用的主要受体,其中FcγRⅡa(CD32A)可能在介导细胞激活中发挥重要作用。本课题组已发现在AAV活动期中性粒细胞膜上FcγRⅡa的表达增强,ROS的生成水平显著升高,血清TNF-α、IL- 6及IL- 8的水平也明显升高[6]。因此,本工作拟探讨两种ANCA是否是通过影响中性粒细胞膜上FcγRⅡa的表达参与疾病进程。
1 材料与方法
1.1 材料
抗FcγRⅡa抗体和抗CD15抗体(Abcam公司)。Ficoll-Hypaque分离液由9%聚蔗糖液24份及33.9%泛影葡胺液10份混合而成,比重是1.077±0.001,Ficoll(上海研生实业有限公司),Hypaque(北京恒业中远化工有限公司)。细胞培养基RPMI- 1640(Gibco公司)。细胞氧化应激活性氧(ROS)鲁米诺化学发光法定量检测试剂盒(上海宝曼生物科技有限公司)。TNF-α及IL- 6 ELISA试剂盒(上海信帆生物科技有限公司)。anti-MPO ELISA试剂盒和anti-PR3 ELISA试剂盒(北京欧蒙生物技术有限公司)。
1.2 方法
1.2.1 血清刺激健康人中性粒细胞:收集2014年1月至2014年12月淮河医院AAV活动期患者及正常人血清:3例显微镜下多动脉炎(anti-MPO浓度分别是109.5、107.2和108.6 U/mL),3例韦格纳肉芽肿(anti-PR3浓度分别是84.1、83.5和84.6 U/mL),及3例来院体检的健康人血清。应用0.9%氯化钠溶液将AAV活动期患者血清稀释成1/2、1/4及1/8浓度,将原血清及稀释后的血清各取1 mL加入到2 mL中性粒细胞的培养液中,3例正常人血清作为对照,孵育12 h后,收集细胞。
Ficoll-Hypaque密度梯度及红细胞裂解法分离正常人中性粒细胞,采集2014年12月至淮河医院体检的5例正常人外周静脉血进行分离,此法可得95%以上的中性粒细胞。血清刺激时,用提取的5例正常人中性粒细胞重复此实验。患者已签署知情同意书, 并且该实验已经过伦理审查。
1.2.2 流式细胞术检测中性粒细胞膜上FcγRⅡa的荧光强度:取血清刺激后的中性粒细胞50 μL,与抗FcγRⅡa抗体孵育15 min,加入1 mL 1×PBS洗涤,1 200 r/min离心5 min,弃上清,留取细胞沉淀,加入500 μL 1×PBS缓冲液,用流式细胞分析仪(Beckman Coulter公司)检测FcγRⅡa荧光强度,用抗CD15抗体标记中性粒细胞。
1.2.3 Western blot方法检测中性粒细胞膜上FcγRⅡa的表达:收集血清刺激后的中性粒细胞,液氮快速冷冻,超声匀浆,离心取上清,4 ℃ 100 000×g离心1 h,将细胞蛋白沉淀悬浮于含有蛋白酶抑制剂的RIPA缓冲液中,然后Western blot方法检测FcγRⅡa运用BCA蛋白定量法对蛋白质浓度进行测定,然后SDS-PAGE电泳(80 V,30 min,110 V,1 h),电转(2 mA/cm2)1.5 h,5%牛奶(TBST配制)室温封闭30 min,与抗FcγRⅡa抗体杂交,4 ℃孵育过夜,PBST洗膜,加入酶标二抗,室温孵育30 min,PBST 洗膜,10 min×3次,DAB显色,扫描。
1.2.4 鲁米诺化学发光方法检测细胞ROS:血清刺激中性粒细胞后,4 ℃ 1 200 r/min离心5 min,弃上清,加入1 mL 1×PBS洗涤细胞两次,然后采用细胞氧化应激活性氧(ROS)鲁米诺化学发光法定量检测试剂盒检测,操作步骤按说明书进行。
1.2.5 细胞因子、MPO和PR3抗体水平的检测:血清刺激健康人中性粒细胞后,收集培养液,用ELISA方法检测TNF-α、IL- 6的水平。用ELISA方法检测AAV活动期患者血清MPO抗体及PR3抗体水平。操作步骤按说明书进行。试剂盒内各有标准品1支,按操作说明将标准品稀释,并检测其吸光度值(absorbance,A),以标准物的浓度为横坐标,A值为纵坐标,在坐标纸上绘出标准曲线,根据样品的A值由标准曲线查出相应的浓度。
1.3 统计学分析

2 结果
2.1 AAV患者基本信息
3例活动期MPA、3例活动期WG及3例健康人的性别、年龄、抗体的浓度(表1)。
2.2 ANCA血清刺激健康人中性粒细胞后FcγRⅡa的表达
中性粒细胞FcγRⅡa表达的强度随着ANCA血清浓度的降低而下降(图1)。中性粒细胞FcγRⅡa蛋白的表达,同样是随着ANCA血清浓度的下降而减弱(图2)。
2.3 ANCA血清刺激健康人中性粒细胞后ROS的生成水平及TNF-α、IL- 6的变化
ROS的生成水平随ANCA血清浓度的下降而降低(表2)。TNF-α的水平也随着ANCA血清浓度的下降而显著降低(表3)。而P-ANCA及C-ANCA阳性的血清相比较,对ROS、TNF-α及IL- 6的水平影响差异较小。

表1 AAV活动期患者基本信息
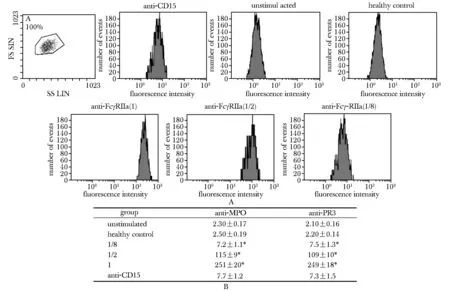
A.flow cytometric analysis of FcγRⅡa expression; B.fluorescence intensity of FcγRⅡa expression;*P< 0.05 compared with unstimulated and control group; anti-CD15 as marker of neutrophil
图1 流式细胞术分析不同浓度AAV患者血清(anti-MPO及anti-PR3阳性)刺激后FcγRⅡa的荧光强度
Fig 1 Detect the expression of FcγRⅡa in the neutrophil membrane using Flow cytometry
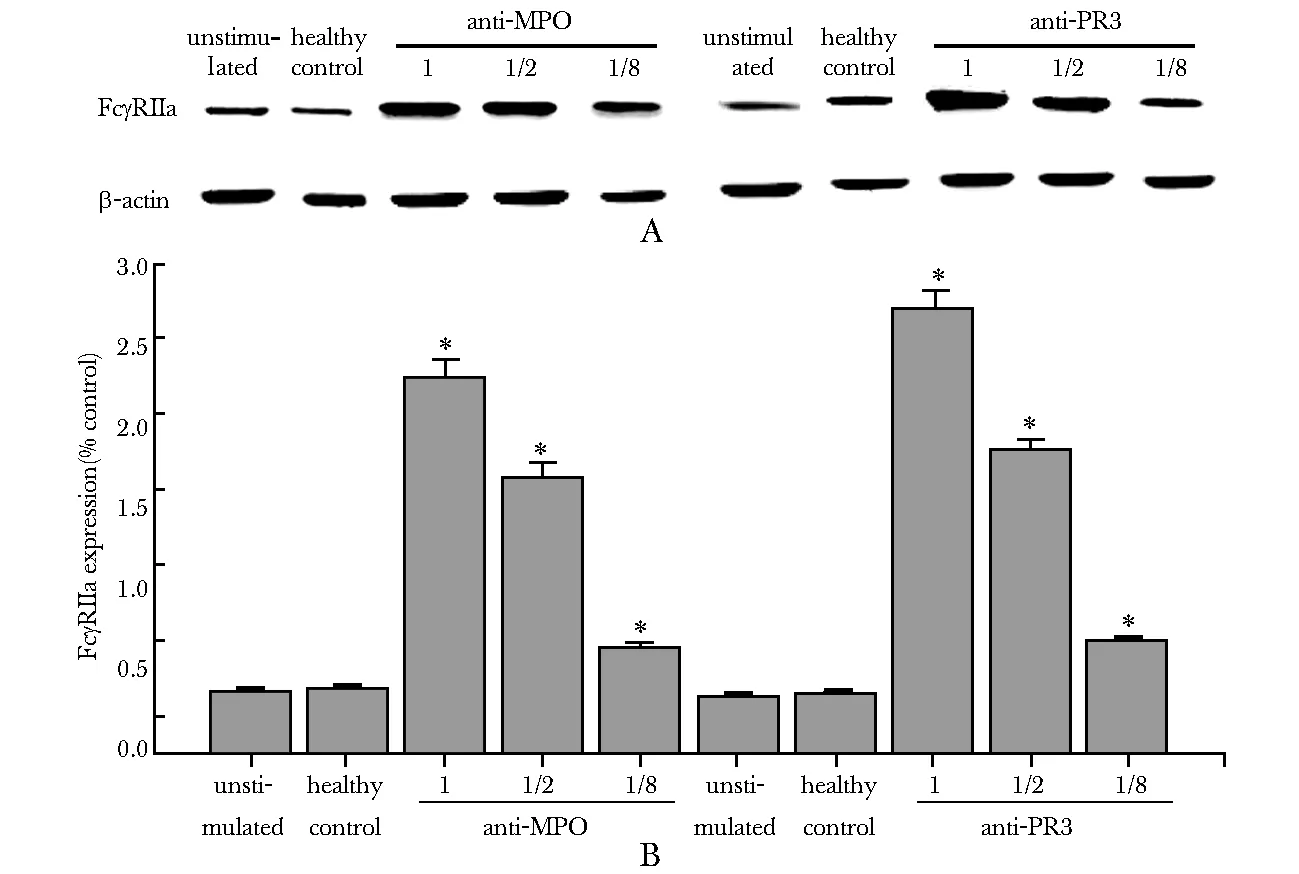
A.original results of Western blot; B.statistical figure of FcγRⅡa protein expression;*P<0.05 compared with unstimulated and control group
图2 Western blot方法检测中性粒细胞上FcγRⅡa的表达
Fig 2 FcγRⅡa protein expression detected by Western blot
表2 鲁米诺化学发光方法检测不同浓度活动性AAV血清(anti-MPO及anti-PR3阳性)刺激后中性粒细胞中ROS的变化
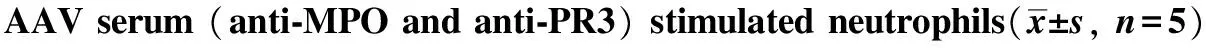

groupanti⁃MPOanti⁃PR3unstimulated213±016162±014healthycontrol226±018183±0151/81120±225∗1050±209∗1/42470±312∗2310±347∗1/25780±596∗5690±608∗19860±841∗9530±917∗
*P<0.05 compared with unstimulated and control group.
表3 ELISA方法检测不同浓度活动期AAV血清(anti-MPO及anti-PR3阳性)刺激中性粒细胞后细胞因子TNF-α、IL- 6水平
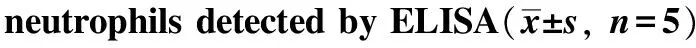

groupTNF⁃α/(μg/L)IL⁃6/(ng/L)anti⁃MPOanti⁃PR3anti⁃MPOanti⁃PR3unstimulated 039±021 035±023 3160±296 2850±279healthycontrol 042±025 046±019 3320±301 3040±2561/8 460±039∗ 430±035∗ 5080±471∗ 4910±486∗1/4 910±063∗ 870±058∗ 9950±1120∗ 9060±1050∗1/2 1560±270∗ 1420±210∗ 17690±1830∗ 16540±1230∗1 2470±320∗ 2390±370∗ 29730±1560∗ 28920±1780∗
*P<0.05 compared with unstimulated and control group.
3 讨论
本研究应用不同浓度的活动期AAV血清(包括MPO-ANCA阳性及PR3-ANCA阳性)刺激健康人中性粒细胞,发现中性粒细胞膜上FcγRⅡa的表达强度随着刺激血清浓度的下降而降低,FcγRⅡa的蛋白水平也下降,ROS、TNF-α及IL- 6的水平也随着浓度的下降而减少,与FcγRⅡa的下降一致。已有研究表明,PR3-ANCA及MPO-ANCA的Fc段与FcγRⅡa结合,能激发中性粒细胞,导致炎性反应,用单克隆抗体Fab阻断FcγRⅡa与ANCA的结合能显著削弱ANCA引起的炎性反应[7- 10]。FcγRⅡa 对ANCA-IgG3具有较强的亲和性,通过二者的结合能体外诱导中性粒细胞黏附[11- 12]。人鼠嵌合的PR3-ANCA亚型IgG4与FcγRⅡa结合,体外诱发中性粒细胞的炎性反应,导致细胞过氧化物酶生成、细胞因子释放、脱颗粒及黏附能力增强,用抗FcγRⅡa 抗体(Ⅳ.3)体外阻断IgG4与FcγRⅡa的结合,引起过氧化物酶生成减少、脱颗粒减弱及IL- 8释放减低[13]。本研究进一步佐证ANCA可能通过影响中性粒细胞膜上FcγRⅡa的表达,进而影响ROS生成及细胞因子TNF-α及IL- 6的水平,导致AAV处于活动期。但是该研究仅在体外水平验证ANCA可能通过影响FcγRⅡa参与活动期AAV的发病过程,仍需要在体内水平通过动物实验进一步研究ANCA在活动期AAV中的作用。
[1] Silva F, Cisternas M. anti-neutrophil cytoplasmic antibody (ANCA)-associated vasculitis: advances in pathogenesis and treatment[J]. Rev Med Chil, 2013, 141:765- 773.
[2] Radice A, Bianchi L, Sinico RA. anti-neutrophil cytoplasmic autoantibodies: methodological aspects and clinical significance in systemic vasculitis[J]. Autoimmun Rev, 2013, 12:487- 495.
[3] Jennette JC, Falk RJ, Gasim AH. Pathogenesis of antineutrophil cytoplasmic autoantibody vasculitis[J]. Curr Opin Nephrol Hypertens, 2011, 20:263- 270.
[4] Kallenberg CG. Pathogenesis of ANCA-associated vasculitides[J]. Ann Rheum Dis, 2011, 70:59- 63.
[5] Millet A, Pederzoli-Ribeil M, Guillevin L,etal. Antineutrophil cytoplasmic antibody-associated vasculitides: is it time to split up the group?[J]. Ann Rheum Dis,2013, 72:1273- 1279.
[6]魏丹丹,林旭红,白春洋. FcγRⅡa及相关炎症分子在ANCA相关性血管炎中的意义[J]. 现代预防医学,2014,41:4184- 4186.
[7] Kettritz R, Jennette JC, Falk RJ. Crosslinking of ANCA-antigens stimulates superoxide release by human neutrophils[J]. J Am Soc Nephrol,1997,8:386- 394.
[8] Porges AJ, Redecha PB, Kimberly WT,etal. anti-neutrophil cytoplasmic antibodies engage and activate human neutrophils via Fc gamma RⅡa[J]. J Immunol, 1994,153:1271- 1280.
[9] Mulder AH, Heeringa P, Brouwer E,etal. Activation of granulocytes by anti-neutrophil cytoplasmic antibodies (ANCA): a Fc gamma RⅡ-dependent process[J]. Clin Exp Immunol, 1994, 98:270- 278.
[10] Reumaux D, Vossebeld PJ, Roos D,etal. Effect of tumor necrosis factor-induced integrin activation on Fc gamma receptor Ⅱ-mediated signal transduction: relevance for activation of neutrophils by anti-proteinase 3 or anti-myeloperoxidase antibodies[J]. Blood,1995,86:3189- 3195.
[11] Pankhurst T, Nash G,Williams J,etal. Immunoglobulin subclass determines ability of immunoglobulin (Ig)G to capture and activate neutrophils presented as normal human IgG or disease-associated anti-neutrophil cytoplasm antibody (ANCA)-IgG[J]. Clin Exp Immunol, 2011, 164:218- 226.
[12] Jayne DR, Weetman AP, Lockwood CM. IgG subclass distribution of autoantibodies to neutrophil cytoplasmic antigens in systemic vasculitis[J]. Clin Exp Immunol, 1991, 84:476- 481.
[13] Hussain A, Pankhurst T, Goodall M,etal. Chimeric IgG4 PR3-ANCA induces selective inflammatory responses from neutrophils through engagement of Fcgamma receptors[J]. Immunology, 2009,128:236- 244.
Relationship of FcγRⅡa expression induced by antineutrophil cytoplasmic antibody with cytokines
HE Jian-ye, WEI Dan-dan, LIN Xu-hong, BAI Chun-yang*
(Dept. of Clinical Laboratory, Children’s Hospital, Kaifeng 475000, China)
Objective To investigate antineutrophil cytoplasmic antibody resulting in antineutrophil cytoplasmic antibody-associated vasculitides contributed by the expression of FcγRⅡa in the cell membrane. Methods Human neutrophils were stimulated by different serum concentrations(anti-myeloperoxidase antibody positive and anti-proteinase 3 positive), healthy human serum as control. Flow cytometry was used to detect the expression of FcγRⅡa on the neutrophil membrane. FcγRⅡa was analyzed by Western blots. Reactive oxygen species(ROS) production was measured by chemiluminescence technique in the presence of 10 mmol/L luminol. ELISA was applied to detect the level of serum cytokines TNF-α, IL- 6, anti-myeloperoxidase antibody and anti-proteinase 3. Results With the decrease of serum concentration, fluorescence intensity of FcγRⅡa expression, expression of FcγRⅡa, ROS generation and secretion of cytokines TNF-α and IL- 6 reduced(P<0.05). Conclusions Anti-myeloperoxidase antibody and anti-proteinase 3 antibody play a role in mediating ROS, TNF-α and IL- 6 levels through FcγRⅡa, and thus induce the generation of antineutrophil cytoplasmic antibody associated vasculitis.
antineutrophil cytoplasmic antibody associated vasculitis; Fc gamma receptor IIa; cytokines
2015- 06- 01
2015- 10- 10
1001-6325(2015)12-1640-05
R392.32
A
*通信作者(corresponding author):13937855282@126.com

