双氢睾酮调节原代培养大鼠Sertoli细胞GDNF的表达
常 青,王丽梅,黑常春,蔡玉芳,吴 凯,孔 斌,朱万平,沈新生,赵承军*
(宁夏医科大学 基础医学院 1.人体解剖与组织胚胎学系; 2.生育力保持教育部重点实验室;3.宁夏生殖与遗传重点实验室,宁夏 银川 750004)
研究论文
双氢睾酮调节原代培养大鼠Sertoli细胞GDNF的表达
常 青1,2,3,王丽梅1,黑常春1,2,3,蔡玉芳1,2,3,吴 凯1,孔 斌1,朱万平1,沈新生1,赵承军1*
(宁夏医科大学 基础医学院 1.人体解剖与组织胚胎学系; 2.生育力保持教育部重点实验室;3.宁夏生殖与遗传重点实验室,宁夏 银川 750004)
目的观察双氢睾酮对原代培养大鼠Sertoli细胞GDNF及相关细胞信号通路关键蛋白的表达,探讨Sertoli细胞GDNF表达调控的机制。方法原代培养出生后20 d大鼠Sertoli细胞,给予双氢睾酮干预,免疫荧光检测GDNF在细胞中定位和表达强度,Western blot检测GDNF,ERK和CREB蛋白的表达及磷酸化情况,并用ERK和cAMP/PKA信号通路抑制剂干预。结果GDNF表达在Sertoli细胞质中,双氢睾酮干预可增加GDNF的表达(P<0.05),并使ERK和CREB磷酸化水平增高(P<0.05),使用ERK和cAMP/PKA信号通路抑制剂可减低双氢睾酮诱导的GDNF表达(P<0.05)。结论双氢睾酮通过激活ERK信号通路诱导Sertoli细胞GDNF的表达。
双氢睾酮;Sertoli细胞;GDNF;ERK;信号通路
在精子发生的有丝分裂阶段,精原干细胞存在不平衡分裂,一方面通过自我更新形成干细胞储备,一方面分化成为精原细胞。精原干细胞的自我更新是精子发生的持续进行的保证。现已发现数个调节精原干细胞(spermatogonial stem cells,SSCs)自我更新和分化的因子,如胶质细胞源性神经营养因子(glial cell derived neurotrophic factor,GDNF),干细胞因子(stem cell factor,SCF),成纤维细胞生长因子(fibroblast growth factor,FGF)等[1]。其中GDNF由睾丸支持细胞(Sertoli细胞)合成,作用于SSCs表面的受体,促进SSCs的自我更新,维持SSCs数量[2, 3]。已发现与精子发生密切相关的卵泡刺激素(follicle stimulating hormone,FSH)作用于Sertoli细胞可促进GDNF的表达,参与调解SSCs的自我更新[4- 6]。已知雄激素是精子发生所必须的调节分子,尚不明确雄激素对Sertoli细胞GDNF表达具有何种作用。本研究以原代培养的Sertoli细胞为材料,研究对雄激素对Sertoli 细胞GDNF表达的影响,及相关的细胞通路变化,深入理解SSCs自我增殖的调控因素。
1 材料与方法
1.1 实验动物和主要试剂
20d SD雄鼠20只[宁夏医科大学实验动物中心,合格证号SCXK (宁) 20110001,SPF级],体质量50~60 g。DMEM/F12(Hyclone公司);胎牛血清(Corning公司);胰蛋白酶,胶原蛋白酶,透明质酸酶和核酸酶,双氢睾酮(Dihydrotestosterone,DHT)(Sigma公司);GDNF抗体(Santa cruz公司);荧光二抗(碧云天公司);U0126和H- 89(Cell Signaling公司)。其他试剂均为分析纯试剂。
1.2 方法
1.2.1 Sertoli细胞的分离和原代培养:脱颈处死动物后取出睾丸并剥除白膜,剪成1 mm×1 mm×1 mm小块,用一步0.1%胰蛋白酶和两步不同浓度(0.05%和0.1%)的胶原蛋白酶消化去除睾丸间质细胞和管周肌样细胞,用0.1%透明质酸酶除去胞间透明质酸。调整细胞为2×106个/mL进行培养,培养液为DMEM/F12,添加青、链霉素,10%胎牛血清,条件为35 ℃、5% CO2。培养48 h后用20 mmol/L、pH为7.4的Tris-HCI低渗处理2.5 min去除生精细胞,培养48 h后进行后续试验。
1.2.2 免疫荧光检测双氢睾酮对GDNF表达的影响:原代培养的Sertoli细胞按1×106个/mL行细胞爬片。使用10-7mol/L浓度的双氢睾酮干预Sertoli细胞,干预时间分别为0、15和30 min及1、2和 4 h。GDNF抗体(1∶100稀释)室温下孵育2 h,FITC标记的第二抗体室温下孵育1 h,DAPI标记细胞核,阴性对照使用PBS代替GDNF抗体。荧光显微镜下观察拍照,观察GDNF的表达。
1.2.3 双氢睾酮对Sertoli细胞GDNF表达的影响:Sertoli细胞培养48 h后,使用0、10-9、10-8、10-7、10-6和10-5mol/L的双氢睾酮干预细胞,培养2 h后收集各组细胞,Western blot检测GDNF蛋白的表达。选取适宜浓度的双氢睾酮干预Sertoli细胞,分别在干预后的第0、15和30 min及1、2和4 h收集细胞,Western blot检测检测GDNF蛋白。
1.2.4 双氢睾酮对ERK1/2和CREB磷酸化的影响: 用10-7mol/L的双氢睾酮干预Sertoli细胞,分别在干预后的0、15和30 min及1、2和4 h收集细胞,用Western blot检测ERK1/2和CREB的磷酸化情况。
1.2.5 U0126和H- 89对双氢睾酮诱导GDNF蛋白表达的影响:支持细胞培养48 h后分别加入U0126(10 μmol/L)和H- 89(20 μmol/L),孵育时间分别为2 h和30 min,对照组用等体积二甲基亚砜(dimethyl sulphoxide,DMSO)代替,然后加入双氢睾酮(10-7mol/L)刺激2 h后收集细胞,Western blot检测GDNF蛋白的表达。
1.3 统计学分析
2 结果
2.1 免疫荧光检测DHT对GDNF表达的影响
GDNF表达于Sertoli细胞的细胞质中,较为均匀地分布在细胞核周围和细胞突起中。在10-7mol/L 双氢睾酮干预作用30 min后,与对照组比较,GDNF的表达明显增加(图1)。
2.2 双氢睾酮作用时间和浓度对GDNF表达的影响
随双氢睾酮浓度的增加,GDNF表达逐步增加。在双氢睾酮浓度为10-7mol/L时,GDNF表达水平最高。当双氢睾酮浓度大于在10-7mol/L时,GDNF的表达下降(图2A)。使用10-7mol/L 双氢睾酮作用于Sertoli细胞,随作用时间的延长,GDNF的表达逐步升高,在2 h表达量最高(图2B)。
2.3 双氢睾酮对ERK1/2和CREB活性的影响
用10-7mol/L 双氢睾酮干预15 min时,可检测到磷酸化ERK1/2水平增高,随干预时间增加,磷酸化水平也增加,在1 h时磷酸化水平最高,随后降低(图3A);同样双氢睾酮也以时间依赖方式增加CREB的磷酸化,在30 min时磷酸化水平最高(图3B)。
2.4 U0126和H- 89对双氢睾酮诱导GDNF蛋白表达的影响
用ERK1/2信号通路抑制剂U0126和PKA信号通路抑制剂H- 89干预后,双氢睾酮所诱导的GDNF的表达明显减少(图4)。
3 讨论
胶质细胞源性神经营养因子(glial cell derived neurotrophic factor,GDNF)是从大鼠胶质细胞瘤细胞系B49的条件培养液中分离纯化得到的一种新型细胞营养因子,属转化生长因子β家族中的一员[7]。在睾丸中,GDNF由睾丸支持细胞合成和分泌,其作为精原干细胞微环境因子之一,参与维持精原干细胞的自我增殖,从而保证精子发生的持续进行[8]。
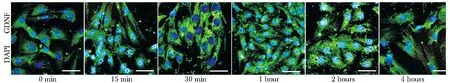
compared with 0 min, the fluorescence intensity of GDNF increased at 30 min, 1 hour, 2 hours and 4 hours; green is GDNF and blue is DAPI(Bar=50 μm)
图1 DHT诱导Sertoli细胞GDNF表达免疫荧光染色
Fig 1 The pictures of immunofluorescence of GDNF expression induced of DHT
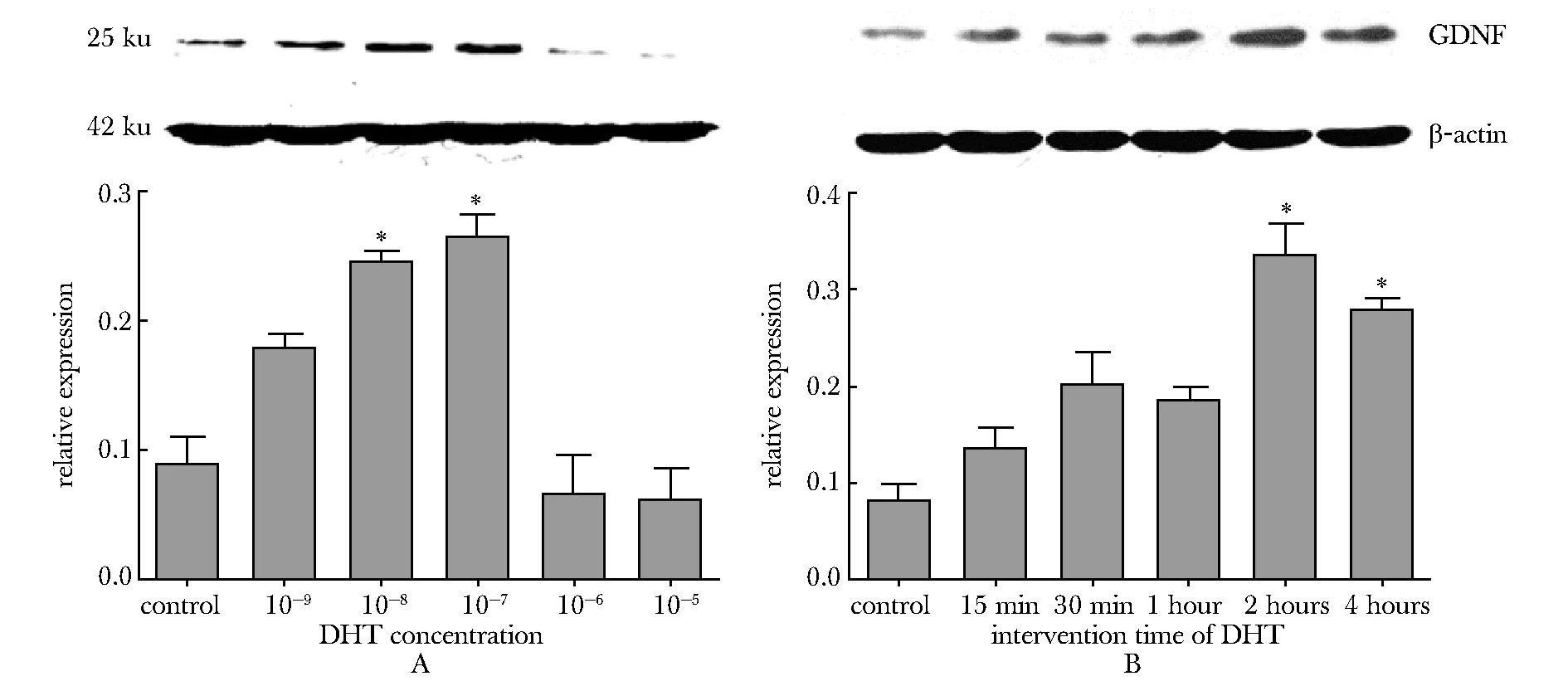
A.the expressions of GDNF are higher than that of control when the concentrations of DHT are 10-8and 10-7mol/L; under the concentration of 10-7mol/L DHT, the expression of GDNF is highest; B.when concentration is 10-7mol/L and the time of acion of DHT are 2 hours and 4 hours, the expressions of GDNF are higher than that of control; the expression of GDNF is highest when the time of action of DHT is 2 hours;*P<0.05 compared with control
图2 DHT浓度和作用时间对Sertoli细胞GDNF表达的影响
Fig 2 The effects of concentration and intervention time of DHT on the expression of GDNF in Sertoli cell

A.the expression of ERK1/2 are not changed by DHT incubating, but the expression of p-ERK1/2 is obviously increased at 1h DHT incubating; B.the expression of CREB are not changed by DHT incubating, but the expression of p-CREB is obviously increased at 30min and 1 hours DHT incubating;*P<0.05 compared with control
图3 DHT对磷酸化ERK1/2和CREB表达的影响
Fig 3 The effects of DHT on the expressions of p-ERK1/2 and p-CREB

In DHT+U0126 and DHT+H- 89 groups, the expressions of GDNF are obviously decreased; *P<0.05 compared with DHT图4 信号通路抑制剂U0126和H- 89对DHT诱导的GDNF表达的影响Fig 4 The effect of signal pathway inhibitor U0126and H- 89 on the expression of GDNF induced by DHT
Sertoli细胞合成GDNF受多种与精子发生相关的分子调控,包括FSH,成纤维细胞生长因子- 2(fibroblast growth factor,FGF- 2),肿瘤坏死因子α(tumor necrosis factor α,TNFα),白细胞介素1β(interleukin, IL- 1β)等[9]。雄激素是另一个调节精子发生的重要分子。已有研究发现,睾酮可刺激睾丸管周肌样细胞GDNF mRNA 和蛋白水平的增加[10]。但是睾酮对Sertoli细胞GDNF的表达是否具有影响,还未进行深入的研究。本研究发现,双氢睾酮刺激可增加原代培养的20 d大鼠Sertoli细胞GDNF表达。这一结果说明,雄激素可通过上调Sertoli细胞GDNF的表达,刺激SSCs的自我更新,保证精子发生的持续进行。
雄激素通过经典和非经典两条途径作用于靶细胞。经典途径指雄激素结合于胞内雄激素受体(AR),形成了激素-受体复合物,入细胞核激活相关基因转录。非经典途径指雄激素可以激活MAPK和钙信号通路,激活相关基因的表达[11- 12]。本研究结果显示,双氢睾酮干预可增加ERK1/2和CREB的磷酸化水平,在使用ERK1/2抑制剂U0126处理Sertoli细胞后,GDNF的表达明显减少。这一结果说明,双氢睾酮可通过ERK通路诱导GDNF蛋白的表达。在使用PKA信号通路抑制剂H- 89时,也会使GDNF的表达水平降低,说明PKA信号通路也是调节GDNF表达的信号通路之一。由于ERK和PKA信号通路之间存在交互作用,并且最终都引起CREB的磷酸化,因此尚不能排除睾酮具有激活PKA信号通路的可能,需要进一步研究。
睾酮或雄激素能够刺激Sertoli细胞表达GDNF,促进SSCs的自我增殖,对于临床雄性生育力损伤的治疗具有一定意义。有研究显示,使用睾酮可以有效启动LH受体基因敲除小鼠的精子发生[13],可以恢复白消安损伤大鼠睾丸的精子发生[14],并使人类先天性睾丸发育不良综合征(Klinefelter’s syndrome)患者的精子发生得以恢复[15]。这些结果提示,睾酮可能从促进SSCs自我增殖开始,对精子发生的全过程发挥调控作用。
总之,本研究发现,对于体外培养的Sertoli细胞,双氢睾酮通过激活ERK信号通路,上调Sertoli细胞GDNF的表达,促进精原干细胞的自我增殖,维系精子发生。
[1] De Rooij DG. The spermatogonial stem cell niche[J]. Microsc Res Tech, 2009, 72:580- 585.
[2] Meng X, Lindahl M, Hyvonen ME,etal. Regulation of cell fate decision of undifferentiated spermatogonia by GDNF[J]. Science, 2000, 287:1489- 1493.
[3] Kostereva N,Hofmann MC. Regulation of the spermatogonial stem cell niche[J]. Reprod Domest Anim, 2008, 43 Suppl 2:386- 392.
[4] Makela JA, Toppari J, Rivero-Muller A,etal. Reconstruction of mouse testicular cellular microenvironments in long-term seminiferous tubule culture[J]. PLoS One, 2014, 9:e90088, doi: 10.1371/journal.pone.0090088.
[5] Ding LJ, Yan GJ, Ge QY,etal. FSH acts on the proliferation of type A spermatogonia via Nur77 that increases GDNF expression in the Sertoli cells[J]. FEBS Lett, 2011, 585:2437- 2444.
[6] 刘欢欢, 陈曦, 余树民, 等. 以GDNF为核心的哺乳动物精原干细胞调控网络[J]. 基础医学与临床, 2015, 35:409- 412.
[7] Spinnler K, Kohn FM, Schwarzer U,etal. Glial cell line-derived neurotrophic factor is constitutively produced by human testicular peritubular cells and may contribute to the spermatogonial stem cell niche in man[J]. Hum Reprod, 2010, 25:2181- 2187.
[8] Goharbakhsh L, Mohazzab A, Salehkhou S,etal. Isolation and culture of human spermatogonial stem cells derived from testis biopsy[J]. Avicenna J Med Biotechnol, 2013, 5:54- 61.
[9] Rossi P,Dolci S. Paracrine mechanisms involved in the control of early stages of Mammalian spermatogenesis[J]. Front Endocrinol (Lausanne), 2013, 4:1- 8.
[10] Chen LY, Brown PR, Willis WB,etal. Peritubular myoid cells participate in male mouse spermatogonial stem cell maintenance[J]. Endocrinology, 2014, 155:4964- 4974.
[11] Shupe J, Cheng J, Puri P,etal. Regulation of Sertoli-germ cell adhesion and sperm release by FSH and nonclassical testosterone signaling[J]. Mol Endocrinol, 2011, 25:238- 252.
[12] Loss ES, Jacobus AP,Wassermann GF. Diverse FSH and testosterone signaling pathways in the Sertoli cell[J]. Horm Metab Res, 2007, 39:806- 812.
[13] Pakarainen T, Zhang FP, Mäkelä S,etal. Testosterone replacement therapy induces spermatogenesis and partially restores fertility in luteinizing hormone receptor knockout mice[J]. Endocrinology, 2005, 146:596- 606.
[14] Udagawa K, Ogawa T, Watanabe T,etal. Testosterone administration promotes regeneration of chemically impaired spermatogenesis in rats[J]. Int J Urol, 2006, 13:1103- 1108.
[15] Mehta A, Bolyakov A, Roosma J,etal. Successful testicular sperm retrieval in adolescents with Klinefelter syndrome treated with at least 1 year of topical testosterone and aromatase inhibitor[J]. Fertil Steril, 2013, 100:970- 974.
Dihydrotestosterone regulates GDNFexpression in primary cultured rat Sertoli cells
CHANG Qing1,2,3,WANG Li-mei1, HEI Chang-chun1,2,3, CAI Yu-fang1,2,3, WU Kai1,KONG Bin1, ZHU Wan-ping1, SHEN Xin-sheng1, ZHAO Cheng-jun1*
(1.Dept. of Anatomy, Histology and Embryology; 2.Key Laboratory of Fertility Preservation and Maintenance ofMinistry of Education; 3.Key Laboratory of Reproduction and Genetics in Ningxia School of Basic Medicine,Ningxia Medical University, Yinchuan 750004, China)
Objective To study the effects of dihydrotestosterone (DHT) on the expression of GDNF and the changes of signaling pathway in primary cultured rat Sertoli cells. Methods The primary cultured 20 days old sertoli cells stimulateused by DHT, immumofluorescence was used to detect the localization and expression of GDNF in Sertoli cell, Western blot was used to detect the expressions of GDNF, ERK1/2 and CREB, and the phosphorylations of ERK1/2 and CREB. while the inhibitors of ERK and cAMP/PKA signaling pathway were examined. Results GDNF expressed in cytoplasm of Sertoli cell. DHT promoted the expression of GDNF, while the level of ERK1/2 and CREB phosphorylation were increased. U0126 and H89 decreased the DHT-induced GDNF expression. Conclusions DHT stimulated the expression of GDNF of Setoli cell by activing the ERK signaling pathway.
dihydrotestosterone; Sertoli cell; GDNF; ERK; signaling pathway
2015- 03- 23
2015- 08- 16
国家自然科学基金(81160084);宁夏医科大学博士学位建设开放课题(KF2010- 15)
1001-6325(2015)11-1481-05
Q952.6
A
*通信作者(corresponding author):yczcj@126.com

