肌肽减轻H2O2诱导的N2a细胞损伤
魏建峰
(徐州医学院基础医学院 组织胚胎学教研室,徐州 221004)
研究论文
肌肽减轻H2O2诱导的N2a细胞损伤
魏建峰*
(徐州医学院基础医学院 组织胚胎学教研室,徐州 221004)
目的探究肌肽对H2O2诱导的N2a细胞损伤的保护作用及其机制。方法将N2a细胞分为对照组、损伤组(给予H2O2)和肌肽保护组(预先加入肌肽)。用相差显微镜观察了细胞形态,用免疫荧光染色和免疫印迹实验检测细胞AKT1和FAS-L的蛋白表达。结果肌肽显著增加了N2a细胞增殖能力(P<0.05);与对照组比较,H2O2损伤组细胞形态发生明显改变,细胞皱缩,胞膜变厚并出现发泡现象;而肌肽保护组细胞形态较损伤组明显改善;免疫荧光染色和免疫印迹实验显示,损伤组AKT1的表达显著低于对照组,FAS-L的表达显著高于对照组。 而肌肽保护组AKT1的表达显著高于对照组,FAS-L的表达显著低于对照组(P<0.05)。结论肌肽能够减轻N2a细胞对H2O2诱导的细胞损伤。
N2a细胞; 肌肽; 氧化应激损伤;AKT1;FAS-L
随着对自由基研究的不断深入,氧化应激损伤和抗氧化保护作用理论越加受到关注,如Alzheimer’s病和衰老等均被公认是与氧化应激损伤及自由基代谢异常有关[1]。肌肽是一种存在于动物体内的具有抗衰老功能的肽类物质[2],它参与机体清除自由基和膜脂质过氧化反应[3- 4], 能抑制在神经退行性紊乱和心血管缺血性损害中由醛诱导的蛋白质与蛋白质,DNA与DNA的交联[5]。肌肽作为自然存在于机体内的抗氧化物质,它能够抑制细胞膜的过氧化过程,清除自由基,减轻有害物质对DNA和蛋白质等的损害。
小鼠神经瘤母细胞(N2a细胞)在形态及结构功能上与神经元极其相似, 具有典型的神经内分泌细胞特性,因此在国内外广为用作研究神经细胞的模型。本研究以H2O2损伤的N2a细胞为氧化应激模型, 探究肌肽对N2a细胞的保护作用, 为深入研究肌肽的抗氧化、神经保护作用及其机制提供生物学依据。
1 材料与方法
1.1 材料与试剂
N2a细胞(华中科技大学同济医学院姜玉峰博士赠予),多聚甲醛(Fluka公司),鼠抗AKT1单克隆抗体(Santa Cruz公司),兔抗FAS-L单克隆抗体、FITC-标记的山羊抗小鼠IgG和IIRP-标记的羊抗兔IgG(北京中杉金桥生物技术有限公司),β-actin单克隆抗体(Sigma公司),ECL显色液(Perbio公司),DMEM、OPTI-MEM和胎牛血清(Gibco公司),其他化学试剂均为国产分析纯。
1.2 实验方法
1.2.1 细胞培养及分组处理:细胞培养基为50% DMEM、50% OPTI-MEM、含5%热灭活FBS。细胞于5% CO2、37 ℃培养箱内进行培养。细胞增殖至70%~80%汇合时传代或用于实验。将增殖旺盛细胞重新悬浮铺板,H2O2损伤组加入终浓度为0.68 mg/L H2O2;肌肽保护组制备同损伤组,提前1 h加入肌肽,终浓度0.45×103mg/L。在加入细胞前在多孔板中放入预先消毒的载玻片,用以制作细胞爬片。
1.2.2 细胞计数:细胞接种12~24 h后加入肌肽,终浓度为0.45×103mg/L,对照组加入稀释肌肽工作液。在加入肌肽后分别于12、24、36、48、60和72 h对细胞进行计数统计。
1.2.3 免疫荧光染色观察AKT1和FAS-L表达:细胞爬片经0.01 mol/L PBS清洗2~3次; 2% TritonX-100 15 min ;300 mg/L H2O220 min; 4%牛血清白蛋白37 ℃封闭30 min;鼠抗AKT1单克隆抗体/兔抗FAS-L单克隆抗体1∶200 4 ℃ 18 h,室温6 h; 0.01 mol/L PBS清洗2~3次;FITC-标记的山羊抗小鼠IgG或IIRP-标记的羊抗兔IgG 1∶300, 室温避光孵育2 h; 0.01 mol/L PBS清洗3次,每次15 min。甘油封片,荧光显微镜下观察、摄片,用image J软件对荧光图片进行半定量分析。
1.2.4 Western-blot检测AKT1和FAS-L表达:细胞蛋白提取:弃培养液,用冷PBS洗细胞2次;置冰上;加4 ℃细胞裂解液,置冰上10~30 min;收集上清并转入离心管,微波振荡;4 ℃,20 000×g离心10 min;取上清-20 ℃保存待用。
蛋白印迹:取细胞总蛋白经10%SDS-聚丙烯酰胺凝胶电泳后,蛋白恒压转入硝酸纤维膜上;5%牛奶封闭45 min,4% BSA封闭5 min;鼠抗AKT1单克隆抗体,1∶800/兔抗FAS-L单克隆抗体,1∶500,4 ℃,18 h;0.02 mol/L TBS(pH 7.4,含1% Tween- 20)洗膜3次,每次10 min;HRP标记的羊抗小鼠IgG/羊抗兔IgG,1∶3 000,室温孵育2 h;同上洗膜3次;ECL显色曝光后冲洗胶片。β-actin为内参照。
1.3 统计分析

2 结果
2.1 肌肽对N2a细胞增殖的影响2.1.1 肌肽加入后的细胞数量在不同检测时间点均高于对照组:前期细胞增殖能力检测发现在加入20 mmol/L浓度肌肽处增殖曲线出现了明显的峰值,从而确定了肌肽的最佳加药浓度。在检测的各个不同时间点,加入20 mmol/L肌肽组的细胞数量均明显高于对照组(P<0.05)(图1)。
2.1.2 各组细胞的形态变化:H2O2损伤组与对照组相比较,细胞形态发生明显改变:细胞皱缩变圆,变小,细胞膜变厚,出现发泡现象,且细胞反光度差;而在肌肽保护组,细胞形态较损伤组明显改善,发泡现象明显减少,细胞反光度也较好(图2)。
2.2 免疫荧光细胞染色
H2O2损伤组AKT1免疫反应的绿色荧光强度显著低于对照组,FAS-L的红色荧光强度显著高于对照组;而肌肽保护组AKT1免疫反应的绿色荧光强度显著高于H2O2损伤组,FAS-L的红色荧光强度显著低于H2O2损伤组(P<0.05)(图3,4)。

*P<0.05 compared with control group图1 肌肽加入后细胞数量随时间变化曲线Fig 1 The number of cells change over time afteradding carnosine
2.3 Western blot
H2O2损伤组中AKT1的蛋白表达较与对照组明显减少,FAS-L的蛋白表达较与对照组明显增加;而肌肽保护组中AKT1的蛋白表达较与对照组明显增加,FAS-L的蛋白表达较与对照组明显减少(P<0.05)(图5)。
3 讨论
肌肽和其相关化合物是继SOD, CAT, VE后体内又一新的活跃自由基的清除剂。肌肽和相关多肽是肌肉和神经组织的正常组份[6],但是它们的生理功能仍然不是十分明确。据报道肌肽和相关多肽的抗氧化机制是抑制活性氧(ROS),清除自由基和螯合金属前氧化物[7]。肌肽和其相关化合物的生物活性,使这些多肽的潜在医学用途倍受人们关注,例如在胃溃疡,关节炎,脑卒中和活性氧引起的一些疾病中的可能治疗作用[8]。
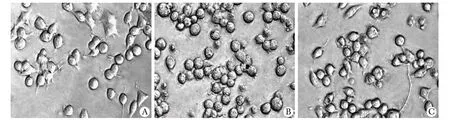
A. normal; B. H2O2; C. carnosine+H2O2图2 各组细胞的形态变化Fig 2 Morphology of N2a cells in each group(×400)

图3 AKT1和FAS-L的免疫细胞化学染色Fig 3 The expression of AKT1 and FAS-L shown by immunofluorescence(×200)

*P<0.05 compared with control group;#P<0.05, compared with H2O2 group图4 AKT1和FAS-L的免疫荧光吸光度半定量分析Fig 4 Immunofluorescence semi-quantitative analysisof the expression of AKT1 and FAS-L
AKT1和FAS-L是国际惯用评价细胞存活,生长状态与损伤凋亡常用的检测指标。活化的AKT通过磷酸化作用激活或抑制其下游靶蛋白, 进而调节细胞的增殖、分化、凋亡以及迁移等[9]。FAS受体与FAS配体(FAS-L)的交联与信号传导在诱发细胞凋亡、维持机体自身稳定和保持内环境稳态方面起着重要作用[10]。
H2O2是体内氧化代谢的中间产物,是一种危害性很大的氧自由基,可以穿透细胞膜到达细胞内,当积累到一定程度时就会造成细胞的损伤[11]。预先加入肌肽的保护组,AKT1的表达较损伤组明显增加, 而FAS-L较损伤组减少, 推测在胞外肌肽缓冲中和了一部分氧自由基,在胞内肌肽除清除了一些进入细胞内的氧自由基外,还可能使受损伤细胞有一定程度恢复。在损伤组,在没有肌肽的保护下,自由基对细胞产生损害作用后,抑制AKT的磷酸化,同时增加了FAS-L的表达。
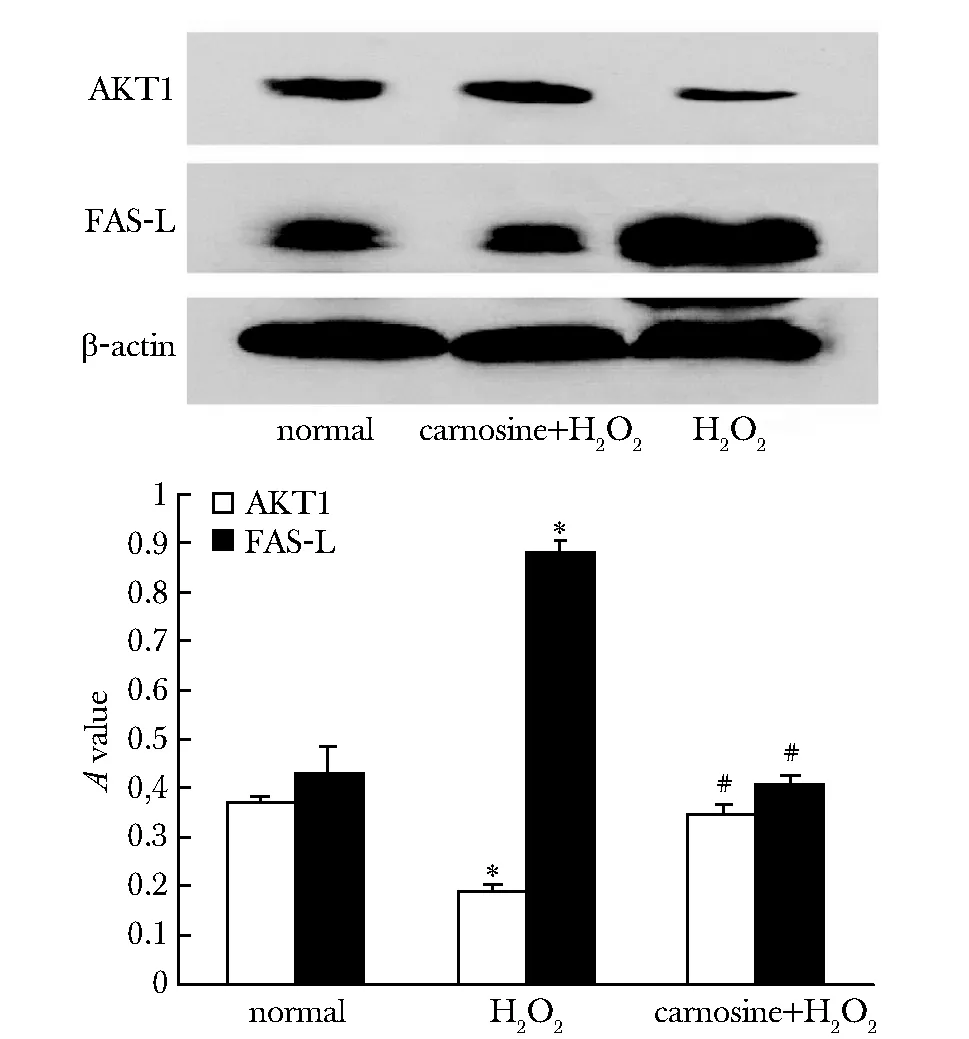
β-actin为内对照;*P<0.05 compared with control group;#P<0.05 compared with H2O2 group图5 AKT1和FAS-L在3组细胞中表达的Westernblot结果及其吸光度定量分析Fig 5 The expression and quantitative analysis ofAKT1 and FAS-L by Western blot
本实验证明了肌肽对N2a细胞氧化应激损伤具有明确的保护作用, 证实了肌肽对活性氧损害的神经细胞具有保护作用,但除抗氧化作用外是否还有其他机制? 肌肽的生物学功能及其抗氧化衰老及对多种疾病的疗效和作用机制还需要更深入的研究和探讨。
[1] Christen Y. Oxidative stress and Alzheimer disease[J]. Am J Clin Nutr, 2000, 71:621S- 629S.
[2] 刘长振, 王爱民, 谢振华, 等. 肌肽对PC12细胞氧化应激损伤的保护作用[J]. 基础医学与临床, 2001, 6:551- 553.
[3] Kang JH, Eum WS. Enhanced oxidative damage by the familial amyotrophic lateral sclerosis-associated Cu,Zn-superoxide dismutase mutants[J]. Biochim Biophys Acta, 2000, 1524: 162- 170.
[4] Decker EA, Ivanov V, Zhu BZ,etal. Inhibition of low density lipoprotein oxidation by carnosine histidine[J]. J Agric Food Chem, 2001, 49:511- 516.
[5] Kang JH. Protective effects of carnosine and homocarnosine on ferritin and hydrogen peroxide-mediated DNA damage[J]. BMB Rep, 2010, 43:683- 687.
[6] Jackson MC, Lenney JF. The distribution of carnosine and related dipeptides in rat and human tissues[J]. Inflamm Res, 1996, 45:132- 135.
[7] Decker EA, Crum AD, Calvert JT. Differences in the antioxidant mechanism of carnosine in the presence of copper and iron[J]. J Agric Food Chem, 1992, 40:756- 759.
[8] Dobrota D, Fedorova T, Stvolinsky S,etal. Carnosine protects the brain of rats and Mongolian gerbils against ischemic injury: after-stroke-effect[J]. Neurochem Res, 2005, 30:1283- 1288.
[9] Ma L, Kerr BA, Naga Prasad SV,etal. Differential effects of Akt1 signaling on short-versus long-term consequences of myocardial infarction and reperfusion injury[J]. Lab Invest, 2014, 94:1083- 1091.
[10] Brint E, O’Callaghan G, Houston A. Life in the FAS lane: differential outcomes of FAS signaling[J]. Cell Mol Life Sci, 2013, 70:4085- 4099.
[11] 郑明奇, 刘刚, 董梅, 等. H2O2对新生大鼠心室肌细胞HCN通道电流的影响及其机制[J]. 基础医学与临床, 2013,12:1523- 1527.
Carnosine Reduces H2O2-induced cellular injury of N2a Cells
WEI Jian-feng*
(Dept. of Histology and Embryology, Basic medical College of Xuzhou Medical University, Xuzhou 221004, China)
Objective To investigate the protective effect of carnosine in oxidative stress induced by H2O2by N2a cells. Methods The N2a cells were divided into three groups: control; H2O2group; carnosine group: carnosine was used in advance. Cell morphology was observed by phase-contrast microscope; immunohistochemistry and Western blot were applied to detect expression of AKT1 and FAS-L. Results Carnosine significantly promoted cell proliferation. Compared with control group,cell morphology changed significantly, cell shrinkage, membrane thickened, foaming phenomenon in H2O2injury group; In the carnosine protection group, carnosine significantly inhibited the H2O2-induced cellular injury, cell morphology obviously better than H2O2group. Compared with the control group, the expression of the AKT1 down-regulated and FAS-L up-regulated in H2O2group, but in the carnosine protection group, the expression of the AKT1 was up-regulated and FAS-L down-regulated than H2O2group (P<0.05). Conclusions Carnosine obviously reduced H2O2-induced cellular injury of N2a cells.
N2a cell; carnosine; oxidative stress; AKT1; FAS-L
2015- 06- 11
2015- 09- 22
1001-6325(2015)11-1535-05
R741.02
A
*通信作者(corresponding author):wjf@xzmc.edu.cn

