乙酸酐/乙酸法制备油溶性胭脂虫红色素
刘兰香,郑华,钱岐雄,张雯雯,高山,张弘
(中国林业科学研究院资源昆虫研究所,国家林业局特色森林资源工程技术研究中心,云南 昆明 650224)
胭脂虫红色素(cochineal)作为昆虫来源的天然染色剂有着悠久的历史[1-2],不仅具有优质的染色能力,并且具有安全性较高、健康、营养和生理活性效应等优点,应用前景广阔[3-4]。胭脂虫红色素的主要染色成分为胭脂红酸,每个胭脂红酸分子的化学结构包含一个核心蒽醌环和一个多羟基的六元环结构单元[5-6],具有极好的水溶性,却几乎不溶于油脂类物质[7]。通过化学结构修饰的方法在胭脂红酸分子中引入疏水性的烷基和脂溶性的醚键、酯基等来改善色素的油溶性可拓展其在各个领域的运用。胭脂红酸分子中的羟基可以与羧酸、酰氯、酸酐等发生酯化反应而减少分子中亲水性羟基的数目,同时增加亲油性的酯基使分子极性减小从而有利于改善胭脂虫红色素的油溶性。乙酸酐是一种是重要的乙酰化试剂,其遇水水解后即生成无毒害且易除去的乙酸,且乙酸酐相对于羧酸、酰氯和其他酸酐具有反应高效、反应体系绿色、无污染等优点,本工作以乙酸酐/乙酸为反应体系对胭脂虫红酸分子进行化学修饰,期望改善胭脂虫红色素的油溶性,同时保持色素原有的优良着色性能。
1 材料和方法
1.1 材料与试剂
胭脂虫红色素,中国林业科学研究院资源昆虫研究所从自主培养的胭脂虫中分离提取;玉米油,嘉里粮油有限公司;乙酸酐、乙酸、乙酸乙酯、无水乙醇、无水硫酸钠、甲醇、乙醇、乙醚、石油醚、甲苯,均为分析纯,西陇化工股份有限公司。
1.2 仪器与设备
AB204-型精密型电子天平,梅特勒-托利多(中国)有限公司; AC-MAGHS-7 型磁力搅拌器,广州仪科实验室技术有限公司; TY742X2A 型纯水机,美国Barnstead 公司;N1000 Rotavapor Rll 型旋转蒸发仪,日本东京理化器械株式会社;101A-2 型电热鼓风干燥箱,上海实验仪器有限公司; TENSON27 型傅里叶变换红外光谱仪,德国布鲁克光谱仪器有限公司; DU800 型紫外-可见光分光光度计,美国贝克曼库尔特有限公司。
1.3 实验方法
1.3.1 油溶性胭脂虫红色素衍生物制备的一般合成方法
称取0.50g 胭脂虫红色素于50mL 圆底烧瓶中,然后按一定比例加入总体积为20mL 的乙酸酐和乙酸,再加入一定量的三乙胺。随后将装有反应混合液的圆底烧瓶置于装有冷凝回流装置的控温磁力搅拌上,调控反应体系的温度进行反应。反应过程中,使用薄层色谱法(TLC)监测[8],间隔30min,当TLC 显示原料点完全消失时停止反应,总反应时间约为8h。
反应停止后,待反应混合溶液自然冷却至室温,加入去离子水45mL 搅拌45min,使乙酸酐充分水解生成乙酸。停止搅拌后将混合液减压蒸馏,然后置于温度为60℃的干燥箱中干燥10h,即可得到目标产物,产物为红色的固体。
1.3.2 制备油溶性胭脂虫红色素衍生物实验条件的单因素考察与优化验证
称取0.50 g 胭脂虫红色素,加入总体积为20mL的乙酸酐与乙酸,保持每次乙酸酐的用量变化为2mL,乙酸酐用量分别为6mL,8mL,10mL,12mL,14mL;催化剂三乙胺(Et3N)的用量分别为0,0.5mL,1.0 mL,1.5 mL,2.0 mL;反应温度分别为50℃,60℃,70℃,80℃,90℃;反应时间分别为4h,6h,8h,10h,12h 的条件下,每次保持其中三个量不变,改变另外一个量,进行单因素实验,每组平行3 次,经恒温非水相反应后分离提纯得到改性后的油溶性胭脂虫红色素衍生物。
在单因素实验的基础上,利用Design-Expert 8.0.5 软件,采用Box-Behnken 试验设计,分别以乙酸酐用量、温度、催化剂用量3 个因素为响应变量,以油溶性胭脂虫红色素衍生物的收率[9]作为响应值进行优化。
对最佳参数进行圆整,在此条件下进行3 组平行实验,取平均值,与响应面优化预测值进行比较。
1.3.3 油溶性胭脂虫红色素衍生物的表征与鉴定
使用UV-VIS 分光光度计测定色素样品的在可见光区的最大吸收波长及其吸光度值,鉴别胭脂虫红色素改性前后的差异。
采用KBr 压片法进行FT-IR,根据所得IR 谱图,对改性后色素衍生物进行结构的初步表征。
1.3.4 色素的色价测定
色价也称比吸光度,是反映一种色素颜色深浅的指标,按照比色法[10-11]测定改性前后色素的色价。
1.3.5 胭脂虫红色素改性前后的油溶性鉴定
将准确称量的红色素样品溶解于食用玉米油中,同时设定不加入色素的油样为空白对照样品,使用紫外可见分光光度计,选择最大吸收波长,测定溶液的吸光度值,记录检测时间。计算油溶性胭脂虫红色素衍生物的保存率,从而评价油溶性胭脂虫红色素衍生物在食用玉米油中的溶解稳定性[12-13]。
2 结果与讨论
2.1 油溶性胭脂虫红色素衍生物制备方法的讨论
酸酐与羟基酯化的反应中,常选用酸性或碱性催化剂来促进反应的发生[14]。在前期试验中,乙酸酐/乙酸的反应体系中分别选用了浓硫酸和三乙胺作为催化剂。试验结果显示,浓硫酸和三乙胺都可催化促使反应的进行,但是使用浓硫酸时产物收率较低,且加入浓硫酸易使原料碳化;当催化剂选用三乙胺时,不但可以提高产物收率,而且在后处理时减压蒸馏即可除去。因此,选择三乙胺做催化剂。
制备油溶性胭脂虫红色素时,反应后处理的操作尤为关键,当反应结束后需加入适量的水使未反应的酸酐彻底水解,若加入水的量过少或水解时间减短,则会造成产品含有部分酸酐,影响产品颜色,造成产品质量不佳。制备油溶性胭脂虫红色素的最后一步操作为减压蒸馏,经减压蒸馏可回收再利用乙酸,同时得到的固体即为目标产物。因此,本实验因溶液体系绿色、无污染,后处理简单易操作有运用于工业生产的可能。
2.2 制备油溶性胭脂虫红色素衍生物的单因素试验结果
2.2.1 温度对油溶性胭脂虫红色素衍生物收率的 影响
温度对油溶性胭脂虫红色素衍生物收率的影响如图1 所示。
从图1 可以看出,在乙酸酐与乙酸用量均为10 mL,催化剂用量为1.0mL,反应时间为8h 的条件下,在一定范围内,产物收率随着反应温度的升高而增加,当反应温度为70℃时可获得最高收率,其值为65.3%;继续升高温度,产物收率反而降低,当温度为90℃时,收率仅为47.7%。本实验的目标产物收率受温度影响较大,可能是因为乙酸酐与胭脂红酸分子酯化的过程是酸酐分子中酰基碳原子上的亲核取代反应,反应需要一定的能量,低温时,反应物的活性较低不利于反应的进行[15-16];但是,当温度较高时,胭脂虫红色素原料中的其他杂质发生变化,从而对生成目标产物的主反应产生干扰而降低了收率。因此,本反应需要在适当的温度条件 下进行,选择温度70℃为中心点,60~80℃为响应面优化区间。

图1 反应温度对油溶性胭脂虫红色素衍生物的收率的影响
2.2.2 乙酸酐对油溶性胭脂虫红色素衍生物收率的影响
控制乙酸酐与乙酸用量总体积为20mL,其中乙酸酐的用量对油溶性胭脂虫红色素衍生物收率的影响如图2 所示。
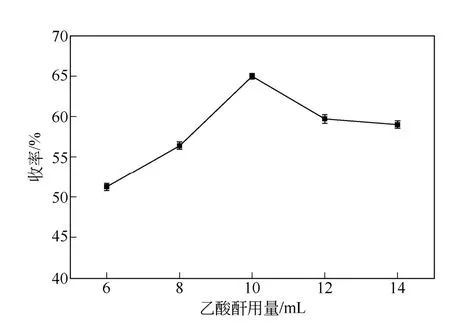
图2 乙酸酐用量对油溶性胭脂虫红色素衍生物的收率的 影响
从图2 可以看出,在温度为70℃,催化剂用量为1.0mL,反应时间为8h 的条件下,乙酸酐的用量直接影响油溶性胭脂虫红色素衍生物收率。目标产物的收率随着乙酸酐用量的增加而逐渐增大,当乙酸酐用量为10mL 时可获得最高为65.1%的收率;当乙酸酐的用量继续增加,收率稍有降低。这可能与该反应的机理有关:胭脂红酸分子中的—OH 具有亲核性,可以进攻乙酐的活性羰基碳,然后离去一分子乙酸同时生成目标产物乙酸酯[17]。每个胭脂红酸分子有八个羟基,足量的乙酸酐才能保证分子中的羟基尽可能多的与酸酐生成最终的目标产物;但是当乙酸酐继续过量时,原料胭脂红酸以消耗完全,反应不再进行,而且过量的乙酸酐在后期水解时对产物造成了损耗而使收率降低。因此,控制乙酸酐与乙酸总用量为20mL,选择乙酸酐用量10mL为中心点,以8~12mL 为响应面优化区间。
2.2.3 催化剂用量对油溶性胭脂虫红色素衍生物收率的影响
催化剂用量对油溶性胭脂虫红色素衍生物收率的影响如图3 所示。从图3 可以看出,在乙酸酐与乙酸用量均为10mL,温度为70℃,反应时间为8h 的条件下,必须有催化剂反应才能进行[17];而且一定范围内,油溶性胭脂虫红色素的收率随着催化剂Et3N 用量的增加而增加,当Et3N 用量为1.0mL 时可获得65.2%的收率,继续增加Et3N 用量,收率基本没有变化。这是因为Et3N 是较强的亲核试剂,容易与乙酸酐分子中的羰基发生亲核反应从而催化酸酐与胭脂红酸分子的反应;另一方面,乙酸酐与胭脂红酸分子发生酯化的同时产生乙酸,反应中加入碱性三乙胺可中和产生的酸从而有利于反应向生成酯的方向进行。因此,选择催化剂用量1.0mL 为中心点,以0.5~1.5mL 为响应面优化区间。
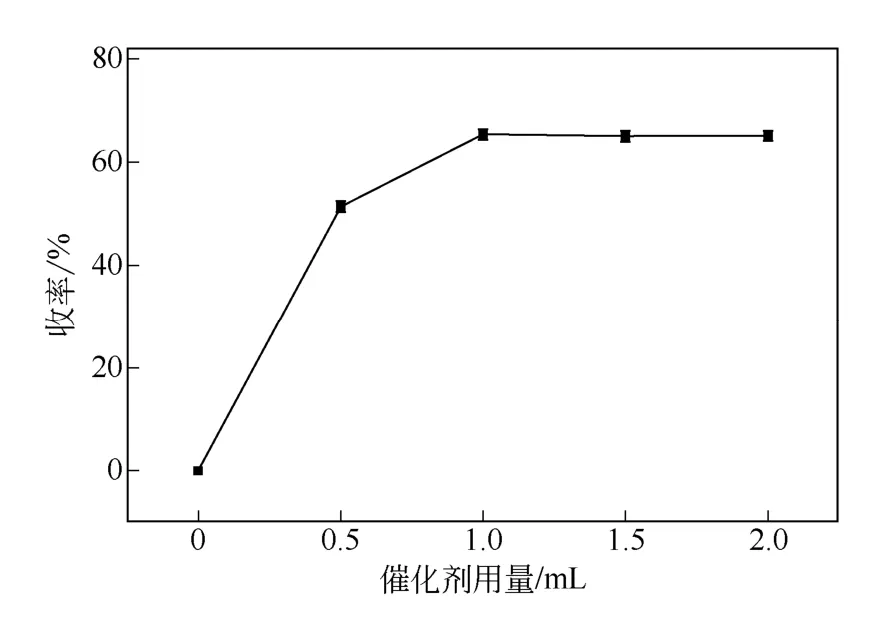
图3 催化剂用量对油溶性胭脂虫红色素衍生物的收率的 影响
2.2.4 反应时间对油溶性胭脂虫红色素衍生物收率的影响
从图4 可以看出,在乙酸酐与乙酸用量均为10 mL,温度为70℃,催化剂用量为1.0mL 的条件下,油溶性胭脂虫红色素衍生物在反应时间6h 时即有目标产物生成;随后反应时间增加,收率也随着增大,但是8h 后收率基本不发生变化,反应时间为8h 的获得产物的收率是65.2%。因此,进行单因素实验时,所有反应的时长保持为8h。
2.3 响应曲面优化法制备油溶性胭脂虫红色素
2.3.1 胭脂虫红色素收率模型的建立

图4 反应时间对油溶性胭脂虫红色素衍生物的收率的影响
通过单因素试验得到乙酸酐与乙酸的用量比、 反应温度、催化剂用量的优化区间表,如表1 所示。
利用 Design-Expert 8.0.5 软件,采用 Box- Behnken 试验设计,选择质量比、温度、催化剂用量3 个因素为变量,得到如表2 所示的试验结果。
对所得实验的数据进行多元回归拟合分析,获得油溶性胭脂虫红色素收率Y 的多元二次多项回归方程为:

在回归方程中,X 变量的正系数表明,该变量的正向变化能引起响应值的增加,负的二次项系数表明方程的抛物面开口向下,具有极大值点,能够进行最优分析[18]。
如表3 的数据所示,模型的P=0.0001,失拟项的值P=0.0002,二者的差异性不显著,且回归模型的拟合系数为0.9918,说明该模型与实验之间的拟合度较好,具有较高的可靠性[19],客观地反映了油溶性胭脂虫红色素衍生物收率与温度、乙酸酐用量、催化剂用量的关系,可用于分析和预测改性后的胭脂虫红色素的收率的工艺结果。一次项T,V,E 及二次项T2,V2,E2的P 值均小于0.05,说明温度、乙酸酐用量、催化剂用量对产物收率都产生显著 影响。

表1 响应面分析因素与水平表
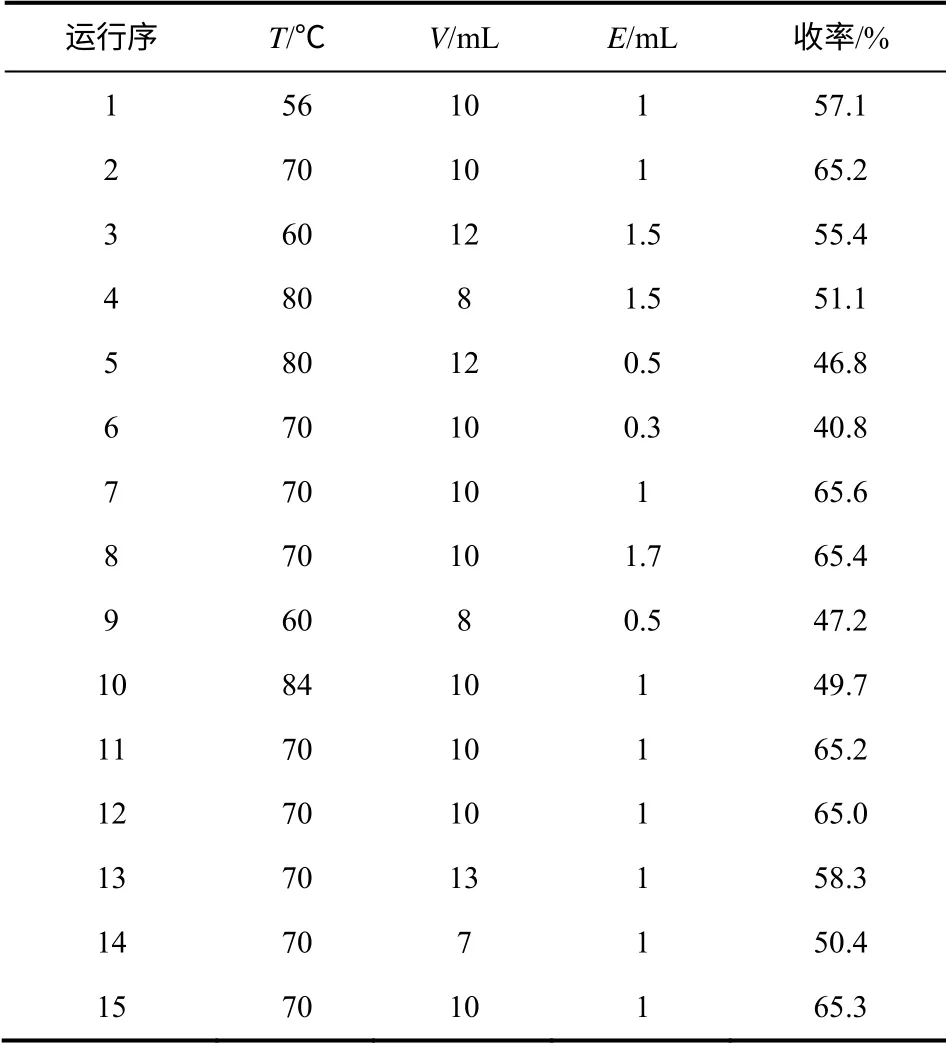
表2 Box-Behnken 设计试验结果

表3 油溶性胭脂虫红色素衍生物的收率回归方程方差分析
通过以上数据得到模型的响应曲面及其等高线图,见图5。图5 针对反应温度、乙酸酐用量、催化剂用量三个因素对胭脂虫红色素衍生物收率的影响得出了直观、准确的评价:催化剂用量的影响大于反应温度,反应温度的影响大于乙酸酐用量。
2.3.2 验证实验
通过Design-Expert 8.0.5 优化,得出乙酸酐酯化法制备油溶性胭脂虫红色素衍生物的最佳条件为:胭脂虫红色素0.5g; 乙酸酐与乙酸用量均为10mL; 催化剂三乙胺用量为1.0mL; 反应温度70℃; 反应时间为8h。在上述最佳组合条件下,油溶性的胭脂虫红色素的收率预测值为64.5%。为检验模型的合理性,在软件分析出的最佳条件下进行3 组平行实验,测得油溶性胭脂虫红色素衍生物收率平均值为65.2%,偏差为0.0108,说明以上分析与改善的条件与实际情况拟合较好,说明该响应曲面法优化得出的最佳工艺条件合理可行。
2.4 油溶性胭脂虫红色素衍生物的红外光谱表征与鉴定
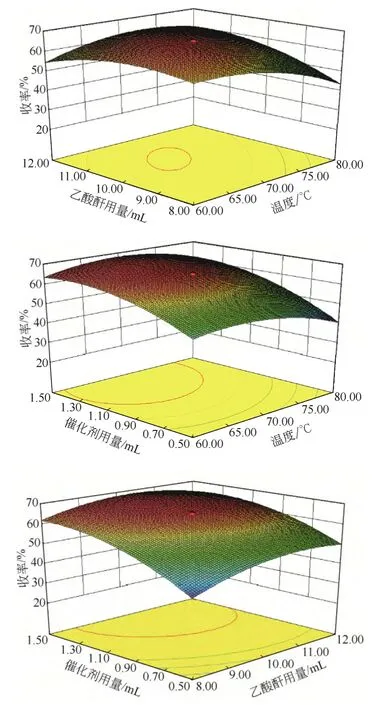
图5 两个因素交互作用影响油溶性胭脂虫红色素收率的响应曲面图

图6 胭脂虫红色素和油溶性胭脂虫红色素衍生物的红外 谱图
图6 为胭脂虫红色素和改性后得到的油溶性胭脂虫红色素衍生物的FTIR 谱图。从图6 中可以看 出,与胭脂虫红色素相比较,经乙酸酐改性后的胭脂虫红色素衍生物在波数为3000~3500cm-1区域内的—OH 吸收峰明显变窄,说明原胭脂红酸分子中羟基的数目减少;明显特征是胭脂虫红色素衍生物在1715cm-1处出现了非共轭脂肪酸/酯中C=O引起的伸缩振动吸收峰[20-21],且在1230cm-1左右可以找到由酯基中—C—O—C—引起的伸缩振动吸收峰[20-21]。以上红外吸收峰的变化表明乙酸酐/乙酸体系有效修饰了胭脂红酸分子的结构,在胭脂红酸分子中同时引入了烷基和酯基。
2.5 油溶性胭脂虫红色素衍生物的紫外-可见光 谱图
图7 为胭脂虫红色素及乙酸酐改性后的油溶性胭脂虫红色素衍生物溶解于乙醇溶液中检测出的紫外-可见光谱图。

图7 胭脂虫红色素和油溶性胭脂虫红色素衍生物的紫外-可见光光谱图
如图7 所示,在可见光区,胭脂虫红色素与乙酸酐改性后的胭脂虫红色素衍生物的最大吸收波长分别为496nm 和463nm,改性后得到的油溶性胭脂虫红色素的吸收带发生蓝移,这可能是由于改性后分子中存在n→π*跃迁的酯键,使得吸收带向短波长方向移动[20,22-23],但是其最大吸收波长仍与文献报道的蒽醌类化合物相符[22-23],表明乙酸酐/乙酸反应体系改性得到的胭脂虫红色素衍生物的发色团仍然是蒽醌环。
2.6 胭脂虫红色素的色价测定
胭脂虫红色素及改性后的油溶性胭脂虫红色素衍生物的在可见光区最大吸收波长分别为496nm和463nm,通过测定它们在最大吸收波长处的吸光度值,计算出它们色价结果如表4 所示。
如表4 所示,经改性得到的胭脂虫红色素衍生物较原料胭脂虫色素的色价值提高了39,说明改性后得到的产物着色能力增强。

表4 胭脂虫红色素及改性后的胭脂虫红色素衍生物的色价(20℃)
2.7 油溶性胭脂虫红色素衍生物的溶解性
实验发现,经乙酸酐/乙酸体系改性后得到的胭脂虫红色素衍生物的溶解性发生了根本性的变化,其几乎不溶于水,却易溶于大部分有机溶剂中,如乙酸乙酯、乙醇、丙酮等溶剂中;也可微溶于乙醚、石油醚等极性较小的有机溶剂中;同时,色素产物能溶于玉米油。胭脂虫红色素衍生物溶解于玉米油中的结果见图8。如图8 所示,经改性得到的产物溶解于食用玉米油中染色效果较强,油样颜色呈橙红色,说明改性后的胭脂虫红色素衍生物在食用玉米油中溶解性好,且具有较佳的着色能力。油样放置1 个月后,油样依然清亮、透明度良好,没有浑浊或者沉淀产生。
将胭脂虫红色素及改性后得到的产物分别添加于去离子水和食用玉米油中,测定它们的溶解度,结果见表5 所示。如表5 所示,经乙酸酐/乙酸反应体系改性后得到的胭脂虫红色素衍生物在玉米油的溶解度为2.41。这个结果表明,乙酸/乙酸酐体系有效地修饰了胭脂红酸分子的结构,减少了分子中亲水的羟基基团,同时增加了疏水性的酯基基团,使得分子极性减小,从而增强了其在油中的溶 解性[24-25]。

图8 添加油溶性胭脂虫红色素衍生物(左)和未添加(右)玉米油的照片

表5 油溶性胭脂虫红色素衍生物在玉米油和水中的溶解度(20℃)
经乙酸/乙酸酐反应体系改性后得到的胭脂虫红色素衍生物溶解在食用玉米油中的稳定性见 表6。
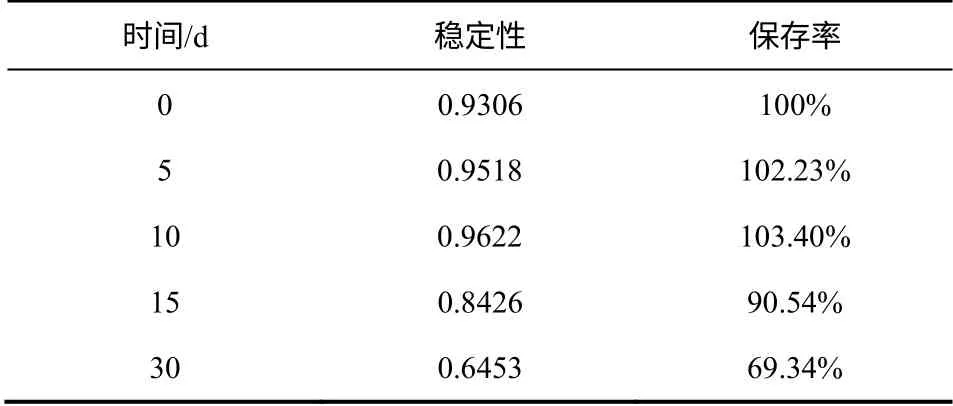
表6 油溶性胭脂虫红色素衍生物溶解在食用玉米油中的 稳定性
如表6 所示,将色素产物溶解于食用玉米油中,在室内自然光的条件下,定期测定其吸光度值,经30 天的追踪观察后发现初始的10 天内,色素油溶液的吸光度值不但没有减小反而增大,说明这段时间内色素产品中的某些成分对色素的稳定性有一定的影响;之后,色素的保存率逐渐减小,但是30天时,色素的保存率依然达到69.34%,说明色素在油中的稳定性较好,具有开发和应用潜在价值与 前景。
3 结 论
(1) 乙酸酐/乙酸法有效地修饰了胭脂虫红酸分子,通过紫外光谱、红外光谱对所得到的目标产物进行了初步的结构表征,表明胭脂虫红酸分子中增加了酯基和烷基,由于胭脂红酸分子的极性减小,使得改性后的色素分子极性与油脂分子的极性相差不大,有助于改性后的色素在油样中的溶解度增加。
(2)乙酸酐/乙酸法制备油溶性胭脂虫红色素衍生物的最佳工艺参数为:胭脂虫红色素0.5g; 乙酸酐与乙酸用量均为10mL; 催化剂三乙胺用量为1.0mL; 反应温度70℃; 反应时间为8h。进行3 组平行实验,测得油溶性胭脂虫红色素衍生物收率平均值为65.2%。该工艺条件下理论与实际的收率偏差仅为0.0108,说明此模型具有一定的合理性,可以作为实际的预测。
(3)乙酸酐/乙酸反应体系绿色、无毒害,后处理操作简单,副产物为乙酸可回收利用,符合绿色化学倡导的理念。制备得到的油溶性胭脂虫红色素衍生物在玉米油中的溶解度为2.41,且稳定性良好,说明胭脂虫红色素的油溶性得到有效的改善,具有开发和应用潜在价值与前景。
[1] Stathopoulououa K,Vallanoub L,Skaltsounisa A L,et al. Structure elucidation and chromatographic identification of anthraquinone components of cochineal (Dactylopius coccus) detected in historical objects[J]. Analytica Chimica Acta,2013,8(3):264-272.
[2] 卢艳民,郑华,张弘,等. 超声波法提取胭脂虫红色素的研究[J]. 食品科学,2009,30(16):142-145.
[3] Palanivel V,Algumthu T,Perumalsamy L,et al. The use of cochineal and Monascus purpureus as dyes for cotton fabric[J]. Coloration Technology,2013,129(4):246-251.
[4] 郭元亨,马李一,郑华,等. 胭脂虫红酸清除自由基的作用[J]. 食品科学,2010,31(17):73-76.
[5] Serrano A,Sousa M,Hallett J,et al. Identification of Dactylopius cochineal species with high-performance liquid chromatography and multivariate data analysis[J]. Analyst,2013,13(8):6081-6092.
[6] Frnk E,Lancaster D,James F,et al. High-performance liquid chromatographic separation of carminic acid,α-and β-bixin ,α-and β-norbixin,and the determination of carminic acid in foods[J]. Journal of Chromatography A,1996,732(2):394-398.
[7] 张弘,卢艳民,郑华,等. 水溶法提取胭脂虫红色素的工艺条件及其优化[J]. 食品科学,2009,30(16):115-118.
[8] 杨丽,张水华,王启军. TLC 薄层色谱法同步检测功能红曲中酸型和内酯型莫那呵啉K(MonacolinK)[J]. 食品研究与开发,2006,27(2):113-114.
[9] 胡金燕,郑华,张雯雯,等. 脂溶性胭脂虫红色素的制备及表征[J]. 食品科学,2014,35(12):29-34.
[10] GB9991—1988.食品添加剂菊花黄[S]. 北京:中国标准出版社,1993:536-553.
[11] 邓洁红,谭兴和,潘小红. 刺葡萄皮色素色价测定及提取工艺研究[J]. 食品研究与开发,2007,28(3):80-83.
[12] Kearsley M W,Katsaboxakis K Z. Stability and use of natural colours in foods red beet powder,copper chlorophyll powder and cochineal[J]. International Journal of Food Science & Technology,2007,15(5):501-514.
[13] 张弘,郑华,陈军,等. 胭脂虫红色素稳定性研究[J]. 食品科学,2008,29(11):59-64.
[14] 马艺文,孙帅婷,许冬玲,等. 酯化反应中催化剂的研究进展[J]. 精细与专用化学品,2008,16(7):27-30.
[15] Zeng Z X,Cui L,Xue W L,et al. Kinetics of the esterification reaction catalyzed by lipase in W/O microemulsions of alkyl polyglucoside[J]. Chinese Chemical Letters,2004,15(6):699-702.
[16] 张秀云,邓建国,黄奕刚,等. 反应条件对环氧大豆油酯化反应的影响[J]. 精细化工,2011,28(3):218-221.
[17] 伍越寰,李伟旭,沈晓明. 有机化学[M]. 第2 版. 北京:中国科学技术大学出版社,2002:380-386.
[18] 田颖,王学魁,高毅颖,等. 响应面法优化钡盐转化法重铬酸钠的制备工艺[J]. 化工进展,2011,30(11):2388-2392.
[19] 朱兴一,杨军辉,谢捷,等. 响应面法优化闪式提取茶叶中儿茶素类物质的工艺研究[J]. 林产化学与工业,2011,31(3):106- -111.
[20] 向智男,站宇,宁正详. 绿原酸分子修饰产物的制备、表征及量子化学计算[J]. 化工学报,2007,58(6):1541-1547.
[21] Yoshida Z,Takabayashi F U. Electronic spectra of mono-substituted anthraquinones and solvent effects[J]. Tetrahedron,1968,24(2):933-943.
[22] Kan J G , Shi Y J. Spectrophotometric determination of 1,4-dihydroxyanthraquinone[J]. Analyst,1995,120(2):573-575.
[23] 满瑞林,倪网东,贾海亭,等. 分光光度法测定虎杖中芪类和蒽醌类化合物[J]. 分析化学,2005,33(12):1808.
[24] Karl B,John E C,Tom G,et al. New ideas about the solubility of drugs[J]. Chemistry & Biodiversity,2009,6(11):1767-1788.
[25] 李雪,王芳,赵晓宏,等. 丹皮酚溶解性能的测定[J]. 中医学报,2013,28(2):221-223.

