电场强化铁粉还原对苯醌合成对苯二酚
孙大贵,刘业芳,刘作华,杜军,范兴,陶长元,周小霞
电场强化铁粉还原对苯醌合成对苯二酚
孙大贵1,刘业芳1,刘作华1,杜军1,范兴1,陶长元1,周小霞2
(1重庆大学化学化工学院,重庆 400044;2第三军医大学化学教研室,重庆 400038)
研究了在酸性体系中,用电场强化铁粉还原对苯醌制对苯二酚的方法,该法考察了铁粉用量、硫酸用量、硫酸加入方式、电解电压和反应时间对铁粉利用率与对苯二酚收率的影响,并在此基础上探讨了还原机理。结果表明:电场强化了还原反应过程中电子的定向迁移,活化了反应物。此时,在95℃下,当硫酸与铁粉的摩尔比(硫酸)∶(铁粉)=1∶3,采用逐步加入硫酸的方式,电解电压为3.0V,反应时间为2h时,铁粉利用率由28.57%提高到75.19%,对苯二酚收率达95%。与现有工艺相比,电场强化法的铁粉利用率高、还原过程无副产物,并且该法易于控制,反应周期短。
催化剂;还原;铁粉;电解
对苯二酚是一种重要的精细化工原料,广泛应用于医药、农药、染料、橡胶、化肥、水处理和液晶聚合物等领域[1-3]。目前,我国对苯二酚的生产工艺主要是苯胺氧化法,该法包括两步反应,即苯胺在硫酸介质中经二氧化锰氧化成对苯醌,再在水溶液中用铁粉将对苯醌还原成对苯二酚[4]。此法具有工艺成熟、收率及产品纯度高等优点,在市场上具有竞争优势,但现有工艺存在还原剂铁粉用量大、生产过程中产生大量铁泥固渣难以处理、容易造成环境污染等问题。
近年来,研究者对苯胺氧化为对苯醌的工艺进行了改进[5],同时也对对苯醌还原制对苯二酚的工艺进行了研究。韩安斌等[6]在还原阶段加入少量的亚铁离子作为引发剂,并在反应前加入少量氢醌,以提高对苯二酚收率;栾天平等[7]采用催化加氢还原对苯醌,彻底解决铁泥固渣的污染。催化氢化法的关键是催化剂的开发,研究报道的催化还原醌类物质的催化剂有Pd/C、Pd/SiO2、Pd/Al2O3、[Ru3(CO)12]、Pt-Re/Al2O3、Pt-Pd/Al2O3等贵金属催化剂[8-9]以及骨架镍催化剂[10],但该法存在催化剂昂贵、对苯醌易过度还原等问题。
与传统加氢工艺相比,电化学还原法具有生产周期短、产品纯度高以及三废污染少等优势,因而受到国内外学者的重视[11-17]。电化学还原法是利用电极本身或化学物质加速电荷在电极和电解质界面之间的交换速度,从而强化反应过程的。本研究拟在现有的铁粉法还原对苯醌的工艺基础上,通过加入电场强化还原过程,以提高铁粉利用率,减少铁泥固渣的产生,实现工艺过程的节能减排。
1 实验部分
1.1 实验试剂与仪器
实验试剂:对苯醌,对苯二酚,硫代硫酸钠,分析纯,成都市科龙化工试剂厂;甲醇,色谱纯,山东禹王实业有限公司化工分公司;铸铁粉,工业品,重庆某厂提供。
实验仪器:直流稳压稳流电源,WYJ-10A30V DC型,杭州苹果仪器仪表有限公司;气相色谱仪,GC1100型,北京普析通用仪器有限责任公司;傅里叶红外光谱仪,IRPRESTIGE-21型,日本岛津制作所。
1.2 实验方法
将0.033mol的铁粉和水(50mL)加入电解槽中(电解槽是无隔膜的烧杯,容积为500mL),升温至95℃;再将0.033mol的对苯醌溶于200mL温水,加入电解槽中;在体系中加入0.011mol 98%的H2SO4作电解质,加电场(其阳极为四元合金(Pb-Ag-Ca-Sr)电极,阴极为不锈钢电极,电极面积为0.02m×0.1m,电极间距为0.03m),控制电压为3.0V,还原时间为2h;待反应结束后,经过滤除杂后得对苯二酚溶液。产物收率采用碘量法分析,产物纯度采用气相色谱法分析。
2 结果与讨论
2.1 铸铁粉组成分析
实验所用铸铁粉取自重庆某对苯二酚生产厂,经研磨至粒径小于75μm,对其进行X射线荧光光谱分析,结果如表1所示。由表1可知,铸铁粉中Fe含量为84.70%,并且含有Mn、Ti、Al、Cr、Cu、V等金属元素。
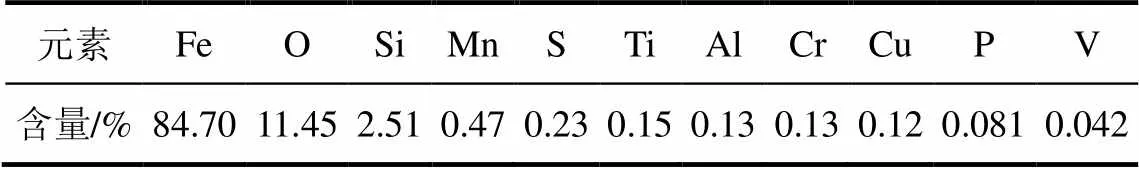
表1 铸铁粉的化学成分
对实验所用铸铁粉进行X射线衍射分析,结果如图1所示。其中,铸铁粉的物相组成是立方晶型的Fe。
2.2 电场强化法与现行工艺的比较
实验加入铸铁粉的量分别为:(C6H4O2)∶(Fe)=1∶1、1∶1.5、1∶2,在95℃下还原10h,对比了电场强化法与现行工艺,实验结果如表2所示。
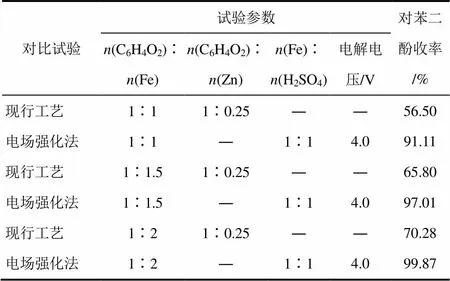
表2 电场强化法与现行工艺对比结果
通过计算,将C6H4O2完全还原所需铁粉的理论用量为C6H4O2摩尔量的0.75倍。由表2可知,在电场强化条件下,当(C6H4O2)∶(Fe)=1∶1时,即使用1.33倍理论用量的铁粉时即可使对苯二酚收率达90%以上;而按照现行工艺,要使对苯二酚收率达到90%以上,所需铁粉为理论用量的3.5~4倍。因此,与现行工艺比较,电场强化法能明显减少生产过程中产生的铁泥固渣,减轻了环保压力及固体废弃物的处理成本。
2.3 H2SO4用量对对苯二酚收率的影响
当(C6H4O2)∶(Fe) =1∶2,电压为4.0V,反应温度为95℃下还原10h,考察了采用一次加入和逐步加入不同量的H2SO4对对苯二酚收率的影响,实验结果如图2所示。由图2可知:随着H2SO4用量的增加,采用一次加入和逐步加入的方式,对苯二酚的收率均呈现先增大后减小的趋势。当H2SO4用量为0.6mL,即(H2SO4)∶(Fe)=1∶3,并且采用逐步加入H2SO4的方式时,对苯二酚收率最高,达97.02%。
[(C6H4O2)∶(Fe) =1∶2; 电压4.0V; 反应温度95℃;反应时间10h]
H2SO4在体系中主要有两个作用:一是与铁粉作用,生成Fe(Ⅱ)作为反应引发剂;二是为体系提供H+。韩安斌等[6]在1986年提出了铁粉还原对苯醌的反应机理,该机理指出:将对苯醌还原为对苯二酚的是Fe(Ⅱ),而Fe(Ⅱ)是由大量过剩的铁(Fe)促使还原对苯醌后生成的Fe(Ⅲ)转变而成。若体系中H2SO4加入过多,铁粉完全转化成FeSO4后,无剩余铁粉将反应生成的Fe(OH)SO4还原为FeSO4继续参与还原反应,导致铁粉利用率不高。在酸性条件下,产生的H+可以加速生成新生态H*的反应,从而加速对苯醌的还原,若体系中H2SO4用量过少,体系中的H+浓度较小,反应速度就较慢。但将H2SO4一次性加入或滴加速度太快,则容易加速生成H2的反应,导致大量H2逸出而降低还原效 果[18-20]。因此选择(H2SO4)∶(Fe)=1∶3,并且采用逐步加入H2SO4的方式较好。
2.4 电解电压对对苯二酚收率的影响
当(C6H4O2)∶(Fe)=1∶2,(H2SO4)∶(Fe)=1∶3,电解电压分别设为2.5V、3.0V、3.5V、4.0V、4.5V,在95℃下还原10h,考察了电压对对苯二酚收率的影响,实验结果如图3所示。由图3可知,当电压为3.0V时,对苯二酚收率可达98.60%。这是由于Fe/Fe2+的标准电极电位为−0.447V,而由于极化作用等原因,反应需要较大的过电位,适当地升高电解电压可以提高对苯二酚的收率;但电压升高到3.0V以上,随着电压的升高对苯二酚的收率反而降低。这是由于电压较高将促使水发生电解,阳极有大量的氧气产生,将生成的对苯二酚氧化,同时产生的大量气体阻止了物质的传递和扩散,从而影响对苯二酚的收率。综合考虑对苯二酚的收率和能耗,选择电解电压为3.0V。
[(C6H4O2)∶(Fe) =1∶2;(H2SO4)∶(Fe)=1∶3; 反应温度95℃; 反应时间10h]
2.5 反应时间对对苯二酚收率的影响
当(C6H4O2)∶(Fe)=1∶2,(H2SO4)∶(Fe)=1∶3,电压为3.0V,反应温度为95℃条件下,分别反应1h、2h、4h、6h、8h、10h,考察反应时间对对苯二酚收率的影响,实验结果如图4所示。
[(C6H4O2)∶(Fe) =1∶2;(H2SO4)∶(Fe)=1∶3; 电压3.0V; 反应温度95℃]
由图4可知,当反应进行2h后,对苯二酚收率即可达95%左右,反应4h后,对苯二酚收率为97%,随着反应时间的继续增加,对苯二酚收率基本保持不变,说明反应已经趋于平衡。因此,与现行工艺的10h比较,电场强化法可以大大加快反应速度,缩短反应达到平衡所需时间,提高生产效率。综合考虑对苯二酚的收率和能耗,选择电解时间为2h。
2.6 铁泥固渣X射线衍射分析
铁泥固渣X射线衍射分析结果如图5所示。图5中的特征衍射峰为立方晶型的Fe3O4的峰。产生的铁泥固渣具有磁性,可用于制造磁性材料,以进一步实现其资源化利用。
2.7 产品结构的鉴定
对还原后所得对苯二酚样品进行了红外光谱分析,其红外光谱图如图6所示,红外光谱吸收峰归属如表3所示。
图6 对苯二酚的红外光谱图
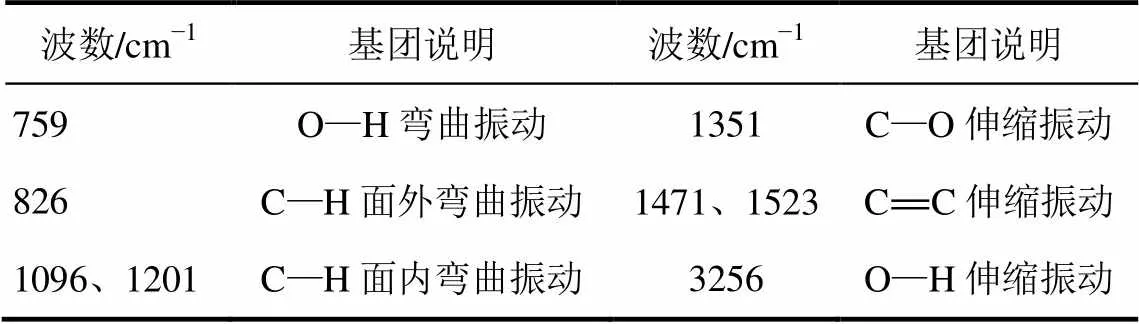
表3 对苯二酚红外光谱基团说明
由图6分析对苯二酚样品和对苯二酚标准品的图谱可知,两图谱的出峰位置基本相同,且对苯二酚的特征峰:3258cm−1、1524cm−1、1471cm−1、1349cm−1、1201cm−1、1094cm−1、826cm−1、757cm−1在样品的红外光谱图中均已出现,由此得出结论,该产品为对苯二酚。
对所得对苯二酚样品进一步作气相色谱分析,实验采用GC-1100气相色谱仪,氢火焰离子化检测器(FID)。气相色谱条件为:柱前压0.05MPa、柱温150℃、汽化室温度220℃、检测器温度250℃、进样量1μL,所得气相色谱图如图7所示。
气相色谱图中保留时间为9.613min的峰为产物对苯二酚的峰,保留时间为5.133min的峰为反应物对苯醌的峰。由图7可知,电场强化铁粉还原对苯醌,不会造成对苯醌的过度还原,反应过程无副反应发生,用于工业化生产其工艺可控性强。
3 反应机理推测分析
电场强化铁粉还原对苯醌的产物为对苯二酚,未检测到其他副产物。反应可用式(1)表示[6]。
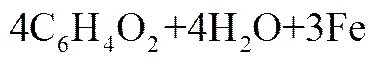
在反应过程中,首先铁粉作为还原剂,在阳极被氧化释放出电子,如式(2)所示。
—→(2)
同时,铁粉溶解于酸性溶液中,也和稀硫酸发生如式(3)的反应。
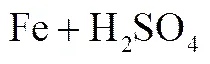
水和硫酸作为质子供体,发生如式(4)、(5)的反应。
—→(4)

式(4)和式(5)反应生成的H+作为电子接受体,在金属表面形成高还原性的中间产物—新生态H*,如式(6)所示[19]。
—→(6)
新生态H*具有很强的还原性,还原对苯醌生成对苯二酚,如式(7)所示。
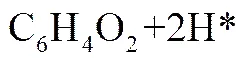
而H+在接受电子时还可能会发生如式(8)的反应。
—→(8)
在酸性条件下,产生的H+可以加速式(6)的反应,从而加速对苯醌的还原,但如果酸性太强或酸性溶液滴加速度太快的话,则容易加速式(8)的反应,从而产生大量H2逸出而降低还原效果,以上实验结果也符合这一推论。
通过电场的强化作用,促进了氧化还原反应中电子的定向迁移,活化了反应物。电场的加入能明显加速还原反应的另一个原因可能是微电池的腐蚀作用[21-22]:铸铁粉中的铁与其他金属元素形成无数微电池,可以加快铸铁粉的腐蚀,增大腐蚀电流,因此铁粉释放电子的速率加快,从而加速对苯醌的还原速率。
4 结 论
(1)酸性体系中,通过电场强化铁粉还原对苯醌制对苯二酚,在95℃下,(H2SO4)∶(Fe)=1∶3,采用逐步加入H2SO4的方式,电解电压为3.0V,反应时间为2h时,铁粉利用率达75%,对苯二酚收率达95%。
(2)与传统的铁粉还原法相比,电场强化铁粉还原对苯醌可有效提高铁粉利用率、减少铁泥固渣,缩短反应时间,提高生产效率。
(3)铁粉利用率提高是由于电场的强化作用,促进了还原反应中电子的定向迁移,活化了反应物;同时,铸铁粉中的铁与其他金属元素形成无数微电池,加快了铸铁粉的腐蚀,增大了腐蚀电流,提高了铁粉释放电子的速率,从而加速了对苯醌的还原速率。
致谢:感谢重庆化医(控股)集团公司牟天明高级工程师给予的指导和重庆川庆化工厂提供的现场实验条件。
[1] Wang J,Park J N,Jeong H C,et al. Cu2+-exchanged zeolites as catalysts for phenol hydroxylation with hydrogen peroxide[J].,2004,18(2):470-476.
[2] Ma W,Long Y T. Quinone/hydroquinone-functionalized biointerfaces for biological applications from the macro- to nano-scale[J].,2014,43(1):30-41.
[3] Etesami M,Karoonian F S,Mohamed N. Electrooxidation of hydroquinone on simply prepared Au-Pt bimetallic nanoparticles[J].,2013,56(6):746-754.
[4] 刘迎新,李新学,维雄辉. 对苯二酚合成方法的研究进展[J]. 化学通报,2004,67(12):869-875.
[5] 朱国华,刘铁铮. 苯胺法生产对苯二酚的工艺评述[J]. 化学工业与工程技术,1996,17(2):46-49.
[6] 韩安斌,林原斌,刘淑平. 苯胺法制对苯二酚的改进[J]. 化学世界,1986(10):442-444.
[7] 栾天平,阮怀仁. 对苯二酚生产工艺改进[J]. 安徽化工,1998,96(6):8-9.
[8] Drelinkiewicz A,Waksmundzka-Gora A.Investigation of 2- ethylanthraquinone degradation on palladium catalysts[J].,2006,246(1-2):167-175.
[9] Pelayo-Vazquez J B,Gonzalez F J,Leyva M A,et al.A ruthenium carbonyl cluster containing a hydroquinone ligand:A layered structure with a polymetallic species. Structure and electrochemical characterization[J].,2012,716:289-293.
[10] 孙大贵,刘业芳,范兴,等. 全国第19届有机和精细化工中间体学术交流会论文集[C]//南京:中国化工学会,2013.
[11] Lisa J G,Goran J. Dechlorination of-chlorophenol on Pd/Fe catalyst in a magnetically stabilized fluidized bed. Implications for sludge and liquid remediation[J].,1999,54(15-16):3085-3093.
[12] Zhang W H,Quan X,Wang J X,et al. Rapid and complete dechlorination of PCP in aqueous solution using Ni-Fe nanoparticles under assistance of ultrasound[J].,2006,65(1):58-64.
[13] 张雯雯,徐颖华,周巧玲,等. 还原橄榄T的间接电还原法[J]. 化工学报,2012,63(6):1803-1809.
[14] Magali S,Martín G,Felipe J G,et al. Electrochemical reduction of 1,4-benzoquinone. Interaction with alkylated thymine and adenine nucleobases[J].,2003,543:73-81.
[15] 马淳安,褚有群,童少平,等. 对氨基苯酚的绿色电化学合成及其工业化[J]. 化工学报,2004,55(12):1971-1975.
[16] Xu W Y,Gao T Y. Dechlorination of carbon tetrachloride by the catalyzed Fe-Cu process[J].,2007,19(7):792-799.
[17] 孙大贵,王冰青,刘作华,等. 电场强化氯化铵法浸取毒重石的实验研究[J]. 无机盐工业,2014,46(1):17-19.
[18] 孙大贵,刘业芳,陶长元,等. 一种电催化还原对苯醌生产对苯二酚的方法:中国,201310116429. 2[P]. 2013-07-24.
[19] 龚金星,徐颖华,马淳安,等. 锌/银二元金属体系中五氯吡啶的电催化还原脱氯[J]. 化工学报,2008,59(s1):55-59.
[20] 童少平,胡丽华,魏红,等. Ni/Fe二元金属脱氯降解对氯苯酚的研究[J]. 环境科学,2005,26(4):59-62.
[21] 吴德礼,王红武,马鲁铭. Ag/Fe催化还原体系处理水体中氯代烃的研究[J]. 环境科学,2006,27(9):1802-1807.
[22] Pablo D A,Drochss P V,Miguel A G,et al. Electrochemical and chemical formation of a low-barrier proton transfer complex between the quinone dianion and hydroquinone[J].,2012,81:197-204.
Preparation of hydroquinonefrom-benzoquinoneintensified by reduction with iron powder under electric field
1,1,1,1,1,1,2
(1School of Chemistry and Chemical Engineering,Chongqing University,Chongqing 400044,China;2Chemistry Group,Third Military Medical University,Chongqing 400038,China)
Preparation of hydroquinone from-benzoquinone intensified by reduction with iron powder was studied under electric field in the acidic system. The effects of dosage of iron powder,dosage of H2SO4,means of adding H2SO4,voltage and reaction time on the utilization ratio of iron powder and the yield of hydroquinone were investigated and the mechanism of the reaction process was studied. Electric field strengthened the electronic directional migration and activated iron powder in the reduction process.Optimal parameters were obtained with molar ratio of H2SO4/Fe 1∶3 at 3.0V for 2h,and H2SO4was added gradually. The utilization ratio of iron powder was increased from 28.57% to 75.19% and the yield of hydroquinone was up to 95%. Compared with the present industrial process,there was higher iron powder utilization and there was no reduction byproduct. Furthermore,the method was easy to control and could greatly shorten the reaction period.
catalysis;reduction;iron powder;electrolysis
TQ 243.1
A
1000–6613(2015)09–3476–05
10.16085/j.issn.1000-6613.2015.09.043
2015-02-02;修改稿日期:2015-03-22。
国家自然科学基金(31101447)及重庆市121科技支撑示范工程项目(kjzcsf28)。
孙大贵(1954—),男,硕士,副教授,主要从事环境资源化工方面的研究。E-maildaguisun@126.com。联系人:刘作华,博士,教授,主要从事环境资源化工和化工工程强化方面的研究。E-mailliuzuohua@cqu.edu.cn。

