分子吸收光谱在半导体薄膜化学气相沉积中的应用
汪文鹄,左然,刘鹏,童玉珍,张国义
(1 江苏大学能源与动力工程学院,江苏 镇江 212013;2 北京大学物理学院 宽禁带半导体研究中心, 北京 100871;3 东莞中镓半导体科技有限公司,广东 东莞 523500)
化学气相沉积(CVD)是一种广泛使用的薄膜加工技术,特别适用于生长单质和化合物半导体薄膜材料和器件[1-3]。典型的CVD 过程是通过载气携带反应气体进入反应腔室,在加热的衬底表面发生化学反应,产生薄膜沉积。反应过程通常也伴随产生寄生产物,大多数寄生产物会随着气流被带走,但少数会滞留在反应腔中,造成薄膜和反应器壁玷污以及源气体浪费[4]。了解CVD 中的各种气相反应,对于减少源气体损耗、优化生长参数、提高薄膜质量具有重要意义。
化合物半导体薄膜广泛用于制备LED 等光电器件。这种薄膜生长通常需要至少两种反应前体。以金属有机化学气相沉积(MOCVD)生长GaN 为例,金属有机物三甲基镓(TMG)提供Ⅲ族元素Ga,氨气(NH3)提供Ⅴ族元素N。NH3和TMG作为源气体,在高温下会发生加合反应和热解反 应[5]。加合反应路径为:TMG 和NH3在低温下生成加合物TMG∶NH3,然后加合物分解脱去CH4分子,生成氨基物DMGNH2以及低聚物(DMGNH2)3。氨基物可以参与薄膜生长,而低聚物产生有害的纳米颗粒。热解反应路径为:加合物重新分解为TMG和NH3,然后TMG 在高温下依次脱去甲基CH3,生成二甲基镓(DMG)和单甲基镓(MMG),它们是薄膜生长的主要前体[5-6]。不同生长条件(反应室结构、温度、压力等)下化学反应不同,薄膜沉积速率和均匀性也存在差异[7-9]。因此,确定气相反应中的物种、进而确定不同条件下的化学反应路径以及分析薄膜组分至关重要。分子吸收光谱可以用来测量气体的浓度,从而用于研究化学反应路径和计算化学反应速率,分子吸收光谱还可用于薄膜成分分析等。
分子吸收光谱是气体浓度原位测量的主要方法,包括紫外-可见吸收光谱和红外吸收光谱,它们在原理上都是根据朗伯-比尔定律测量气体浓度。在气相化学反应的研究中,主要通过分子吸收光谱来确定反应前体的流量、浓度、反应物量的减少,生成物量的增加等。本文主要介绍紫外-可见吸收光谱和红外光谱在测量CVD 中气相反应物种和含量以及薄膜的元素组成等方面的应用,特别是在研究氮化物薄膜MOCVD 生长的化学反应路径中的应用。
1 紫外-可见吸收光谱在CVD 过程的应用
1.1 分子吸收光谱
紫外-可见吸收光谱是分子中的价电子在不同的分子轨道间跃迁而产生,红外吸收光谱是分子振动能级跃迁产生。两种光谱的原理都是以朗伯-比尔定律为基础,通过物质对光的吸收峰和吸收强度来判断物质的存在和浓度。设光束通过吸光物质前后的强度分别为I0和I,那么朗伯-比尔定律的数学关系式可表示为式(1)。

式中,A 是吸光度,表示物质对光的吸收程度;T 为透射率,即I 与I0的比值[10]。
1.2 CVD 中紫外-可见光谱仪测量系统
在使用紫外-可见吸收光谱原位测量CVD 过程的系统中,氘灯、卤素灯分别作为紫外和可见光光源;在反应器上加装石英窗口,从而使紫外和可见光透过[11-13]。由于测量气体的吸收光谱不会影响CVD 反应器中的反应过程,因此特别适合原位 测量。
Johnson 等[13]构建了用于监测CVD 过程气体浓度的紫外吸收光谱光学测量系统,如图1 所示。该系统由紫外光源(氘灯)、光纤、光谱仪、硅光电二极管、计算机等组成。水平式反应器包括双层石英管,内层为水平扁管,内置生长薄膜衬底;外管为圆柱管,用来支撑内管免遭大气压力。在内外管之间有N2净化,保护壁面清洁和光路清晰。紫外光路在反应室基座的上游位置,其温度较低,对源气体影响小,此处的吸收光谱是因反应前体吸收紫外-可见光产生。
1.3 紫外-可见吸收光谱测量CVD 过程气体浓度
CVD 制备化合物半导体薄膜所用的Ⅲ族金属有机气体和V族气体能够吸收波长在200nm附近的紫外光。常用的金属有机物有三甲基镓(TMG)、三甲基铟(TMI)和三甲基铝(TMA),Ⅴ族气体则主要为氨气(NH3)。测量上述气体在不同条件下的紫外吸收光谱,可以得到不同物质的浓度,从而判断化学反应的发生条件等。常见的金属有机物和Ⅴ族有机源的最大吸收波长λmax和摩尔吸光系数ε列于表1。
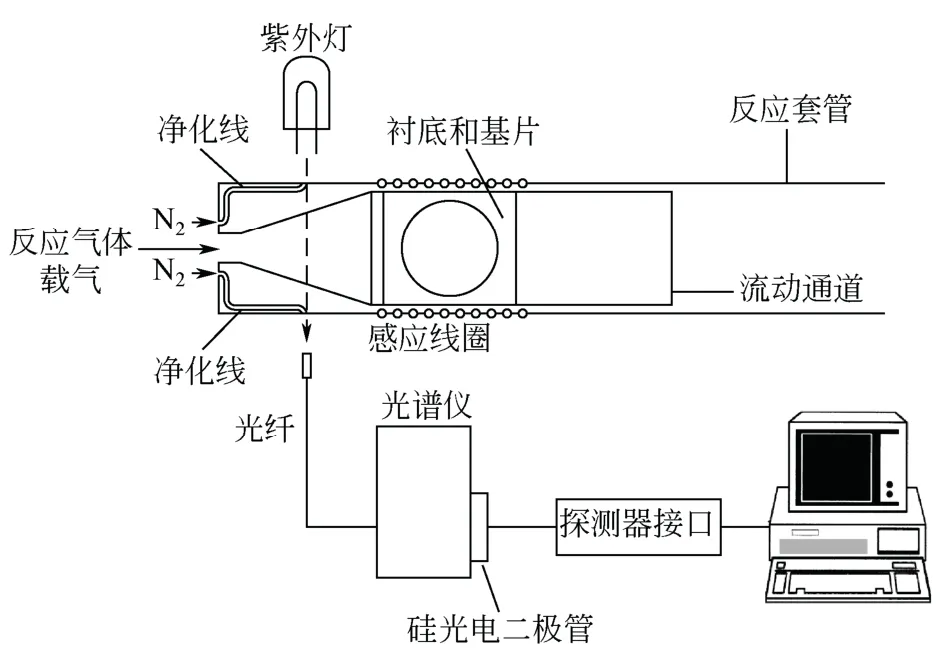
图1 MOCVD 中紫外吸收光谱光学测量系统原理图

表1 常见的金属有机物和Ⅴ族有机源的最大吸收波长λmax和摩尔吸光系数ε[14-16]
Dietz 和Woods[14,17-18]用紫外-可见吸收光谱分析了高压化学气相沉积(HPCVD)中源气体NH3和TMI 的分解。测量NH3的紫外吸收光谱,发现波长在198nm、205nm、209nm 等处有吸收峰;而TMI 在210.7nm 处发现了吸收最大值。根据朗伯-比尔定律,吸光度和气体浓度成正比,因此,测量气体的吸光度可以得到其浓度。在波长210.7nm 处、压力为10bar(1bar=1.01×105Pa,下同)的反应器中,分别测量不同温度下的NH3和TMI 的紫外吸收。发现NH3在850K 开始分解,而大气压下990K才开始分解;而TMI 的分解温度为800K,比低压化学气相沉积的分解温度略高[17-18]。表明TMI 和NH3的分解与温度和压力有关。
TMI 和三甲基磷(TMP)是MOCVD 制备半导体材料磷化铟(InP)的源气体,Karlicek 等[15]用紫外吸收光谱研究了TMI 和TMP 的反应。将TMI 从室温加热到265℃,没有观测到TMI 的吸光度发生变化;继续加热TMI 到270℃,发现TMI 的吸收光谱强度减弱,持续75min 后,TMI 的吸收峰消失,表明在该温度下TMI 发生热解。测量TMI 和TMP在40℃、100℃、300℃的紫外吸收光谱。在40℃发现了TMI·TMP 的吸收特征峰,从40℃加热到100℃,吸收光谱发生变化,而从100℃冷却到40℃,吸收光谱和40℃时光谱一致。在100℃到300℃没有发现吸光度变化,吸收光谱与等量TMI、TMP 的吸收光谱之和一致,而在300℃发现了TMP 的吸收特征峰。表明在40℃到100℃,TMI·TMP 发生可逆分解;在100℃到300℃,TMI·TMP 完全分解为TMI和TMP;在300℃以上,TMI 分解,TMP 不发生 分解。
Alexandrov 等[19]利用紫外吸收光谱研究了GaCl3和NH3反应的机理。在薄膜沉积之前,反应前体 G a C l3和 N H3在气相中会生成络合物GaCl3·NH3,同时GaCl3和GaCl3·NH3加热后会发生分解。在350℃、500℃、600℃、750℃、900℃测量GaCl3·NH3-Ar 的透射比,分析不同条件下可能存在的物质。GaCl3·NH3和NH3的吸收光谱的最大吸收值对应波长相同[图2(a)]可以判断NH3的存在。当温度在600~700℃[图2(b)],被测气体在波长249nm 附近有很强的吸收,该吸收光谱与GaCl 的电子迁移吸收光谱吻合。在230~300nm 波段,GaCl3·NH3相对NH3吸收更强[图2(c)],且GaCl3有最大吸收波长小于230nm 且很宽的吸收带,因此GaCl3可能存在。
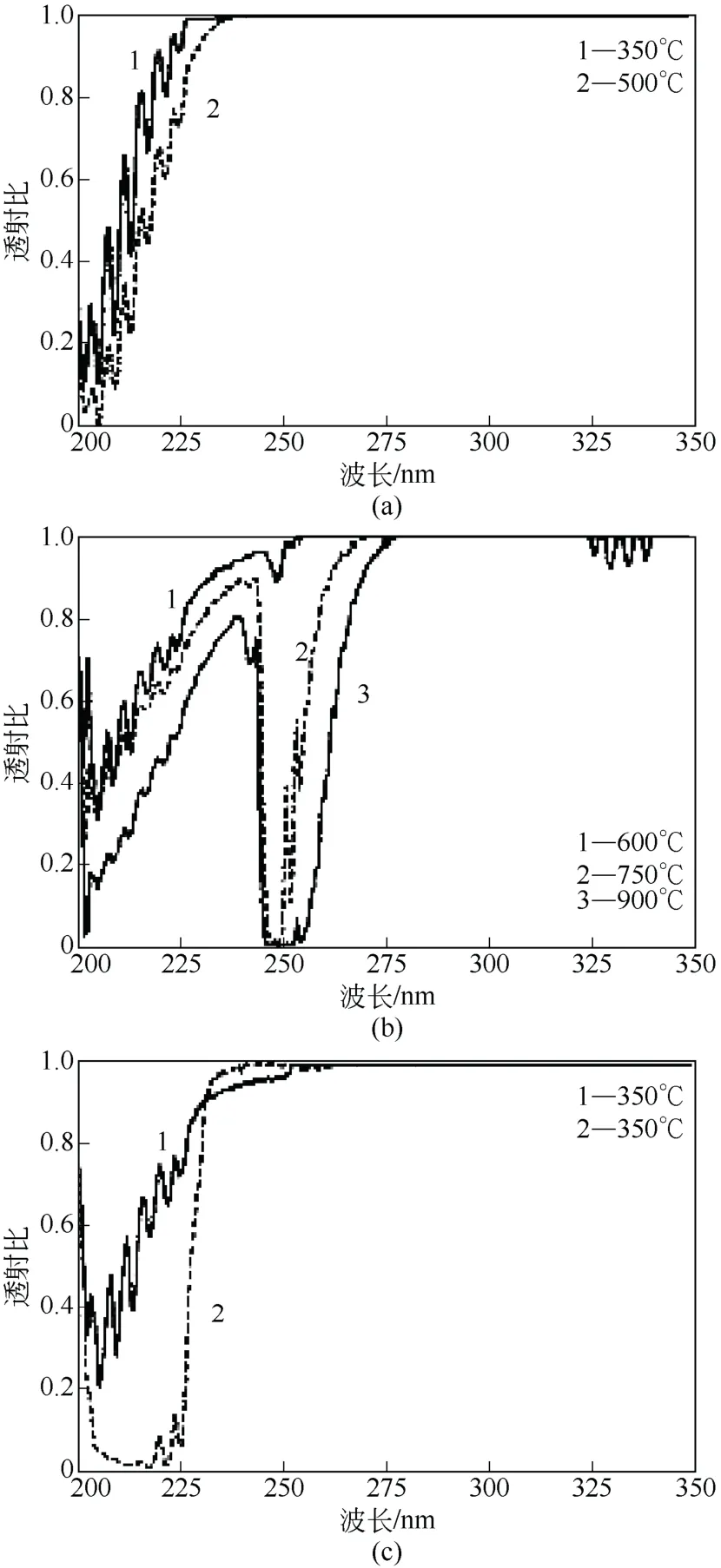
图2 以Ar 为载气的不同温度下气体的紫外吸收光谱[19]

表2 GaCl3 和NH3 制备GaN 的化学反应及条件[16]

图3 不同温度的积分吸收系数K [19]
通过比较不同温度的吸收光谱,并结合反应热力学计算,可以得到不同温度下发生的化学反应,如表2。图3 是GaCl3·NH3加合物在360Pa、不同温度下的积分吸收系数K(与气体浓度有关)。从图3中可看出,温度在 300~500℃时,反应①中GaCl3·NH3可逆分解为GaCl3和NH3。当温度高于500℃时,GaCl3和NH3的浓度降低,反应②可能发生。同时GaCl 的浓度增加,表明反应③发生。进一步研究发现在300~500℃,当GaCl3·NH3加入NH3后波长在230~245nm 的吸收减弱,表明GaCl3增加。当温度高于500℃,发现波长在245~270m和320~350nm 波段的吸收强度减小,GaCl 浓度降低。各种情况中,随NH3的增加GaN 沉积速率增大。GaCl3和GaCl 的减少是由于反应④、⑤消耗生成GaN。
2 红外吸收光谱在CVD 中的应用
2.1 FTIR 在CVD 气相反应路径中的应用
不同化学键间的红外特征吸收峰干扰小,具有高度的特征性,不仅可以采用与标准化合物的红外光谱对比的方法进行分析和鉴定物质,而且可以区分不同同位素组成的化学键,从而区分化学反应中不同物质中相同元素的运动和迁移[20-21]。
国外学者利用红外吸收光谱,针对TMG 和NH3为源气体生长GaN 的MOCVD 过程,进行了大量研究。Sywe 等[22]用FTIR 研究了TMG 和NH3在低温下的反应,发现生成TMG∶NH3及其它产物的证据。分别在 (a)室温下NH3过量,(b)室温下TMG过量,(c)150℃时NH3过量等不同条件下测量NH3和TMG 的红外吸收光谱。对比(a)(b)(c)的红外吸收光谱发现:(a)中NH3的吸收峰消失,(b)中NH3吸收峰存在,TMG 的吸收峰则相反;在(a)(b)中都发现TMG∶NH3的吸收特征峰,但(c)中不仅观测到TMG∶NH3吸收特征峰,也观测到TMG 吸收特征峰。因此,TMG 和NH3在低温下生成加合物TMG∶NH3,而加合物TMG∶NH3在150℃可逆分解。
Mazzarese 等[23]利用FT-IR 和同位素示踪法研究了TMG 和NH3的气相反应。利用H 的同位素D标记NH3和H2,不影响气体的化学性质追踪产物中H 的来源。FTIR 可以区分H 和D 组成化学键的吸收峰。当用ND3和TMG 反应时,并没有探测出CH4,而探测到CH3D。由此断定,CH4的出现是因为TMG和NH3反应生成,而非来自TMG 的直接分解。
Creighton 等[24-26]用FT-IR 进一步研究了TMG和NH3在不同温度下的反应机理。图4 是两种混合气体分别在53℃、127℃、269℃的红外吸收光谱。在53℃发现了加合物TMG∶NH3的特征峰,在 127℃发现TMG∶NH3的吸收强度降低约40%,而在269℃,加合物TMGa∶NH3的特征峰消失,发现了TMG 的吸收特征峰。图5 是将TMG 和NH3加热到574K 时红外吸收光谱。图5 中曲线a 为去除NH3吸收的混合气体吸收光谱,b 为去除TMG吸收的混合气体吸收光谱并放大7 倍,c 为单纯CH4的吸收光谱。在a 中,发现CH4的特征吸收光谱。通过b 和c 的对比,发现TMG 分解,但是没有发现DMGNH2的吸收特征峰。因此得出TMG 和NH3在低温下加合生成TMG∶NH3,温度升高时可逆分解为TMG 和NH3,温度更高时TMG∶NH3和TMG分别不可逆的脱去甲烷和甲基。

图4 NH3 和TMG 在不同温度下气体的吸收光谱[24]
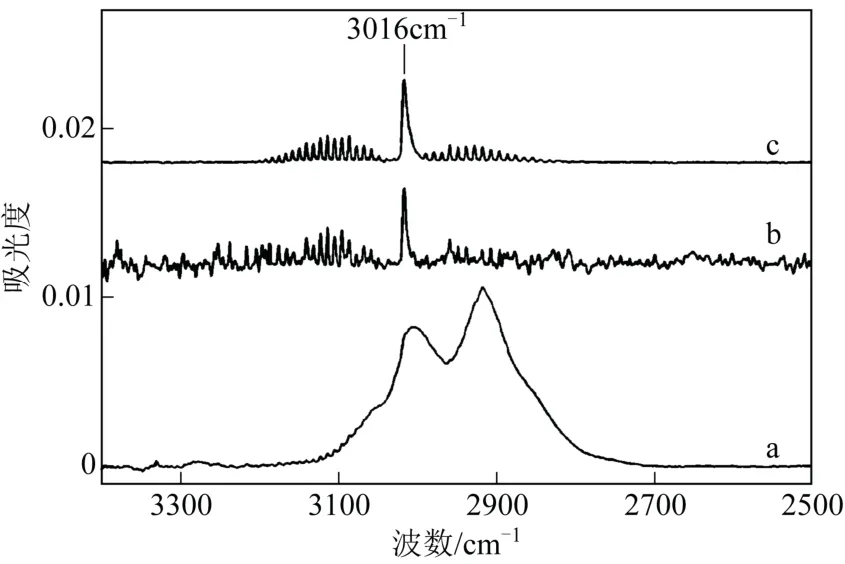
图5 3 种条件下气体的吸收光谱[25]
2.2 FT-IR 在CVD 薄膜成分分析中的应用
为了得到N 型和P 型半导体,需要在CVD 过程中掺杂,薄膜会被源气体中其他元素玷污[27]。碳化硅(SiC)是重要的宽禁带半导体材料,具有耐高温和抗辐射等特性,主要用化学气相沉积方法生 长[28-29]。Kamble 等[29]用FT-IR 分析了SiC 薄膜的部分元素的含量。纯净的硅烷(SiH4)和乙烷(C2H6)在200℃利用热丝化学气相沉积(HWCVD)方法可以高速率沉积SiC 薄膜。借助FT-IR 可以分析SiC薄膜中所含的各种元素含量,从而分析不同条件下元素的并入。
Basa 和Smith[30]提出了计算元素含量的关系式,如式(2)。

式中,Aω和α(ω)对应频率ω 的吸光度和吸收系数。Kamble 根据关系式(2),并结合式(1),计算得到不同压力下Si-C、Si-H、C-H 的密度变化。当压力增加,Si-C 密度增加,而C-H 和Si-H 密度减少。当压力从5mTorr(1Torr=133.322Pa)增加到55mTorr,H 含量从22.6%降到14.4%,表明高压下C 更加容易与Si 结合,低压下C 更容易与H 结合。
2.3 红外光谱研究CVD 的化学反应动力学参数
已知物质或者基团的特征吸收峰,可以在其红外吸收光谱中确定物质的存在及含量。Sugiyama 等[31]研究了在不同条件下红外吸收光谱中TBP 等物质含量随时间的变化关系,结合式(3)和式(4),计算出化学反应速率k,已知不同温度的速率常数,根据阿累尼乌斯公式可以计算化学反应速率的指前因子和活化能,如式(3)、式(4)。

式中,C 为气体在时间τ 时的浓度;C0为气体反应前的初始浓度;k 为反应速率常数。式(3)给出浓度C 与一阶反应的驻留时间τ 的关系,式(4)是阿累尼乌斯公式,反映了速率常数与指前因子、活化能和温度的关系。
TBP 浓度是由红外吸收光谱特征峰强度来确定。由式(4),TBP 的浓度和其初始浓度比值的对数ln(C/C0)与时间呈线性关系,函数图像的斜率为-k。图6 反映了TMG、TMI、TBP、TBA(叔丁基砷)、DMZ(二甲基锌)的速率常数随温度的变化。根据阿累尼乌斯公式,图6 中的函数图像的斜率和纵坐标截距分别为-Ea和lgA。从图6 中得出的速率常数关系见表3。
Kim 等[32]利用红外吸收光谱测量发现,TMG∶NH3和TMG 在500℃左右分解释放出CH4。图7是TMG 和TMG∶NH3在520℃和550℃时偏压比的对数随时间变化的关系。通过阿累尼乌斯公式得到TMG∶NH3分解速率常数,如式(5)。
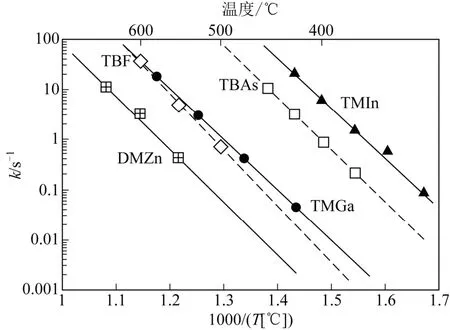
图6 源气体分解速度的阿累尼乌斯关系[31]

表3 MOVPE 源的分解反应速率常数[31]
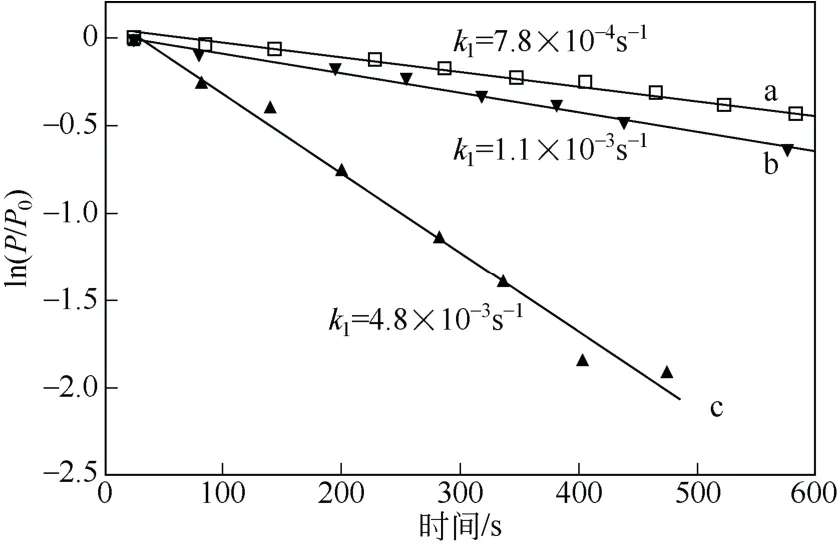
图7 不同条件下反应物的偏压和初始偏压比P/P0随时间的变化关系[32]
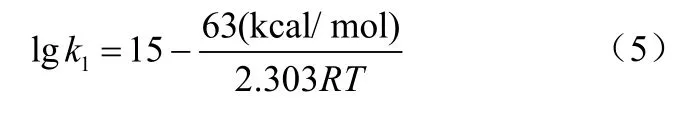
3 结 语
紫外-可见吸收光谱和红外光谱是测量半导体薄膜化学气相沉积生长中分子浓度的主要工具,特别是可以实现气体浓度的原位测量。本文介绍了紫外-可见吸收光谱和红外光谱用于化学气相沉积的紫外-可见吸收光谱测量系统,以及在测量气体浓度和不同条件下的化学反应机理中的应用。特别是在MOCVD生长GaN的气相反应路径及反应速率分析以及SiC 薄膜生长的成分分析等方面的应用。
[1] Kuznia J N,Khan M A,Olson D T,et al. Influence of buffer layers on the deposition of high quality single crystal GaN over sapphire substrates[J]. Journal of Applied Physics,1993,73(9):4700-4702.
[2] Addamiano A,Sprague J A. “Buffer-layer”technique for the growth of single crystal SiC on Si[J]. Applied Physics Letters,1984,44(5):525-527.
[3] 许效红,周爱秋. 金属有机化学气相沉积反应器技术及进展[J]. 化工进展,2002,21(6):410-413.
[4] Mihopoulos T. Reaction and transport processes in OMCVD:Selective and group III-nitride growth[D]. Massachusetts :Massachusetts Institute of Technology,1999.
[5] Parikh R P,Adomaitis R A. Validating gallium nitride growth kinetics using a precursor delivery showerhead as a novel chemical reactor[J]. Journal of Crystal Growth,2006,296:15-26.
[6] Parikh R P,Adomaitis R A. An overview of gallium nitride growth chemistry and its effect on reactor design:Application to a planetary radial-flow CVD system[J]. Journal of Crystal Growth,2006,286(2):259-278.
[7] Thon A,Kuech T F. High temperature adduct formation of trimethylgallium and ammonia[J]. Applied Physics Letters,1996,69(1):55-57.
[8] Theodoropoulos C,Mountziaris T J,Moffat H K,et al. Design of gas inlets for the growth of gallium nitride by metalorganic vapor phase epitaxy[J]. Journal of Crystal Growth,2000,217(1):65-81.
[9] Mihopoulos T G,Gupta V,Jensen K F. A reaction-transport model for AlGaN MOVPE growth[J]. Journal of Crystal Growth,1998,195(1):733-739.
[10] 李克安. 分析化学[M]. 北京:北京大学出版社,2005:327-337.
[11] Hebner G A,Killeen K P,Biefeld R M. In situ measurement of the metalorganic and hydride partial pressures in a MOCVD reactor using ultraviolet absorption spectroscopy[J]. Journal of Crystal Growth,1989,98(3):293-301.
[12] Hails J E,Irvine S J C. Screening of organotellurium compounds for use as MOVPE precursors[J]. Journal of Crystal Growth,1991,107(1):319-324.
[13] Johnson M C,Poochinda K,Ricker N L,et al. In situ monitoring and control of multicomponent gas-phase streams for growth of GaN via MOCVD[J]. Journal of Crystal Growth,2000,212(1):11-20.
[14] Woods V,Dietz N. InN growth by high-pressures chemical vapor deposition:Real-time optical growth characterization[J]. Materials Science and Engineering:B,2006,127(2):239-250.
[15] Karlicek R,Long J A,Donnelly V M. Thermal decomposition of metalorganic compounds used in the MOCVD of InP[J]. Journal of Crystal Growth,1984,68(1):123-127.
[16] McCrary V R,Donnelly V M. The ultraviolet absorpton spectra of selected organometallic compounds used in the chemical vapor deposition of gallium arsenide[J]. Journal of Crystal Growth,1987,84(2):253-258.
[17] Dietz N,Alevli M,Kang H,et al. The growth of InN and related alloys by high-pressure CVD[C]//Optics & Photonics 2005. International Society for Optics and Photonics , 2005 :59120E-59120E-8.
[18] Dietz N,Alevli M,Woods V,et al. The characterization of InN growth under high-pressure CVD conditions[J]. Physica Status Solidi (b),2005,242(15):2985-2994.
[19] Alexandrov S E,Kovalgin A Y,Krasovitskiy D M. A study of CVD of gallium nitride films by in situ gas-phase UV spectroscopy[J]. Le Journal de Physique IV,1995,5(C5):C5-183-C5-190.
[20] 李晖,左然. 化学气相沉积的过程监测[J]. 化工进展,2008,27(6):849-856.
[21] 杨海涛,郑兴,姚兰,等. 同位素标记法用于植物纤维中 LCC 蒸煮过程中结构变化的研究[J]. 化工学报,2013,64(3):1069-1075.
[22] Sywe B S,Schlup J R,Edgar J H. Fourier transform infrared spectroscopic study of predeposition reactions in metalloorganic chemical vapor deposition of gallium nitride[J]. Chemistry of Materials,1991,3(4):737-742.
[23] Mazzarese D,Tripathi A,Conner W C,et al. In situ FTIR and surface analysis of the reaction of trimethylgallium and ammonia[J]. Journal of Electronic Materials,1989,18(3):369-377.
[24] Creighton J R,Wang G T. Reversible adduct formation of trimethylgallium and trimethylindium with ammonia[J]. The Journal of Physical Chemistry A,2005,109(1):133-137.
[25] Creighton J R,Wang G T. Kinetics of metal organic-ammonia adduct decomposition:Implications for group-III nitride MOCVD[J]. The Journal of Physical Chemistry A,2005,109(46):10554-10562.
[26] Creighton J R,Wang G T,Breiland W G,et al. Nature of the parasitic chemistry during AlGaInN OMVPE[J]. Journal of Crystal Growth,2004,261(2):204-213.
[27] 陆大成,段树坤. 金属有机化合物气相外延基础及应用[M]. 北京:科学出版社,2009:45-47.
[28] McDanels D L. Analysis of stress-strain,fracture,and ductility behavior of aluminum matrix composites containing discontinuous silicon carbide reinforcement[J]. Metallurgical Transactions A,1985,16(6):1105-1115.
[29] Kamble M M,Waman V S,Ghosh S S,et al. High growth rate of a-SiC:H films using ethane carbon source by HW-CVD method[J]. Bulletin of Materials Science,2013,36(7):1177-1185.
[30] Basa D K,Smith F W. Annealing and crystallization processes in a hydrogenated amorphous Si Calloy film[J]. Thin Solid Films,1990,192(1):121-133.
[31] Sugiyama M,Kusunoki K,Shimogaki Y,et al. Kinetic studies on thermal decomposition of MOVPE sources using fourier transform infrared spectroscopy[J]. Applied Surface Science,1997,117:746-752.
[32] Kim S H,Kim H S,Hwang J S,et al. In situ FTIR analysis for the thermal decompositions of trimethylgallium and trimethylgallium- ammonia adduct[J]. Chemistry of Materials,1994,6(3):278-281.

