L-鸟氨酸发酵废菌渣水解固形物回用工艺的研究
耿晓玲,蔡 莉,王均华,王 朋(.江阴职业技术学院化学纺织工程系,江苏江阴443;.江阴市食品安全检测中心,江苏江阴443)
L-鸟氨酸发酵废菌渣水解固形物回用工艺的研究
耿晓玲1,蔡莉1,王均华2,王朋1
(1.江阴职业技术学院化学纺织工程系,江苏江阴214431;2.江阴市食品安全检测中心,江苏江阴214431)
摘要:以L-鸟氨酸发酵废菌渣水解固形物为有机氮源,进行L-鸟氨酸发酵工艺条件的研究,实验结果发现最佳回用工艺条件为:水解时间20 h,水解温度90.0℃,水解液加入量6.5 g/100 mL,6.0 mol/L硫酸溶液(mL)与含水废菌渣固形物(g)之比1∶2.5。在上述条件下,L-鸟氨酸产量达到了37.47 g/L,与酵母膏为有机氮源进行的鸟氨酸发酵差异不明显,且产量稳定。
关键词:L-鸟氨酸;废菌渣;正交试验;工艺条件
L-鸟氨酸作为一种医药、保健品以及化工产品的原料应用日趋广泛[1],美国研究发现L-鸟氨酸可以用作促进生长激素的分泌,以增强肌肉合成和提高基础代谢及预防肥胖[2],在欧洲鸟氨酸也作为膳食药物来销售,日本研究者发现L-鸟氨酸也可以作为食品类原料[3-4]。目前在国际市场上,L-鸟氨酸的绝大部分市场份额被日本占据,国内有少数几家生产,微生物发酵法生产L-鸟氨酸研究具有重大的经济意义和理论意义[5]。但是,国内发酵法生产鸟氨酸也面临着资源浪费和环境污染的严重问题[6]。在微生物发酵过程中,发酵末期的菌体不是目的产物,因此会产生大量的废菌渣固形物,其处理方法是将废菌渣固形物在污水处理厂中分解或是燃烧处理,这不仅污染环境、破坏生态,也造成了严重的资源和能源浪费[7-10]。本研究拟借鉴国内外的其它发酵行业的废菌渣固形物利用的经验,开发谷氨酸棒杆菌废菌丝体的综合回收利用工艺,以期能显著减少废液的排放量、节约资源、避免环境污染,为国内L-鸟氨酸工业化高效环保生产奠定基础,对促进国内发酵法生产L-鸟氨酸的产业化和医药行业的发展有重要的意义。
1 材料与设备
1.1菌种和废菌渣固形物
谷氨酸棒杆菌1006(Corynebacterium glutamicum 1006),用其进行L-鸟氨酸发酵,发酵后期收集废菌渣固形物以备用。
1.2主要仪器与试剂
葡萄糖、硫酸铵、七水合硫酸镁、碳酸钙、磷酸二氢钾、磷酸氢二钾等均为分析纯;酵母膏、蛋白胨、牛肉浸膏等均为生化试剂。
Cintra2020紫外-可见分光光度计:澳大利亚GBC公司;安捷伦1100高效液相色谱仪:美国安捷伦科技公司;AllTech 2000ES蒸发光散射检测器:美国GRACE公司;HR/T20MM立式高速冷冻离心机:湖南赫西仪器有限公司;HYG-Ⅱ型回转式恒温调速摇瓶柜:上海彦承实业有限公司;GZX-9140 MBE电热鼓风干燥箱:上海博迅实业有限公司;LRH-250A型生化培养箱:上海仪纯有限公司;SBA-40C型生物传感分析仪:山东省科学院生物研究所;LDZX-75KBS立式压力蒸汽灭菌锅:上海申安医疗器械。
1.3培养基
1.3.1保藏培养基
蛋白胨1.0 g/100 mL,牛肉膏0.5 g/100 mL,NaCl 0.5 g/100 mL,琼脂2.0,pH 7.00~7.20。
1.3.2活化培养基
葡萄糖0.1 g/100 mL,蛋白胨1.0 g/100 mL,牛肉膏0.5 g/100 mL,NaCl 0.5 g/100 mL,琼脂2.0 g/100 mL,pH 为7.00~7.20。
1.3.3种子培养基
葡萄糖2.5 g/100 mL,硫酸铵0.5 g/100 mL,硫酸镁0.3g/100mL,酵母膏0.5 g/100 mL,碳酸钙0.4 g/100 mL,少量磷酸盐和生长因子,pH为7.60~7.80。灭菌条件:121.0℃,保温10 min。
1.3.4发酵培养基
1.3.4.1以酵母膏为有机氮源
葡萄糖9.0 g/100 mL,硫酸铵2.5 g/100 mL,硫酸镁0.4 g/100 mL,酵母膏3.0 g/100 mL,碳酸钙1.0 g/100 mL,少量的无机磷酸盐和生长因子,pH为7.60~7.80。灭菌条件:121.0℃保温10 min。
1.3.4.2以废菌渣固形物水解液为有机氮源
葡萄糖9.0 g/100 mL,硫酸铵2.5 g/100 mL,硫酸镁0.4 g/100 mL,废菌渣固形物水解液6.5 g/100 mL,碳酸钙1.0 g/100 mL,少量的无机磷酸盐和生长因子,pH为7.60~7.80。灭菌条件:121.0℃保温10 min。
2 方法
2.1指标测定方法
2.1.1发酵液OD值的测定
鸟氨酸发酵液中含碳酸钙,用一定浓度的HCl溶液溶解碳酸钙,将发酵液稀释一定倍数,在660 nm波长下测吸光度OD值。
2.1.2L-鸟氨酸含量的测定
采用HPLC-ELSD法定量测定L-鸟氨酸的含量。色谱柱为Prevail C18(250 mm×4.6 mm i.d.,5 μm),流动相为0.14%三氟乙酸(含0.06%七氟丁酸)溶液-乙腈溶液(88∶22)。在流动相流量为0.8 mL/min,气体流量为2.8 mL/min,ELSD检测器漂移管温度为110℃,进样量为20 μL的色谱条件下,将不同浓度的L-鸟氨酸盐酸盐标准溶液进样,以峰面积为横坐标,L-鸟氨酸盐酸盐浓度为纵坐标,制作标准曲线,得到回归方程C=1.382 64×10-7A+0.059 37(r=0.999 7)。利用外标法,将样品的峰面积代入回归方程中,即可求得样品中L-鸟氨酸盐酸盐的浓度。
2.1.3残糖量的测定
采用SBA-40C型生物传感分析仪测定残糖。2.2废菌渣固形物的水解方法及条件的确定
本试验采用硫酸水解法进行废菌渣固形物的水解。经单因素水解试验,选择合适的酸浓度、废菌渣固形物的比例及温度3个因素,设计L9(34)正交试验,试验设计如表1所示。

表1 正交试验设计Table 1 Orthogonal test
2.3废菌渣固形物水解时间对L-鸟氨酸发酵的影响
用硫酸溶液直接水解含水废菌渣固形物,水解时间不同菌体的水解程度也不同,取一定废菌渣固形物在一定的水解条件下分别水解不同时间,然后用于发酵并检测发酵产物量,以确定最佳水解时间。
2.4调废菌渣固形物水解液pH的方式对L-鸟氨酸发酵的影响
废酵母水解液新鲜制取时,pH较低,要用较多的碱性物质进行调pH。本试验分别采用CaO、NaOH、NH3· H2O对废菌渣固形物水解液回调pH至7.60~7.80。按摇瓶发酵培养基配方,进行发酵并考察试验结果。
2.5添加废菌渣固形物水解液含量的确定
在一定的发酵培养基上依次加不同量的硫酸废菌渣固形物水解液代替购买的硫酸水解的酵母水解液进行发酵试验,并检测试验结果。
2.6连续回用废菌渣固形物水解液进行L-鸟氨酸发酵的分析
以废菌渣固形物水解液为有机氮源的培养基进行一定批数摇瓶发酵,并检测试验结果。考察L-鸟氨酸发酵产物量稳定性。
3 结果与分析
3.1水解废菌渣固形物条件的确定
若是将废酵母先烘干再进行加酸进行水解废酵母,不仅工序繁多,而且造成能源浪费。根据表1中的试验设计对废菌渣固形物直接水解试验,结果如表2。
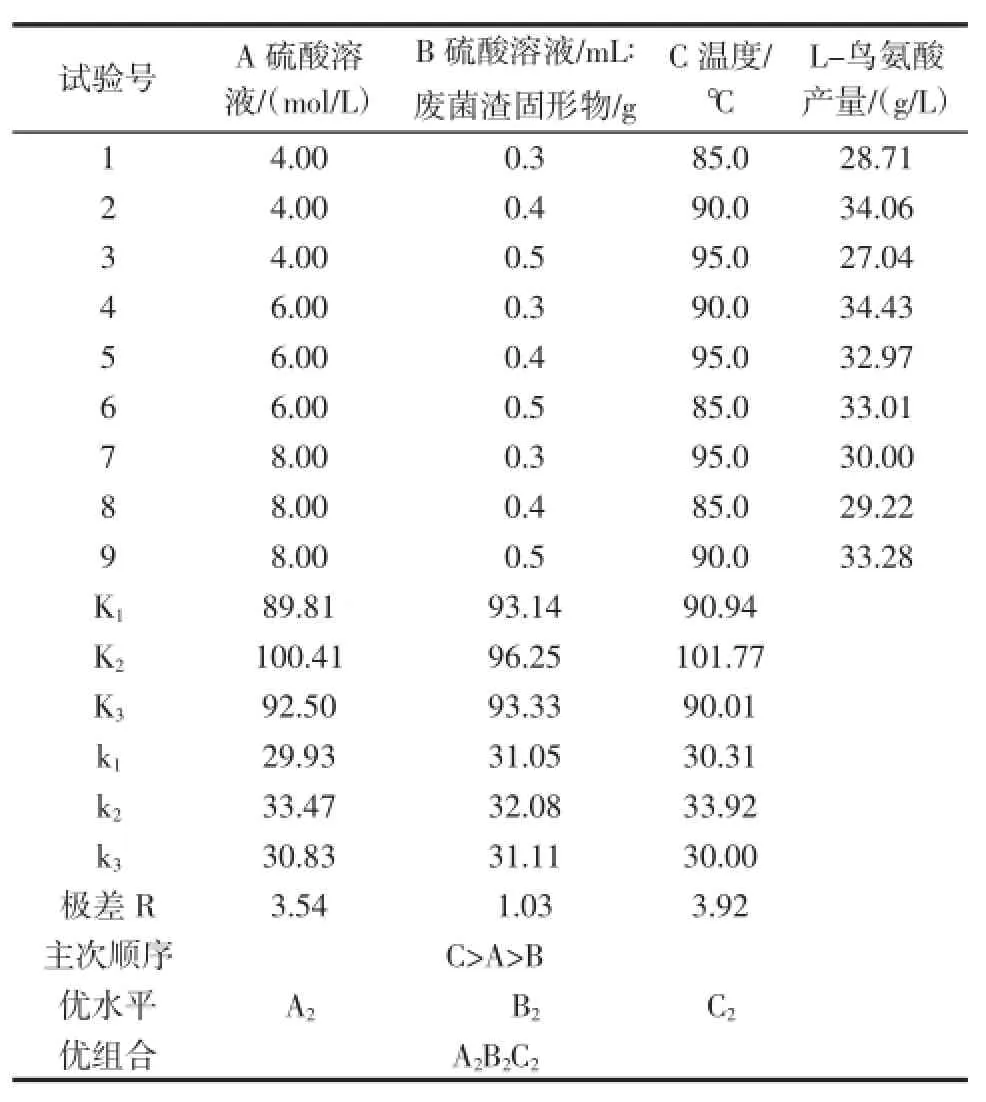
表2 正交试验结果及分析Table 2 The orthogonal experiment results and analysis
运用极差分析法对试验结果进行分析,从表2可以看出,水解废菌渣固形物最佳条件为:水解温度为90.0℃,6.0 mol/L硫酸溶液(mL):废菌渣固形物(g)为1∶2.5。
3.2废菌渣固形物水解时间对L-鸟氨酸发酵影响的确定
通过正交试验确定了废菌渣固形物水解的主要条件,本试验中采用硫酸溶液直接水解含水菌体,水解时间对L-鸟氨酸发酵也有一定的影响,在水解温度为90.0℃,6.0 mol/L硫酸溶液(mL):废菌渣固形物(g)为1∶2.5的条件下对湿菌体进行水解,在水解时间为10、15、20、25、30、35 h进行取样,并按1.3.4.2以废菌渣固形物水解液为有机氮源的配方分别用于发酵,另外按1.3.4.1以酵母膏为有机氮源设置对照组,并检测发酵情况,以确定最佳水解时间。结果见表3。
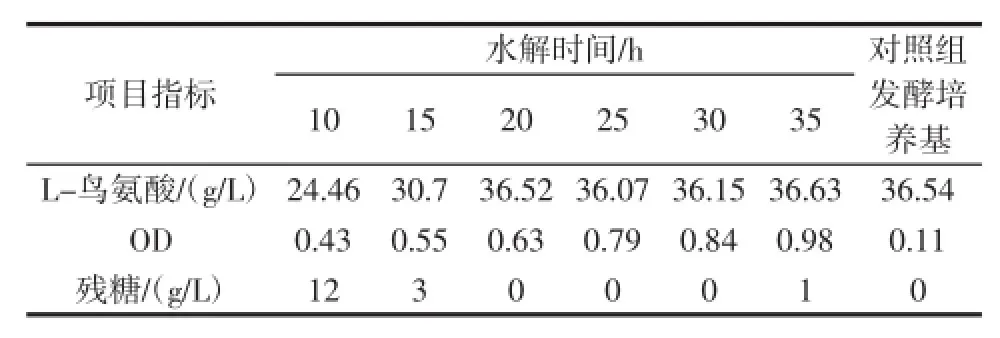
表3 水解时间对L-鸟氨酸发酵的影响Table 3 Effects of hydrolysis time on the fermentation of ornithine
由表3可知,当水解时间超过20 h,L-鸟氨酸产量接近对照组,低于20 h水解的不彻底,L-鸟氨酸产量不高,随着水解时间的延长,对L-鸟氨酸发酵影响不大,为了确保水解的充分性,水解时间安排在20 h为最佳。
3.3pH调节方式对L-鸟氨酸发酵的影响
按3.1方法制取的新鲜废菌渣固形物水解液,pH较低,要用碱性物质调pH。本试验分别采用了CaO、NaOH、NH3·H2O对废菌渣固形物水解液回调pH至7.60~7.80。进行发酵的试验结果如表4所示。

表4 调pH的方式对L-鸟氨酸发酵的影响Table 4 Effects of the methods of controlling pH on thefermentation of ornithine
可以看出,用氨水回调pH得到的L-鸟氨酸含量最高为36.87 g/L,可能是用其它两种物质回调pH,带来了大量的Na+和Ca2+,Na+较多,会对钠、钾ATP酶系统造成影响,而ATP水解直接偶联L-鸟氨酸的运输,虽然CaSO4微溶于水,但是Ca2+可以和磷酸盐和磷酸氢盐反应生成沉淀,在中性和碱性条件下尤为如此,这样就会引起磷酸盐的降低。
故可知废菌渣固形物水解液制备的工艺为温度为90.0℃、6.0 mol/L硫酸溶液(mL):废菌渣固形物(g)为1∶2.5、水解时间为20 h,将制取的水解液用氨水调解pH调至7.60~7.80。
3.4添加废菌渣固形物水解液含量的确定
L-鸟氨酸发酵水平的高低和废菌渣固形物水解液用量之间存在着密切关系,即L-鸟氨酸的产量会随着废菌渣固形物水解液的浓度发生改变。添加废菌渣固形物水解液含量的梯度试验对于确定添加废菌渣固形物水解液的最佳含量十分必要。按1.3.4.2以废菌渣固形物水解液为有机氮源的配方在100 mL的发酵培养基上依次用3.5、5.0、6.5、8.0、9.5 g硫酸废菌渣固形物水解液为有机氮源,以酵母膏为有机氮源设置对照组,检测发酵结果,试验结果如表5所示。

表5 废菌渣固形物水解液含量对L-鸟氨酸发酵的影响Table 5 Effects of the hydrolysate content of the fermentation residues
从表5可以看出发酵液OD值随废菌渣固形物水解液的增加而递增,当发酵培养基中含废菌渣固形物水解液6.5 g/100 mL,L-鸟氨酸产量最高,达到了37.47 g/L,说明了用自制废菌渣固形物水解液取代发酵培养基中的酵母膏是成功的,试验结果超过了对照组发酵培养基的水平,可能是因为废菌渣固形物水解成水解液之后,没有经过较大的后续处理,直接当作有机氮源使用,其营养成分比经过后续处理的酵母膏丰富所致。
3.5连续回用废菌渣固形物水解液进行L-鸟氨酸发酵的研究
第1批按1.3.4.1以酵母膏为有机氮源的发酵培养基配方进行摇瓶发酵,氨水调节初始pH至7.6~7.8,按5%接种量将种子液接入装有50mL的发酵培养基的500 mL三角瓶中,8层纱布封口,置于旋转式摇床上(220 r/min),30℃振荡培养72 h。检测发酵过程中最大OD及72 h鸟氨酸产量,发酵后期收集废菌渣固形物,制备成具体水解液后,按6.5 g/100 mL废菌渣固形物水解液量加到发酵液中,其他按第1批发酵情况进行第2批发酵,以此类推连续进行到第8批发酵,分别检测每批发酵过程中最大OD及72 h鸟氨酸产量。以发酵批数为横坐标,以每批发酵过程中最大OD及72 h鸟氨酸产量为纵坐标绘图。绘制结果如图1所示。
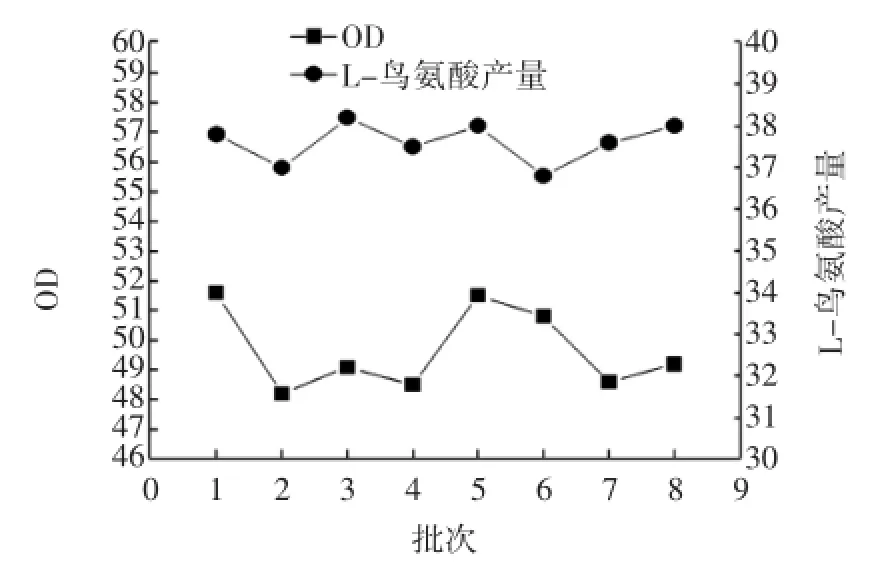
图1 不同批次发酵过程中最大OD及L-鸟氨酸产量Fig.1 Maximum OD and production of L-ornithine in different batches of fermentation
由图1所示可知用水解温度为90.0℃,6.0 mol/L硫酸溶液(mL):废菌渣固形物(g)为1∶2.5,水解时间20 h以上,废菌渣固形物水解液加入量为6.5 g/100 mL的条件进行发酵,由多批次发酵过程中最大OD值和L-鸟氨酸产量表明菌体生物量稳定,鸟氨酸产量稳定,表明该工艺可行。
4 总结
本文主要研究了L-鸟氨酸发酵废菌渣固形物水解液的制备工艺,并将其回用于L-鸟氨酸的发酵工艺上,得出如下结论:
1)通过正交试验法和单因素试验法,对直接利用含水废菌渣固形物制取废菌渣固形物水解液的操作参数进行优化,并确定了废菌渣固形物水解液替代酵母膏的最佳用量、水解废菌渣固形物的时间和调pH的最佳方式,达到用酵母膏时的产酸水平。得到L-鸟氨酸发酵废菌渣固形物水解液回用工艺最佳条件为:水解温度为90.0℃、6.0 mol/L硫酸溶液(mL)与含水废菌渣固形物(g)之比为1∶2.5、水解液加入量为6.5 g/100 mL。
2)通过连续回用废菌渣固形物水解液进行L-鸟氨酸发酵,其L-鸟氨酸产量稳定。
3)分别以酵母膏为有机氮源和以废菌渣固形物水解液为有机氮源的发酵培养基检测,L-鸟氨酸产量相差无几,完全可以用废菌渣固形物水解液代替酵母膏进行鸟氨酸发酵生产。
参考文献:
[1]Yun-JeongYang,Hwang Sung-Ho,Sang-Mok Lee.Continuous cultivation of L actobaci l lus rhamnosus with cell recycling using an acoustic cell settler[J].Biotechnology Bioprocess Engineering,2002, 7(6):357-361
[2]Roca C,Olsson L.Increasing ethanol productivity during xylosefermentation by cell recycling of recombinant S accharomyces cer2evisiae[J].Appl Microbiol Biotechnol,2003,60(5):560-563
[3]张炳荣.氨基酸工业大全[M].北京:中国轻工业出版社,1991
[4]Brocker P.A two-centre,randomized,double-blind trial of ornithine oxoglutarate in 194 elderly,ambulatory,convalescent subjects[J].Age and Ageing,1994,23(4):303-306
[5]Elam R P.Effects of arginine and ornithine on strength,lean body mass and urinary hydroxyproline in adult males[J].Sports Med Phys Fitness,1989,29(2):52-56
[6]Suminski R R.Acute effect of amino acid ingestion and resistance exercise on plasma growth hormone concentration in young men[J]. Int J Sport Nutr,1997,34(7):48-60
[7]De Bandt J P,Coudray-Lucas C,Lioret N,et al.A randomized controlled trial of the influence of the mode of enteral ornithine alphaketoglutarate administration in burn patients[J].Nutr,1998,128(9): 563-569
[8]王树庆,陈宁,张克旭,等.微生物发酵法生产鸟氨酸[J].四川食品与发酵,1998(S1):14-17
[9]胡学智.具有广泛保健功能的L-鸟氨酸[J].食品工业,2006(1):48-49
[10]孙金杰,郝英利,周文瑜,等.2-3-丁二醇发酵过程的菌体生物质回收利用初步研究[J].化学与生物工程,2010,27(7):73-76
DOI:10.3969/j.issn.1005-6521.2015.20.025
收稿日期:2015-08-05
作者简介:耿晓玲(1981—),女(汉),讲师,硕士,研究方向:食品工程、食品安全。
Study on Reuse Process of Hydrolysis Solids of L-ornithine Fermentation Residues
GENG Xiao-ling1,CAI Li1,WANG Jun-hua2,WANG Peng1
(1.Department of Chemical and Textile Engineering,Jiangyin Polytechnic College,Jiangyin 214431,Jiangsu,China;2.Food Safety Testing Center of Jiangyin District,Jiangyin 214431,Jiangsu,China)
Abstract:Hydrolysis solids of L-ornithine fermentation residues were used as the organic nitrogen source to study the production of L-ornithine by fermentation.The optimized conditions of reuse process were as follows:hydrolysis time 20 h,hydrolysis temperature 90.0℃,hydrolysate 6.5 g/100 mL,the ratio was 1∶2.5 of 6.0 mol/L H2SO4solution(mL):fungi residues solids containing water(g).Finally,37.47 g/L of L-ornithine was obtained under these conditions,which was no difference compared with the control group.The yield of the L-ornithine obtained from the continuous reuse process was stable.
Key words:L-ornithine;fermentation residues;orthogonal array design;process conditions

