“探究铁及其化合物的氧化性和还原性”课堂实录
刘永梅
【新课导入】ppt播放血常规检验报告单
缺铁性贫血是因为人体缺少铁元素还铁的某种形式?带着这个问题走进我们今天的课题:铁及其化合物的氧化性或还原性。
【提问】根据预习案的完成,我们知道铁有变价,0、+2、+3价,铁的化合物比较
丰富,我们不可能每种都去研究,今天我们以典型代表物:铁单质、氯化亚铁、氯化铁为例,来探究铁及其化合物的性质。
一、【理论分析】
请利用氧化还原反应有关知识来预测铁单质、氯化亚铁、氯化铁所具有的性质。
【学生】讨论、小组代表回答、评价。预测结果:
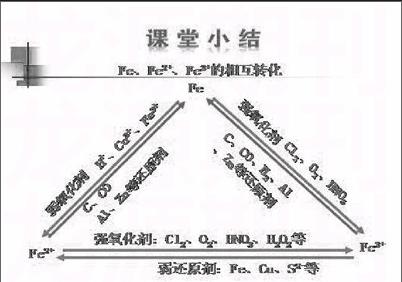
具有还原性物质:铁;
具有氧化性的物质:三氯化铁;
既有氧化性又有还原性的物质:氯化亚铁。
【想一想】如何证明某物质具有氧化性或还原性?
【方法导引】如果预测某物质具有氧化性(或还原性),就应该寻找具有还原性(或氧化性)的另一物质,通过实验证实两者能发生氧化还原反应。
二、【实验探究】
下面请同学们根据老师提供的实验试剂来设计合理的方案。ppt展示实验试剂:
铁粉、 盐酸、FeCl3溶液、FeCl2溶液、 稀硝酸、 锌片、 KSCN溶液(硫氰酸钾)
教师强调学生分工:药品较多,可设计的实验方案也较多,时间有限,一堂课的时间,我们只能采取合作学习,我们不可能把每个实验让每一个学生都亲身经历过。这样我们呢,每个组只设计一个方案,注意每个组任务不同,第一组同学,你们设计证明单质铁具有还原性,二、三组同学设计证明二价铁具有还原性,四、五组同学设计证明二价铁具有氧化性,六、七组同学设计证明三价铁具有氧化性,任务明确,好,现在开始,时间三分钟。
【学生】明确任务,迅速进入白热化讨论、设计实验方案。
【教师适当指导】
【教师强调】 时间到, 相信每个组现在都有了自己的方案,下面请每个组把你们的方案拿出来给大家共享一下。注意,请大家保持安静,认真倾听对方组的设计,因为你只设计了其中的一部分,另外大部分的经验你只能通过间接经验获得,所以当你的同学起来回答问题的时候,请你认真倾听,尊重同学。 无论哪位同学介绍你们的方案,请先介绍你们的设计目的,试管里加入什么试剂,预测将会出现什么现象则可以证明你们的预测。 好现在开始。
【学生】展示实验方案,学生相互评价、论证,确定合理方案。
第一组学生代表:我们设计证明铁单质具有还原性,在试管内加入铁粉,再加入适量稀盐酸,出现气泡,溶液颜色变为浅绿色,说明单质铁变为二价铁,证明铁单质具有还原性。
二、三组同学:
学生代表:我们要证明二价铁具有还原性,首先向一支干净的试管里加入2ml的氯化亚铁溶液,加入几滴硫氰酸钾溶液,无明显变化,再加入稀硝酸,溶液变为血红色。则证明二价铁具有还原性。
四、五组
学生代表:我们要证明二价铁具有氧化性,在FeCl2溶液中加入锌片,会析出铁,同时溶液颜色变得更浅甚至褪色。
六、七组
学生代表:我们要证明三价铁具有氧化性,我们选择在FeCl3溶液中先加入硫氰酸钾,溶液出现血红色,然后加入还原性铁粉,,血红色褪去。说明三价铁变为二价铁,证明三价铁具有氧化性。
【过渡】
我们的方案已经经过大家的集体评价、修正。下一步实施方案,实验验证我们的预测。ppt展示实验表格:学生操作,教师提示:实验试剂一般取1-2ml,滴加试剂出现明显现象就好,不要滴加过多,节约也是一种美德啊!
三、【实验实施】依据设计好的实验方案,并参照导学案,完成实验,并且准确及时记录有关实验现象,分析现象,得出结论
1.Fe的还原性
(1)铁与非氧化性酸反应:Fe+H2SO4=FeSO4+H2↑
(2)铁与硫酸铜溶液的反应:Fe+CuSO4=FeSO4+Cu
2.FeCl3的氧化性
FeCl3与还原性铁粉反应:2Fe3++Fe=3Fe2+
3.FeCl2的还原性:2Fe2++Cl2=2Fe3++2Cl-
4.FeCl2的氧化性:Zn+Fe2+=Zn2++Fe
【小结】
四、【迁移应用】
1.解答课堂开始疑惑:人体缺少二价铁容易患缺铁性贫血,建议学生平衡膳食。
2.解释FeCl2溶液的保存通常加入铁粉的原因。
3.学生写出利用FeCl3溶液腐蚀铜箔制造印刷线路板的离子方程式。
(作者单位:榆林市苏州中学)

