TNF—α预处理脐血间充质干细胞移植心肌梗死大鼠心功能影响
樊志刚 刘芳

[摘 要] 目的:研究肿瘤坏死因子(TNF-α)预处理的脐血间充质干细胞(HUMSC)血管细胞黏附分子-1的表达及其对心肌梗死大鼠心功能的影响。方法:实验组取第3代HUMSC用TNF-α(10 ng/mL)预处理24 h后,迁移黏附实验检测其体外迁移黏附能力,Western blot检测VCAM-1蛋白表达;对照组不用TNF-α处理。动物实验分为实验组(注射TNF-α预处理HUMSC)和对照组(注射HUMSC),取第3代HUMSC移植于心肌梗死大鼠的心肌内3周后,二维超声心动图检测大鼠左心室心功能。结果:与对照组比较,实验组体外迁移黏附力明显增强(P<0.05);黏附分子VCAM-1的蛋白表达水平显著升高(P<0.05);左心室射血分数明显提高(P<0.05)。结论:移植TNF-α预处理的HUMSC更能明显改善大鼠心功能,其机制可能与TNF-α提高HUMSC黏附分子VCAM-1的蛋白表达水平相关。
[关键词] 肿瘤坏死因子-α;脐血间充质干细胞;黏附分子
中图分类号: R332 文献标识码: A 文章编号:2095-5200(2015)04-004-05
每年全球约有1700万人死于心血管病,其中占总数1/2患者死于急性心肌梗死(AMI)[1]。过去30年中,MI病死率(30 d内)虽然已降至10% ,但年病死率仍为20% 左右[2]。目前,MI治疗方法以药物、介入和外科手术为主,这些方法可解除血管阻塞,缓解心室重构,延缓和改善心功能恶化及心律失常发生,但无法逆转坏死心肌,使已梗死心肌细胞再生。而干细胞治疗给人们带来了新希望。
MSC具有多向分化潜能、支持和促进造血干细胞植入、调节免疫以及分离、培养时操作简便等特点[3]。脐血间充质干细胞(Human Umbilical cord blood mesenchymal stem cells,HUMSC)是从脐带组织中分离出来,较祖细胞更原始,有更强增殖分化能力[4];免疫原性较为幼稚,不易触发免疫反应或引起移植物抗宿主病;较骨髓MSC有更大应用潜能。
循环血液中干细胞归巢到缺血组织中是组织修复第一步,干细胞归巢第一步就是黏附于心脏微血管内皮细胞[5],因此提高移植干细胞向受损组织迁移及定植对提高干细胞治疗效果具有重要价值。黏附分子广泛存在于细胞表面及细胞外基质中,通过与受体结合,介导细胞与细胞或细胞与细胞外基质接触,并参与细胞活化与迁移[6]。在炎症、缺血性损伤及伤口愈合等过程中发挥重要作用。生理状态下充质干细胞少量表达血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1),而明显表达细胞间黏附分子(intercellular adhesion molecule-1,ICAM)[7]。Segers等[8] 研究发现,VCAM-1对BMMSCs黏附于心肌微血管内皮细胞具有重要作用,在加入VCAM-1抗体后可完全消除由肿瘤坏死因子 (tumor necrosisfactor,TNF-α)预处理增强MSC对内皮细胞黏附性,而加入ICAM-1抗体则MSC对内皮细胞黏附能力却没有明显变化。所以本研究用采用TNF-α预处理HUMSC,通过迁移黏附能力、VCAM-1表达和左心室功能变化等检测指标,探讨其对心肌梗死大鼠治疗作用。
1 材料与方法
1.1 实验动物
雄性SD大鼠20只,清洁级,220~250 g用于心肌梗死造模,购自河南省实验动物中心,实验中对动物处置符合动物伦理学要求。
1.2 主要试剂和仪器
L-DMEM、胎牛血清(fetalbovine serum,FBS)购自美国Hyclone公司;0.25%胰酶、SDS-PAGE凝胶试剂盒购自上海碧云天生物技术有限公司;TNF-α购自美国Peprotech公司;PVDF膜购自美国Sigma公司;VCAM-1一抗购自美国Bioworld公司;β-actin、二抗购自北京中杉金桥生物技术有限公司;倒置显微镜Olympus BX41购自日本Olympus公司;二维多普勒超声仪购自美国Phillips公司。
1.3 脐血间充质干细胞分离和培养
脐血来自于郑州市妇幼保健医院产妇志愿捐献足月妊娠顺产婴儿,参照文献[9]采用密度梯度离心法获取HUMSC,将分离细胞以5×106/mL接种于含体积分数为20%胎牛血清DMEM/F12培养液中培养。取第3代细胞用于后续实验。
1.4 细胞鉴定
将第3代HUMSC调整为1×106 /L 细胞悬液,用流式细胞仪进行细胞表面标志测定。细胞分别与鼠抗人FITC-CD90、PE-CD86、FlTC-CD45,PE-CD19、FITC-CD105、PE-HLA-DR、FITC-HLA-ABC和PE-CD34抗体反应,在4℃暗室中放置30min。以鼠抗人PE/FITC-IgG1为平行对照。数据用Cell Quest软件处理。
1.5 体外迁移实验
将第3代HUMSC浓度调整为5×106/mL,取100 μL细胞悬液接种于8 μm孔径24孔transwell小室上层,下层加入500μL含2%FBSL-DMEM培养基,实验组下层培养液中加入TNF-α使得其终浓度为10 ng/mL,对照组加入等体积PBS,置于细胞培养箱中继续培养。24 h后取出小室,用荧光倒置显微镜下观察并随即选取6个视野拍照后计数迁移至膜下表面细胞数目。
1.6 体外黏附实验
将第3代HUMSC长至80%融合时,实验组加入TNF-α(10 ng/mL)处理,培养24 h后,调整细胞浓度为1×106/mL,取1 mL细胞悬液经1200 r/min离心3min后重悬于250μLL-DMED中,然后接种于胶原包被24孔板,静置15 min后,用PBS洗两遍,去除未贴壁干细胞。显微镜下随机选取6个视野拍照后计数。
1.7 Western blot检测黏附分子蛋白表达
实验组加入TNF-α(10 ng/mL)处理,培养24 h后,调整细胞浓度为1×106/mL,加入上样缓冲液后100℃水浴变性5 min,10SDS-PAGE电泳,转移至PVDF膜上。封闭液封闭2 h,加一抗孵育12h,HRP标记二抗孵育2 h。洗膜后将增强化学发光液(ECL)涂于PVDF膜上,曝光并采集图像。Ge1-Pro analyzer 4软件分析蛋白条带,以β-actin表达量作为参照。
1.8 大鼠心肌梗死模型制备和细胞移植
麻醉大鼠后,接心电监护、气管插管并接上小动物呼吸肌,于心前区肋间隙进入胸腔并刺破心包,在与左心耳交界处下方0.2cm处缝扎左前降支动脉,可见心电监护ST段显著抬高。术后关胸常规肌注30万U青霉素,心肌梗死模型复制成功后1周,大鼠随机分为对照组和实验组各10只。对照组大鼠梗死局部心肌内注射HUMSC100μL(1×105个),实验组大鼠梗死局部心肌内注射第3代TNF-α预处理HUMSC100μL(1×105个),所有动物随后关胸并给予抗生素处理。
1.9 超声心动图检测大鼠心功能
移植后3周,大鼠麻醉后固定于鼠板上,二维多普勒超声仪检测大鼠左心室舒张末内径(left ventricular end-diastolic dimension,LVEd)、左心室收缩末内径(left ventricular end- systolic dimension,LVDs),按照公式:LVEF=[( LVDd)3-( LVDs)3]/ ( LVDd)3×100%计算射血分数(left ventricular ejection fraction,LVEF)。
1.10 统计学处理
采用GrahPad Prism 5.0统计软件进行分析,数据以x±s表示,两组间比较用t检验,a=0.05。
2 结果
2.1 脐血间充质干细胞分离培养
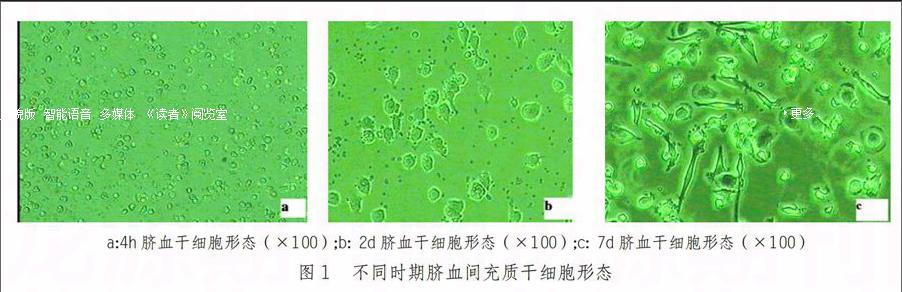
倒置显微镜下可见,培养初期胞体小且呈圆形(图1A),2d以后逐渐变为椭圆、胞体变大(图1B),7d(第3代)后向两级伸出凸起为长梭形(图1C)。
2.2 细胞检测结果
流式细胞仪检测结果显示CD34、CD45阳性率不足10%,提示大部分人脐带间充质干细胞不是造血干细胞。CD19和CD86阳性率少于10%,CD90、CD105阳性率高于70%,主要组织相容性复合体HLA-ABC阳性率为90% 以上,HLA-DR阳性率低于5%,结果提示人脐带间充质干细胞和间充质干细胞细胞表型相似。
2.3 体外迁移能力
结果表明与TNF-α共培养24h后,TNF-α处理组从小室表面迁移到小室下表面细胞数目(26.4±2.8)明显多于PBS组(6.9±1.7),差异有统计学意义(P<0.05)。说明TNF-α可以增强干细胞体外迁移能力。(见图2a/b)
2.4 体外黏附能力
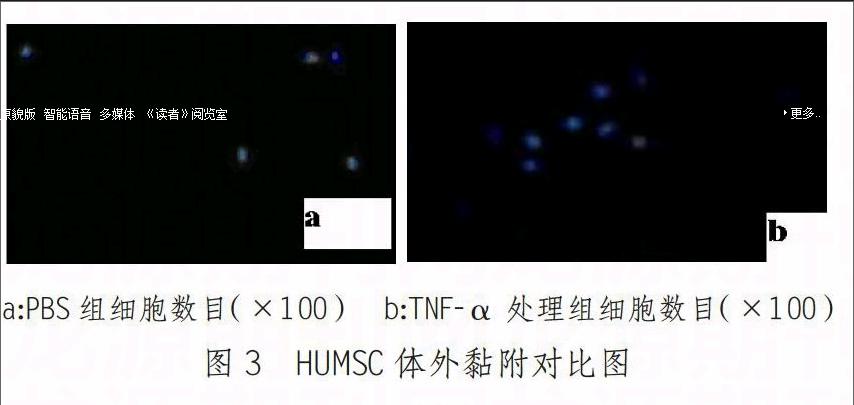
结果表明与TNF-α共培养24h后,TNF-α处理组黏附于培养板细胞数目(41.2±3.6)明显高于PBS组(7.8±1.3),差异有统计学意义(P<0.05)。说明TNF-α可以显著增强干细胞黏附能力。(见图3a/b)
2.5 黏附分子VCAM-1表达
用Western blot法检测转移至膜上蛋白含量,结果表明,PBS组VCAM-1表达较低,TNF-α处理组能显著诱导VCAM-1蛋白合成,约为对照组3倍,两组间差异具有统计意义(见图4)。
2.6 TNF-α预处理HUMSC对大鼠心功能影响
移植后3周,对照组(HUMSC)有2只大鼠死亡,实验组(TNF-α预处理HUMSC)有1只大鼠死亡。LVDd、LVDs、LVEF结果见表1,多普勒超声心动图结果显示,实验组LVEF明显高于对照组(P<0.05)。说明经TNF-α预处理HUMSC移植可以明显改善心功能。
3 讨论
MSC具有较强扩增能力,可分化成心肌样细胞和有助于血管形成血管平滑肌细胞以及血管内皮细胞,能参与心肌缺血引起心肌重构和血管再生,达到替代损伤心肌细胞,改善心功能目[10]。由于MSC缺少主要组织相容性复合体II ,可参与免疫调控但具免疫豁免性,增强了异体细胞移植安全性,因此最有可能发展成标准化治疗,从而满足大部分人治疗需求[11]。很多研究者认为,干细胞可能是通过旁分泌而不是替代梗死心肌来发挥改善心功能作用[12-13],目前已发现多种干细胞因子以旁分泌产生作用[14-15]。
脐血中含有丰富间充质干细胞[16],是近年发现具有与骨髓干细胞细胞(BMMSC)相同多向分化潜能原始祖细胞,和其他来源干细胞相比,脐血来源广泛,脐血中淋巴细胞免疫功能不够成熟,免疫原性较弱,移植物抗宿主病发生率较低[17-18];HUMSC易于分离[19-20]为一种新可靠干细胞来源,在适当条件下具有向神经细胞、成骨细胞、心肌细胞等组织细胞多项分化潜能[21]。
目前,已有多种干细胞应用于MI临床治疗研究[22-23],但HUMSC移植治疗MI还比较少。干细胞移植治疗主要困难之一是移植干细胞只有很少一部分能存活和植入心肌中。所以如何提高干细胞移植存活率成为研究者首当其冲问题。Luo 等[24-25]研究发现在梗死区边缘区注入高表达血管内皮生长因子(vascular endothelial growth factor,VEGF)干细胞,可以减少梗死区面积,增加梗死区周围心肌血管生成,促进冠脉结扎实验中心脏功能恢复。Ries 等[26]研究发现提高BMMSC基质金属酶表达,可以促进细胞趋化和迁移。
心肌梗死后会释放大量炎症介质,这些介质一方面可以促进组织修复和增强心肌对缺血适应,但另一方面这些介质也可以促进心肌细胞凋亡和加快基质降解进而抑制和减低心功能[27-29]。以前研究重视干细胞移植后如何降低炎症因子表达,但新近有研究[30-32]证实用炎症因子处理过干细胞移植能明显改善心功能,促进心肌功能恢复。Herrmann等[33]研究发现,用TGF-a预处理24h BMMSC移植可以增加VEGF表达,进一步保护大鼠心肌和减少坏死区域面积。
本研究之所以选择TNF-α浓度为10 ng/mL是因为这一浓度刺激可以激活干细胞旁分泌而不改变其表面活性物质[34]。有研究[35]显示移植MSC可以促进梗死区炎性因子如TNF-α、白介素-6和转化生长因子等释放,这些因子又对细胞旁分泌起重要作用。因此研究移植后干细胞对炎性环境应答对提高其存活率和改善心功能有更重要价值。
参 考 文 献
[1] Psaltis PJ,Zannettino AC,Worthley SG,et a1.Concise review:mesenchymal stromal cells:potential for cardiovascular repair.Stem Ceils[J].2008,26(1):2201-2210.
[2] Przybyt E,Harmsen MC.Mesenchymal stem cells:promising for m yocardial regeneration Curr Stem Cell Res Ther[J].2013,8(2):270-277.
[3] Ballard VI .Stem ceils for heart failure in the aging heart[J].Hear Fail Rev,20l0,15(1):447-456.
[4] Hodgkinsol CP,Gomez JA,Mrotsou M,et a1.Genetic engineering of mesenchymal stem cells and its application in human disease therapy[J].Hum Gene Ther,2010,21(2):1513-1526.
[5] Hodgkinson CP,Gomez JA,Rotsou M.Genetic engineering of mesenchymal stem cells and its application in human disease therapy[J].Hum Gene Ther,2010,21(2):1513-1526.
[6] Miettinen JA,Salonen RJ,Ylitalo K,et a1.The effect of bone marrow microenvironment on the functional properties of thetherapeutic bone marrow derived cells in patients with acute myocardial infarction[J].J Transl Med,2012,10(1):66.
[7] Hyun Y M ,Chung H L,McGrath J L,et a1.Activated integrin VLA 4 localizes to the lamellipodia and mediates T cell migrationon VCAM-1[J].J Immunol,2009,183(1):359-369.
[8] Segers V F,Van-Riet Andries LJ, et al.Mesenchymal stem cell adhesion to cardiac microvascular endothelium:activators and mechanisms[J].Am J Physiol Heart Circ Physiol,2006,290(4):1370-7.
[9] Pucilowska J,Puzerey PA,Karlo JC,et a1.Disrupted erk signaling during cortical development leads to abnormal progenitor proliferation, neuronal and network excitability and behavior, modeling human neuro-cardio-facial-cutaneous and related syndromes.[J]. J Neurosci,2012,32(25):8663-8677.
[10] Herrmann JL,Abarbanell AM,Weil BR,et a1.Optizing stem cell function for the treatment of ischemic heart disease[J].Surg Res,2011,166:138-145.
[11] Hoover Plow J,Gong Y.Challenges for heart disease stem cell therapy[J].Vasc Health Risk Manag,2012,8(2):99 -113.
[12] Ballard VL.Stem cells for heart failure in the aging heart[J].Heart Fail Rev,2010,l5(1):447-456.
[13] Wen J,Zhang JQ,Wei H,et a1.SDF 1q and CXCR4 as therapeutic targets in cardiovascular disease[J].Am J Cardiovasc Dis,2012,2(2):20-28.
[14] Fedak PW.Paracrine effects of cell transplantati0n: modifying ventricular rem odeling in the failing heart[J].Sen Thorac Cardiovase Surg,2008,20(1):87-93.
[15] Herrmann JL,Abarbanell AM,Weil BR,et a1.Optizing stem cell function for the treatment of ischemic heart disease[J].J Surg Res,2011,166(3):138-145.
[16] Biuqstud K B, Tenq Y G,Redmond D E,et a1.Human neural stem cells migrate along the nigrotriata1 pathway in a primatemodel of Parkinsons disease[J].ExpNeurol,2008,211(2):362-369.
[17] Sanders RD,Xu J,Shu Y,et a1. Dexmedetomidine attenuates isoflurane—induced neurocoguitive impairment in neonatal rats [J].Anesthesiology,2009,110(5):1077-1085.
[18] Sande RD,Sun P,Pate1 S,et a1. Dexmedetomidine provides cortical neuroprotection: impact on anaesthetic‐induced neuroapoptosis in the rat developing brain[J].Acta Anaesthesiol Scand, 2010,54(6):710-716.
[19] Pucilowska J,Puzerey PA,Karlo JC,et a1.Disrupted erk signaling during cortical development leads to abnormal progenitor proliferation, neuronal and network excitability and behavior, modeling human neuro-cardio-facial-cutaneous and related syndromes.[J]. J Neurosci,2012,32(25):8663-8677.
[20] Biuqstud K B,Tenq Y G,Redmond D E,et a1.Human neural stem cells migrate along the nigrotriata1 pathway in a primatemodel of Parkinsons disease[J].ExpNeurol,2008,211(2):362-369.
[21] 王蒙 ,杨媛.人脐血源性MSCs成骨诱导分化后对DCs免疫抑制研究[J]. 免疫学杂志,2012,28(11):959-963.
[22] Nabel E G,Brannwald E.A tale of coronary artery disease and myocardial infarction[J].N Engl J Med,2012,366(1):54-63.
[23] Nasef A,Fouillard L,Ashammakhi N.Immunomodulatory effect of mesenchymal stromal cells:possible mechanisms[J].RegenMed,2008,3(4):531-46.
[24] Luo Y,Wang Y,Poyntcr J A,et a1. Pretrcating mesenchymal stem cels with interleukln-1β and transforming growth factor– β psynergistically increases vascular endothelial growth factor production and improves mesenehymal stem cell--mediated myocardial protection after acute ischemia[J].Surgery,2012,151(3):353-63.
[25] Ries C,Egea V,Karow M,et a1.MMP-2,MT1,MMP,and TIMP-2 are essential forthe invasive capacity of human mesenehymalstem cells:differential regulation by inflammatory cytokines [J].Blood,2007,109(9):4055-63.
[26] Nian M,Lee P,Khaper N,et a1.Inflammatory cytokines and postmyoeardial infarction remodeling[J].Circ Res,2004,94(12):1543-1553.
[27] Egea V,yon Baumgarten L,Schichor C,et a1.TNF-13t respecifies human mesenchymal stem cells to a neural fate an d promotes migration toward experimental glioma[J].Cell Death Differ,2011,18(5):853-863.
[28] Tit,XM,Peyton KJ,Shebib AR,et a1.Activation of AMPK stimulates heme oxygenase-1 gene expression and human endothelial cell survival[J].Am J Physiol Heart Circ Physiol,2011,300(3):84-93.
[29] Jazwa A,Stepniewski J,Zamykal M,et a1.Pre-eruptivehypoxia regulated HO-1 gene therapy improves postischaemic limb perfusion and tissue regeneration in mice [J].Cardiovasc Res,2013,97(4):115-124.
[30] Yaghoubi SS,Campbell DO,Radu CG,et a1.Positron emission tomography reporter genes and reporter probes:gene and cell therapy applications[J].Theranostics,2012,2(1):374 -391.
[31] Wu ML,Ho YC,Lin CY,et a1.Heme oxygenase-1 in inflammation and cardiovascular disease [J].Am J Cardio-vasc Dis,2011,1(2):150-158.
[32] Terrovitis JV,Smith RR,Marb6n E.Assessment and optimization of cell engraftment after transplantation into the heart[J].Circ Res,2010,106(3):479-494.
[33] Henmann J L,Abarbanell A M,Wang Y,et al.Transforming growth faetor etenhances stem cell mediated postischemic myocardial protection[J].Ann Thorae surg,2011,92(5):1719-1725
[34] Xiao Q,Wang sK,Tian H,et al. INF-otincreases bonemal Tow mesenehymalstem cell migration to ischemic tissues[J].Cell Biochcm Biophys,2012,62(3):409-414.
[35] Armifi6n A,Gandfa C,Garcia Verdugo JM,eta1.Mesenehymal stem cells provide better results than hematopoietic precumom for the treatment of myocardial infarction[J].J Am Coll Cardiol,2010,55(2):2244-2253.

