复合七氟醚时地佐辛用于上腹部手术麻醉适宜剂量
李俊等
[摘 要] 目的:分析复合七氟醚时地佐辛用于上腹部手术麻醉适宜剂量选择,为临床应用提供参考依据。方法:以140例择期行上腹部手术患者为研究对象。按照随机数字表法将其分为对照组、低剂量组、中剂量组和高剂量组,各35例。于麻醉诱导前给予8%七氟醚,并按照组别分别给予5 mL生理盐水、0.1 mg/kg、0.2 mg/kg和0.3 mg/kg地佐辛,后静脉注射琥珀酰胆碱。比较各组患者最低肺泡有效浓度(MAC)、应激反应及不良反应。结果:应用地佐辛能够有效降低七氟醚MAC,各组患者可达到相同麻醉深度。对照组术中MAP、HR变化较其他3组更为稳定,但其术毕即刻MAP显著高于其他各组,差异有统计学意义(P<0.05)。各组患者切皮后30 min至术毕即刻Glu、Lac、Cor均有所升高,对照组升高最为明显,差异有统计学意义(P<0.05)。中剂量组术中MAP、HR较高剂量组更为稳定,两组患者术中Glu、Lac、Cor比较,差异无统计学意义(P>0.05)。对照组、低剂量组、中剂量组患者不良反应发生率比较,差异无统计学意义(P>0.05),高剂量组不良反应发生率为68.6%,显著高于其他各组,差异有统计学意义(P<0.05)。结论:应用地佐辛能够有效降低七氟醚MAC与术中应激反应,将地佐辛剂量控制在0.2 mg/kg,有助于在保证麻醉深度前提下降低术后不良反应发生率。
[关键词] 复合七氟醚;地佐辛;上腹部手术;剂量
中图分类号:R 614 文献标识码: A 文章编号:2095-5200(2015)04-019-04
上腹部手术对患者肌肉松弛度要求较高,故常以全身麻醉保证麻醉平面位达到胸2~胸10神经范围,使患者对手术刺激无明显应激反应[1]。麻醉诱导期及麻醉维持期应用气管插管往往导致机体处于高应激状态,可导致心脑血管功能紊乱、代谢紊乱等严重并发症发生,因此,选择合适麻醉药物是抑制应激反应、保证手术效果前提[2]。七氟醚是一种吸入麻醉剂,具有最低肺泡有效浓度(MAC)小、血气分配系数低、可控性强等优势,是上腹部手术理想麻醉药物,但单纯应用七氟醚,患者麻醉苏醒期易出现躁动。地佐辛是一种人工合成新型强效混合型阿片类受体激动-拮抗剂,近年来,有学者应用复合七氟醚与地佐辛进行麻醉诱导,取得了良好麻醉效果[3]。然而,目前关于地佐辛适宜剂量选择尚存在争议。为此,笔者选取我院140例择期行上腹部手术患者实施前瞻性对照研究,现将研究方法与结论报告如下。
1 一般资料
选取我院2012年8月至2014年8月诊治140例择期行上腹部手术患者,经我院医学伦理委员会批准,征得患者及家属知情同意后,纳入此次研究。排除标准:(1)入组前1周内有镇静、镇痛类药物使用史。(2)合并神经系统疾病或神经肌肉传导功能异常。(3)合并严重心、肺、肾等其他系统疾病。(4)有酗酒史或过度肥胖。(5)近期有呼吸道感染、胃食道反流、呼吸困难发病史。按照随机数字表法将其分为对照组、低剂量组、中剂量组和高剂量组,各35例。。各组年龄、体重、身高、手术时间、性别、ASA分级、手术类型等指标比较均未见明显统计学差异(P>0.05),本研究具有可比性。
2 研究方法
2.1 药品与设备
乳酸钠林格氏液:山东齐都药业有限公司,规格500 mL。地佐辛:地佐辛注射液,扬子江药业集团有限公司,规格1 mL(5 mg)。七氟醚:上海恒瑞医药有限公司生产,规格120 mL。琥珀酰胆碱:商品名司可林,上海旭东海普药业有限公司生产,规格2 mL(100 mg)。麻醉机:荷兰德恩欧美达公司生产,型号Aestiva/57100。麻醉气体监测仪:荷兰飞利浦公司生产,型号1026B。实时肌松检测仪:荷兰欧佳农公司生产,型号TOF-Watch SX。
2.2 麻醉方法
术前禁食8 h,入室后行常规心电图、血压、血氧饱和度监测,建立静脉通路,静脉输注乳酸钠林格氏液,剂量10 mL/(kg·h)。给予面罩吸氧,氧流量0.1 L/(kg·h),使用麻醉气体监测仪对呼气末二氧化碳、七氟醚吸入浓度进行检测。
于麻醉诱导前按照患者组别分别给予5 mL生理盐水、0.1 mg/kg、0.2 mg/kg和0.3 mg/kg地佐辛(溶于5 mL生理盐水中),静脉注射。给予8%七氟醚,氧流量6~8 L/min,保持呼气末七氟醚浓度维持在3%,持续2 min[4]。后静脉注射琥珀酰胆碱,剂量0.15 mg/kg。待患者肌颤消失后,连接麻醉机,行气管插管机械通气,通气参数:氧流量1~2 L/min,潮气量8~10 mL/kg,频率10~12次/min,吸呼比1:2,呼气末二氧化碳35~45 mmHg。
将对照组、低剂量组、中剂量组、高剂量组患者七氟醚呼气末浓度分别设定为3.0%、2.6%、2%及1.8%,于10 min内将七氟醚呼气末浓度调整至上述水平[5],稳定15 min以上切皮。
3 观察指标
3.1 最低肺泡有效浓度及麻醉深度
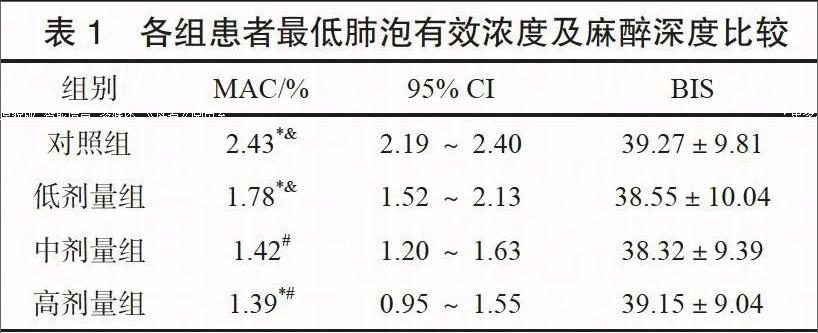
各组患者按照序贯法接受手术,若上例患者术中出现体动,则下一例患者七氟醚呼气末浓度上调20%,反之则下调20%。至交叉点≥6时,取其平均值作为该组抑制50%患者切皮诱发体动MAC[6],并对其95%可信区间(95% CI)进行计算。以脑电双频指数(BIS)代表各组患者麻醉深度,进行比较。
3.2 应激反应
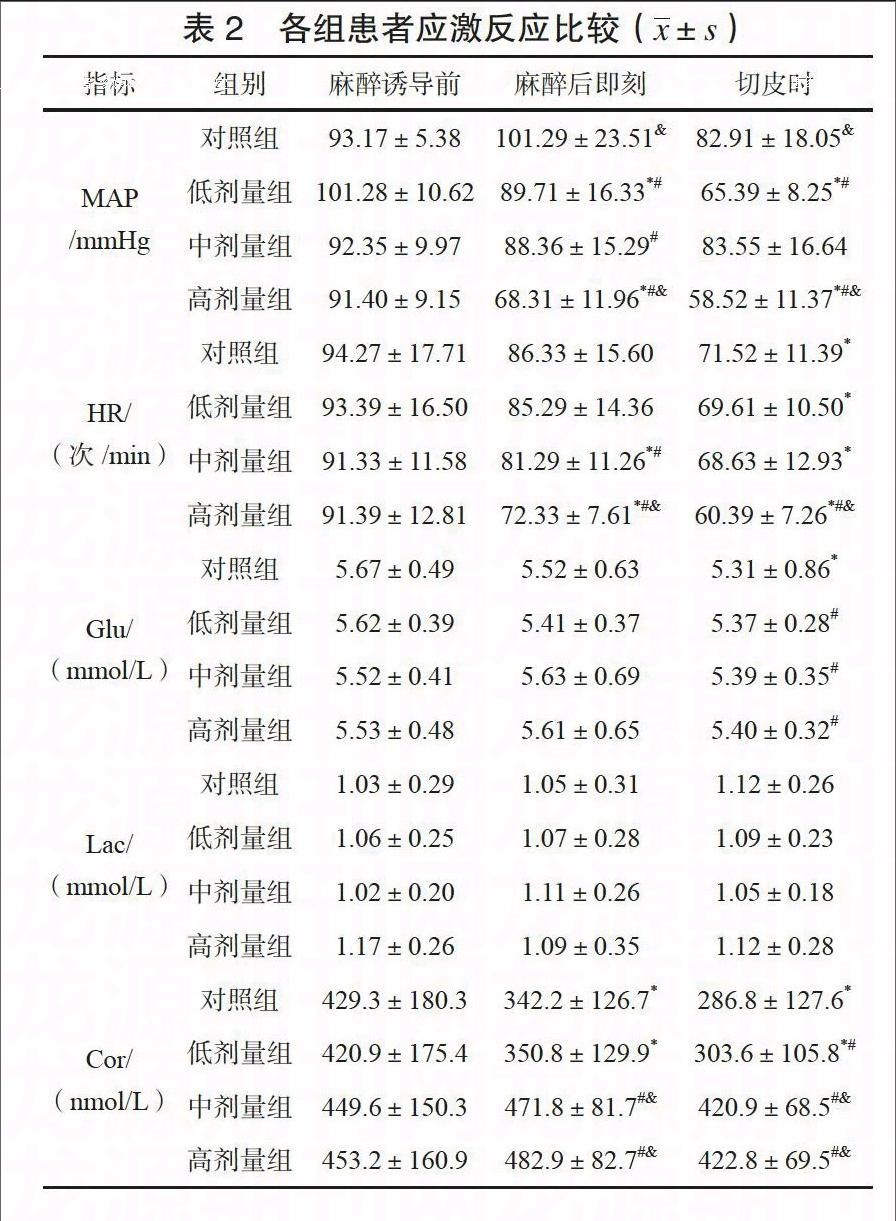
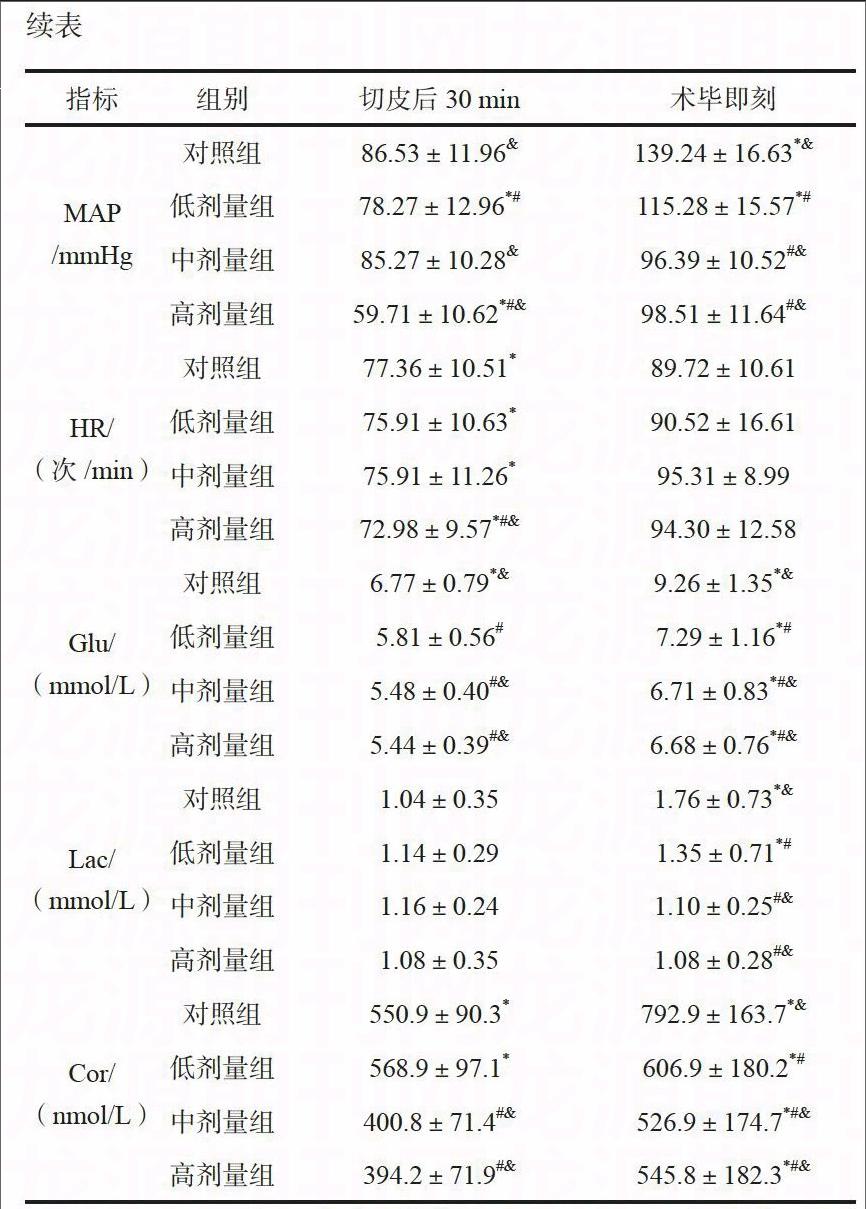
记录各组患者麻醉诱导前、麻醉后即刻、切皮时、切皮后30 min、术毕即刻平均动脉压(MAP)、心率(HR)、末梢血糖(Glu)、乳酸(Lac)及皮质醇(Cor)浓度,比较其应激反应水平。
3.3 不良反应
记录各组患者麻醉期间心动过缓、低血压及术后恶心、呕吐、呼吸抑制等不良反应发生情况。
4 统计学分析
对本临床研究所有数据采用SPSS18.0进行分析,计数资料以(n/%)表示,并采用c2检验,计量资料以(x±s)表示,并采用t检验,检验水准设定为α=0.05,以P<0.05为有统计学意义,以P<0.01为有显著统计学意义。
5 结果
5.1 各组最低肺泡有效浓度及麻醉深度比较
中剂量组、高剂量组MAC显著高于低剂量组、对照组,差异有统计学意义(P<0.05),中剂量组与高剂量组MAC比较,差异无统计学意义(P>0.05),各组患者BIS比较,差异无统计学意义(P>0.05)。见表1。
5.2 各组应激反应比较
对照组术中MAP、HR变化较其他3组更为稳定,但其术毕即刻MAP显著高于其他各组,差异有统计学意义(P<0.05)。各组患者切皮后30 min至术毕即刻Glu、Lac、Cor均有所升高,对照组升高最为明显,差异有统计学意义(P<0.05)。中剂量组术中MAP、HR较高剂量组更为稳定,两组患者术中Glu、Lac、Cor比较,差异无统计学意义(P>0.05)。见表2。
5.3 各组不良反应比较
对照组、低剂量组、中剂量组不良反应发生率分别为22.9%、28.6%、22.9%,三组不良反应发生率比较,差异无统计学意义(P>0.05),高剂量组心动过缓8例,低血压16例,不良反应发生率为68.6%,显著高于其他各组,差异有统计学意义(P<0.05)。
6 讨论
上腹部手术多为大中型手术,患者常因病理状态导致机体电解质紊乱、低血容量等生理变化,易因术中应激反应导致心脑血管事件发生,故保证麻醉安全平稳是确保手术顺利进行关键[7]。故目前上腹部手术多采取全身麻醉,其麻醉诱导速度快、保证通气量充足优点已达成广泛共识[8]。
MAC是反映吸入麻醉药物作用强度主要指标,可受患者年龄、体重等指标影响。本研究4组患者一般资料比较,差异无统计学意义(P>0.05),排除了上述因素对研究结果造成干扰。可以发现,随着地佐辛剂量增加,七氟醚MAC逐渐降低,且中、高剂量地佐辛对MAC影响比较,差异无统计学意义(P>0.05),各组患者BIS比较,差异亦无统计学意义(P>0.05)。该结果表明,地佐辛能够在确保麻醉深度前提下,有效降低七氟醚MAC,避免高浓度七氟醚对呼吸中枢、心脏迷走神经影响[9]。
全麻缺陷在于无法全面阻滞交感、躯体神经传入,往往使患者出现较强应激反应,对术中操作、术后恢复均可造成明显影响。因此,在保证麻醉深度前提下,更为有效地抑制患者应激反应是改善其预后重中之重。七氟醚较其他常用静脉麻醉药物而言,抑制应激反应效果不够理想[10]。本研究对照组患者MAP、HR变化更为平稳,但与其他各组相比,Glu、Lac、Cor水平波动更为明显,差异有统计学意义(P<0.05),印证了上述结论,并提示应激反应存在、麻醉苏醒期躁动明显。应用低剂量地佐辛对这一应激反应无明显改善效果,中、高剂量地佐辛使得患者机体Glu、Lac、Cor水平得到了有效控制,可能与地佐辛抑制交感-肾上腺皮质系统兴奋、增强手术区域痛觉传入阻断效果有关,这对减轻术中应激反应及术后炎性反应均具有积极意义。
地佐辛一方面可通过激动κ受体,增强七氟醚镇痛、镇静效果,另一方面,地佐辛还可部分阻断μ受体,起到兴奋心血管、增强平滑肌张力作用,有助于降低围术期心动过缓、低血压等不良反应发生率[11]。然而,本研究发现,高剂量组不良反应发生率显著高于其他各组,考虑与高剂量地佐辛激活Gi蛋白后,对钙通道阻滞作用及对中枢神经系统敏化降低作用过强有关,可能引发严重心血管抑制与药物蓄积作用,安全性有待商榷[12]。故以0.2 mg/kg地佐辛复合七氟醚实施麻醉诱导方为理想药物剂量。
参 考 文 献
[1] 耿武军, 唐红丽, 张学政, 等. 地佐辛注射液对腹腔镜胆囊切除术全麻苏醒期不良反应影响[J]. 中国临床药理学与治疗学, 2012, 17(3): 318-318.
[2] Li X, Xia Q, Li W. Comparison of the effects of dezocine, fentanyl, and placebo on emergence agitation after sevoflurane anesthesia in children[J]. International journal of clinical pharmacology and therapeutics, 2015, 53(3): 241-246.
[3] 胡鹏, 芦智波, 刘敏, 等. 地佐辛对七氟醚麻醉腹腔镜手术患者应激反应影响[J]. 内蒙古中医药, 2014, 33(15): 25-26.
[4] Lu Z, Fang J, Zhu J, et al. Intravenous dezocine pretreatment reduces the incidence and intensity of myoclonus induced by etomidate[J]. Journal of anesthesia, 2014, 28(6): 944-947.
[5] 安礼俊, 张宙新, 胡伟, 等. 地佐辛对瑞芬太尼复合七氟醚麻醉苏醒期躁动影响[J]. 南京医科大学学报: 自然科学版, 2011, 31(7): 1036-1039.
[6] Wan Q, Xu L, Bo Y. Effects of Dexmedetomidine combined with Dezocine on cognition function and hippocampal microglia activation of rats[J]. International journal of clinical and experimental medicine, 2014, 7(9): 2787.
[7] 项崇悟, 高丽娟, 吴兴娇, 等. 地佐辛预防七氟醚全身麻醉后苏醒期躁动临床效果[J]. 中国药业, 2013, 22(13): 94-96.
[8] 胡鹏, 芦智波, 刘敏, 等. 地佐辛对腹部手术患者七氟醚MACBAR影响[J]. 北方药学, 2014, 11(11): 115-116.
[9] Shinn H K, Lee M H, Moon S Y, et al. Post-operative nausea and vomiting after gynecologic laparoscopic surgery: comparison between propofol and sevoflurane[J]. Korean journal of anesthesiology, 2011, 60(1): 36-40.
[10] 靳红绪, 王忠义, 张同军, 等. 地佐辛预防瑞芬太尼复合七氟醚麻醉后诱发痛觉过敏临床研究[J]. 中国医药导报, 2012, 9(22): 88-90.
[11] Lindholm E E, Aune E, Norén C B, et al. The anesthesia in abdominal aortic surgery (ABSENT) study: a prospective, randomized, controlled trial comparing troponin T release with fentanyl-sevoflurane and propofol-remifentanil anesthesia in major vascular surgery[J]. Anesthesiology, 2013, 119(4): 802-812.
[12] Zaugg M, Lucchinetti E. Sevoflurane-Compared with Propofol-based Anesthesia Reduces the Need for Inotropic Support in Patients Undergoing Abdominal Aortic Aneurysm Repair: Evidence of Cardioprotection by Volatile Anesthetics in Noncardiac Surgery[J]. Anesthesiology, 2014, 120(5): 1289-1290.

