臭氧化生理盐水对慢性坐骨神经结扎损伤大鼠脊髓TNF-α和IL-1β表达的影响
王喜连,旷 昕,赵 铭,颜 超
(1.南华大学附属第一医院疼痛科,湖南衡阳421000;2.南华大学附属第一医院麻醉科,湖南衡阳421001;3.孝感市中心医院泌尿外科,湖北432100)
臭氧化生理盐水对慢性坐骨神经结扎损伤大鼠脊髓TNF-α和IL-1β表达的影响
王喜连1,旷 昕2,赵 铭2,颜 超3
(1.南华大学附属第一医院疼痛科,湖南衡阳421000;2.南华大学附属第一医院麻醉科,湖南衡阳421001;3.孝感市中心医院泌尿外科,湖北432100)
目的 观察静脉注射40 μg/mL臭氧化生理盐水对神经病理性疼痛大鼠脊髓肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)的影响。方法 将24只SD大鼠分成假手术组(Sham组)、慢性坐骨神经结扎损伤(CCI)组(CCI组)和CCI臭氧化生理盐水干预组(Ozone组),每组8只。术前1 d和术后7 d测定各组动物机械刺激及热刺激潜伏期。采用双抗体夹心酶联免疫吸附法检测术后第7天脊髓IL-1β、TNF-α水平。结果 CCI导致大鼠机械刺激及热刺激潜伏期下降,术后7 d CCI组大鼠与Sham组比较,TNF-α、IL-1β[(3.24±0.21)、(13.13±0.72)pg/mg]水平增高,差异均有统计学意义(P<0.01);静脉注射臭氧化生理盐水能降低CCI大鼠的机械性痛阈及热痛阈值,且使TNF-α、IL-1β[(1.16±0.04)、(7.89±0.27)pg/mg]的表达水平降低,差异均有统计学意义(P<0.01)。结论 静脉注射臭氧化生理盐水可能通过抑制脊髓TNF-α、IL-1β的表达而降低CCI大鼠的痛觉反应。
臭氧; 氯化钠; 脊髓; 结扎术; 神经系统/病理学; 疼痛; 大鼠,Sprague-Dawley; 肿瘤坏死因子α; 白细胞介素1β
神经病理性疼痛是与多种周围神经障碍相关联的共同症状表现,在神经损伤正常愈合后仍可持续存在数月甚至数年,并伴感觉和运动功能异常,严重影响患者的生活[1]。近年来有研究表明,神经系统的重塑及免疫系统的激活参与了神经病理性疼痛形成过程,而细胞因子作为联系神经-免疫反应的关键分子,在疼痛的激发和维持中发挥了重要作用[2]。本研究采用慢性坐骨神经结扎损伤(CCI)模型建立神经病理性疼痛模型,观察静脉注射臭氧化生理盐水对CCI大鼠机械性痛阈(采用机械刺激潜伏期表示)、热痛阈(采用热刺激潜伏期表示)及脊髓肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)表达的影响,探讨臭氧化生理盐水对神经病理性疼痛大鼠镇痛作用的可能机制,为医用臭氧的临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 将24只健康成年雄性SD大鼠(由南华大学动物实验中心提供,体质量200~250 g),随机分为假手术组(Sham组)、手术组(CCI组)及CCI臭氧化生理盐水干预组(Ozone组),每组8只。Ozone组于术后1 d开始每天尾静脉注射40 μg/mL臭氧化生理盐水5 mL/kg,CCI组和Sham组尾静脉注射相同容积的生理盐水。所有大鼠分别于术前1 d、术后7 d进行机械性痛阈和热痛阈检测。术后7 d处死大鼠,取腰段脊髓,置于-70℃深低温冰箱保存备用。
1.1.2 试剂及主要仪器 TNF-α、IL-1β试剂盒(武汉博士德生物工程有限公司),医用臭氧治疗仪(德国赫尔曼公司),Von Frey纤维丝测痛仪(美国Stoelting公司),BME-410C型全自动热痛刺激仪(中国医学科学院生物工程研究所)等。
1.2 方法
1.2.1 CCI的制备 术前将动物置于安静、自然光的环境中饲养48 h以上。保持动物在室温、12 h昼夜节律,自然饮水、进食。SD大鼠腹腔注射10%水合氯醛(300 mg/kg)进行麻醉后常规消毒右后肢,切开皮肤及皮下组织,钝性分离肌肉,于股骨后找到坐骨神经主干,在坐骨神经三叉分支的近侧端约5 mm处,用4-0铬制羊肠线松扎4处,间距为1 mm,结扎线以不影响神经外膜的血运为度,近侧端第1、2道结扎线结扎时可见肢体有轻微抖动,第3、4道结扎线以没有肢体抖动为宜。然后逐层缝合。术后肌内注射青霉素25×105U预防感染。Sham组仅暴露坐骨神经而不进行结扎,其余过程同CCI组。
1.2.2 行为学测试
1.2.2.1 行为学观察 手术前后观察大鼠后肢着地的协调程度、着地/离地时间、跛行、爪部畸形,以及舔、咬或激烈抖动患侧足等自噬现象。
1.2.2.2 机械刺激潜伏期(PWML) 采用Von Frey纤维丝测定双后肢机械痛阈,即将大鼠固定在特制的、大小为220 mm×220 mm×280 mm有机玻璃罩内,放在高为360mm的金属笼架实验台上,用不同压力的纤维丝(从小到大)刺激其双侧足底,每次间隔5 s,直至找到出现50%(10次)抬足反应的纤维丝,记录其压力值,并将其设定为阈值。所有测定均于9:00~10:00进行。
1.2.2.3 热刺激潜伏期(PWTL) 将大鼠固定在特制的、大小为220 mm×220mm×280 mm有机玻璃罩内,放在高为360 mm的实验台上,实验台的玻璃板厚约2 mm。调整光源与后肢足底的距离及光辐射强度,使基础PWTL在5~10 s。单次光照射时间不超过20 s,同一部位刺激的间隔时间为5 min,以开始照射至出现缩足逃避反射的时间表示热痛阈,连续测定3次,取平均值。
1.2.3 组织取材 戊巴比妥钠60 mg/kg腹腔注射深度麻醉,用剪刀截取腰段椎体,从骶段椎管内快速注射冰冷生理盐水将完整的脊髓冲出,用刀片截取腰膨大部位的脊髓(相当于L4~6脊髓),快速放入液氮中冻存,在-70℃深低温冰箱保存备用。
1.2.4 组织匀浆 检测前将组织取出称质量,然后将脊髓置于预冷组织匀浆液中[0.1 mol/L磷酸盐缓冲液(PBS),pH 7.4,含有1 mmol/L乙二胺四乙酸(EDTA)],用玻璃匀浆器在4℃下匀浆,20 000 r/min离心30 min,取上清液,储存于-80℃备用。
1.2.5 脊髓组织匀浆生化指标测定 严格按照酶联免疫吸附试验(ELISA)试剂盒提供的标准步骤测定TNF-α、IL-1β水平。所有标本均为双管检测,结果以“pg/mg”表示。
1.3 统计学处理 应用SPSS11.5统计软件进行数据分析,计量资料以±s表示,多组间比较采用完全随机资料方差分析(One-Way ANOVA),两两比较采用LSD-t检验;计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 行为学测试 三组大鼠术前1dPWML、PWTL比较,差异均无统计学意义(P>0.05),术后7 d,CCI组PWML、PWTL较术前下降,差异有统计学意义(P<0.01),Shan组、Ozone组大鼠术后7 d PWML、PWTL与术前比较,差异均无统计学意义(P>0.05)。而CCI组术后7 d PWML、PWTL较Sham组和Ozone组均降低,差异均有统计学意义(P<0.01),见表1、2。Ozone大鼠右后支跛行、缩足等现象明显改善。
2.2 三组大鼠术后7 d脊髓TNF-α和IL-1β检测结果比较 术后7 d CCI组大鼠脊髓TNF-α、IL-1β水平较Sham组明显增高,差异有统计学意义(P<0.01);Ozone组大鼠骨髓TNF-α、IL-1β水平较CCI组均下降,差异均有统计学意义(P<0.01),而与Sham组比较,差异均无统计学意义(P>0.05),见表3。
表1 三组大鼠手术前后右后肢PWML比较(±s,g)
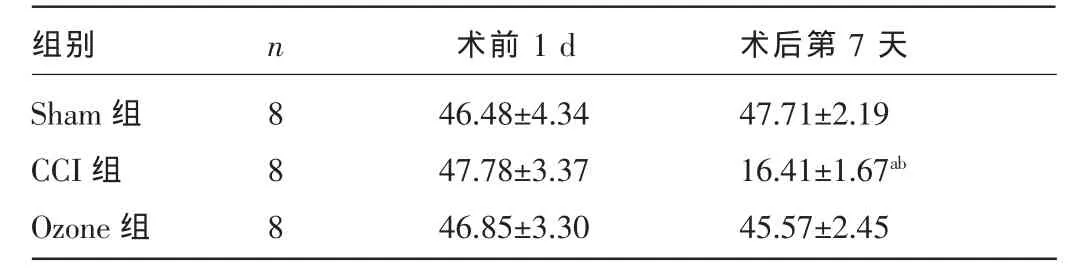
表1 三组大鼠手术前后右后肢PWML比较(±s,g)
注:与Sham组、Ozone组同时间点比较,aP<0.01;与同组术前1 d比较,bP<0.01。
术前1 d 术后第 7天组别Sham组CCI组Ozone组n 888 46.48±4.34 47.78±3.37 46.85±3.30 47.71±2.19 16.41±1.67ab45.57±2.45
表2 三组大鼠手术前后右后肢PWTL比较(±s,s)
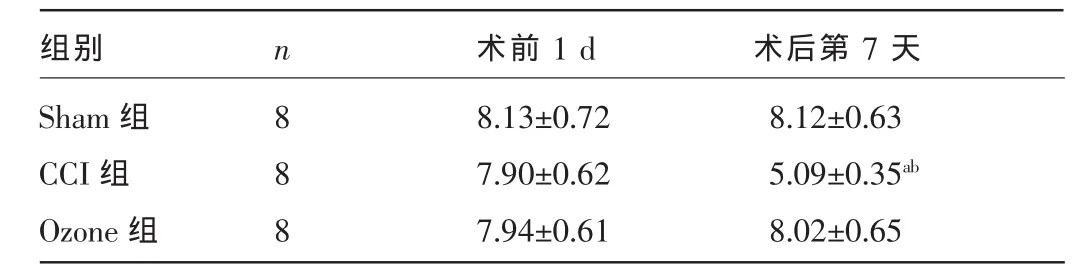
表2 三组大鼠手术前后右后肢PWTL比较(±s,s)
注:与Sham组、Ozone组同时间点比较,aP<0.01;与同组术前1d比较,bP<0.01。
术前1 d 术后第7天组别Sham组CCI组Ozone组n 888 8.13±0.72 7.90±0.62 7.94±0.61 8.12±0.63 5.09±0.35ab8.02±0.65
表3 三组大鼠术后7d脊髓TNF-α和IL-1β检测结果比较(±s,pg/mg)
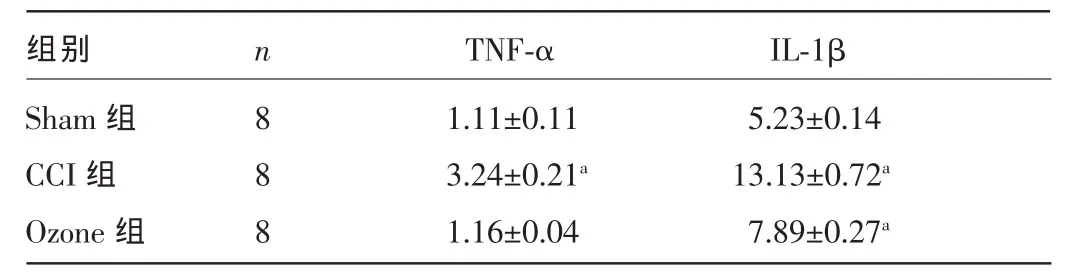
表3 三组大鼠术后7d脊髓TNF-α和IL-1β检测结果比较(±s,pg/mg)
注:与Sham组、Ozone组比较,aP<0.01。
组别Sham组CCI组Ozone组n 888 TNF-α IL-1β 1.11±0.11 3.24±0.21a1.16±0.04 5.23±0.14 13.13±0.72a7.89±0.27a
3 讨 论
神经系统特别是中枢神经系统的重塑与神经病理性疼痛的激活密切相关,在神经病理性疼痛的维持和慢性化过程中,脊髓背角突触的可塑性改变和中枢敏化起重要作用[3-4]。中枢敏化过程主要为胶质细胞的激活及相关细胞因子的释放,细胞因子包括神经生长因子、脑源性神经营养因子、胶质细胞源性神经营养因子、IL-1β、IL-6、TNF-α及前列腺素(PGs)等,胶质细胞释放的细胞分子通过作用于突触前自身受体激发突触前囊泡大量释放致痛物质[5],同时,作用于突触后神经元上自身受体激发胞内信号转导,最终导致痛觉信号的过度放大,从而引发中枢敏化和病理性疼痛的瀑布式放大效应[6]。另外,免疫系统在神经病理性疼痛的形成及维持阶段发挥了重要作用[2],联系神经-免疫反应的关键分子的细胞因子可能通过激活炎症细胞而加重炎性反应,促进兴奋性氨基酸、NO、氧自由基的释放,敏化脊髓背角神经元而介导神经病理性疼痛[7]。在神经病理性疼痛中可能发挥重要作用的主要有TNF-α、IL-1、IL-6等。有研究表明,神经损伤的早期脊髓组织中TNF-α mRNA及其蛋白的表达迅速升高,提示TNF-α可能在神经病理性疼痛形成的最初阶段发挥重要作用。外周神经损伤后脊髓组织中IL-1β mRNA和蛋白表达增加,而鞘内应用IL-1β和TNF-α拮抗剂可出现剂量相关的抑制神经病理性痛觉过敏,由此证实,IL-1β和TNF-α与神经病理性疼痛的激活有关[8-9]。鉴于细胞因子在神经病理性疼痛中的关键作用,以炎性反应或促炎性细胞因子作为靶点的疼痛治疗策略逐渐受到关注。
医用臭氧具有免疫调节效应,现已用于促进压疮愈合、椎间盘突出症、外周血管疾病、类风湿性关节炎及疼痛等治疗[10]。坐骨神经痛或腰背部疼痛患者通过神经根局部注射臭氧能够有效减轻疼痛程度。局部注射医用臭氧可显著缓解糖尿病神经病理性疼痛大鼠模型实验中的痛觉过敏[11],说明臭氧局部应用能有效缓解神经病理性疼痛程度。目前认为,臭氧局部注射可直接作用于神经末梢,刺激中间神经元释放脑啡肽等物质,而臭氧代谢后于局部直接改善神经末梢组织缺氧状况,从而发挥镇痛效应。单次皮下注射臭氧能降低神经痛大鼠的疼痛程度且降低神经组织中炎症因子的表达,提示臭氧可能通过抑制中枢神经系统中炎症因子的表达而有效降低神经病理性疼痛大鼠痛觉过敏程度[12]。医用臭氧自体血回输疗法是臭氧全身应用治疗的主要方法,因其受外周血管状况的影响,临床应用不方便[13]。因此,能否以臭氧化液体静脉滴注方法替代臭氧自体血回输疗法一直在探索中。Bocci[14]发现,臭氧化生理盐水能很好地保存臭氧及其衍生物,但高浓度臭氧化生理盐水(臭氧质量浓度80 μg/mL)静脉滴注对血管有刺激性,可能引起化学性静脉炎。临床实践结果显示,低浓度臭氧化生理盐水静脉滴注具有臭氧自体血回输疗法相同的疗效,且无明显不良反应[15]。
本研究采用传统CCI技术建立神经病理性疼痛模型,术后7 d测定PWML及PWTL,与术前比较,CCI组大鼠PWML、PWTL均下降,而Sham组与术前比较,差异无统计学意义(P>0.05),表明CCI组成功复制出神经病理性疼痛。术后每天通过静脉注射臭氧化生理盐水,术后7d大鼠PWML、PWTL较CCI组增高,脊髓TNF-α及IL-1β水平较CCI组降低。由此可推断,静脉注射40 μg/mL臭氧化生理盐水可通过抑制脊髓TNF-α及IL-1β的表达而发挥镇痛效应。
[1]Kerstman E,Ahn S,Battu S,et al.Neuropathic pain[J].Handb Clin Neurol,2013,110:175-187.
[2]Imai S,Ikegami D,Yamashita A,et al.Epigenetic transcriptional activation of monocyte chemotactic protein 3 contributes to long-lasting neuropathic pain[J].Brain,2013,136(Pt 3):828-843.
[3]Basbaum AI,Bautista DM,Scherrer G,et al.Cellular and molecular mechanisms of pain[J].Cell,2009,139(2):267-284.
[4]Tung KW,Behera D,Biswal S,et al.Neuropathic pain mechanisms and imaging[J].Semin Musculoskelet Radiol,2015,19(2):103-111.
[5]Cohen D,Segal M.Homeostatic presynaptic suppression of neuronal network bursts[J].J Neurophysiol,2009,101(4):2077-2088.
[6]Benarroch EE.Central neuron-glia interactions and neuropathic pain:overview of recent concepts and clinical implications[J].Neurology,2010,75(3):273-278.
[7]Lam SY,Liu Y,Ng KM,et al.Chronic intermittent hypoxia induces local inflammation of the rat carotid body via functional upregulation of proinflammatory cytokine pathways[J].Histochem Cell Biol,2012,137(3):303-317.
[8]Gerard E,Spengler RN,Bonoiu AC,et al.Chronic constriction injury-induced nociception is relieved by nanomedicine-mediated decrease of rat hippocampal tumor necrosis factor[J].Pain,2015,56(7):1320-1333.
[9]del Rey A,Apkarian AV,Martina M,et al.Chronic neuropathic pain-like behavior and brain-borne IL-1β[J].Ann N Y Acad Sci,2012,1262:101-107.
[10]Re L,Mawsouf MN,Menéndez S,et al.Ozone therapy:clinical and basic evidence of its therapeutic potential[J].Arch Med Res,2008,39(1):17-26.
[11]蔡振华,陈丹丹,周华成,等.臭氧对糖尿病神经病理性疼痛大鼠的镇痛作用[J].中国疼痛医学杂志,2012,18(4):205-208.
[12]Fuccio C,Luongo C,Capodanno P,et al.A single subcutaneous injection of ozone prevents allodynia and decreases the over-expression of pro-inflammatory caspases in the orbito-frontal cortex of neuropathic mice[J]. Eur J Pharmacol,2009,603(1/2/3):42-49.
[13]Borrelli E,Diadori A,Zalaffi A,et al.Effects of major ozonated autohemotherapy in the treatment of dry age related macular degeneration:a randomized controlled clinical study[J].Int J Ophthalmol,2012,5(6):708-713.
[14]Bocci V.臭氧治疗学[M].李庆祥,王燕申,译.北京:北京大学医学出版社,2006:15-29.
[15]Kulikov AG,Turova EA,Shcherbina TM,et al.Efficacy of different methods of ozone therapy in vascular complications of diabetes mellitus[J].Vopr Kurortol Fizioter Lech Fiz Kult,2002(5):17-20.
Effect of ozonated normal saline on spinal cord IL-1β and TNF-α expression in rat with sciatic nerve chronic constriction injury
Wang Xilian1,Kuang Xin2,Zhao Min2,Yan Chao3
(1.Department of Pain;2.Department of Anesthesiology,First Affiliated Hospital,University of South China,Hengyang,Hunan 421001,China;3.Department of Urologic Surgery,Xiaogan Municipal Central Hospital,Xiaogan,Hubei 432100,China)
Objective To investigate the effects of intravenous injection of 40 μg/mL ozonated normalsaline on the expression of spinal cord tumor necrosis factor-α(TNF-α)and interleukin-1β(IL-1β)in rats with chronic neuropathic pain.Methods 24 SD rats were randomized into the sham operation group(sham group),sciatic nerve chronic constriction injury group(CCI group)and the ozonated normal saline group(Ozone group),8 cases in each group.The paw withdrawal thermal latency(PWTL)and paw withdrawal mechanic threshold(PWMT)were measured before operation and on postoperative 7 d.The expression levels of spinal cord TNF-α and IL-1β on postoperative 7 d were detected by the double antibody sandwich ELISA.Results Sciatic nerve chronic constriction injury(CCI)induced the decrease of PWTL and PWMT(P<0.01);the expression of spinal cord TNF-α and IL-1β on postoperative 7 d in the CCI group were increased[(3.24±0.21)pg/mg,(13.13±0.72)pg/mg],there was statistical dif ference compared with the sham operation group(P<0.01);intravenous injection of ozonated normal saline could decrease PWTL and PWMT,moreover the TNF-α and IL-1β levels were decreased[(1.16±0.04),(7.89±0.27)pg/mg,P<0.01].Conclusion Intravenous injection of ozonated normal saline could decrease the pain sensation in CCI rat by inhibiting the expression of TNF-α and IL-1β in spinal cord.
Ozone; Sodium chloride; Spinal cord; Ligation; Nervous system/pathology; Pain; Rats,sprague-dawley; Tumor necrosis factor-alpha; Interleukin-1beta
10.3969/j.issn.1009-5519.2015.21.004
A
1009-5519(2015)21-3217-03
2015-08-16)
湖南省衡阳市科学技术发展计划项目(2013KJ51)。
王喜连(1977-),女,湖南溆浦人,硕士研究生,主要从事急慢性疼痛的诊治工作;E-mail:wxl553@163.com。

