DC-OVA疫苗在裸鼠体内的抗肿瘤效应
陈 晓, 周 薇, 王方策, 王 龙, 蒋 涛, 赵培林
(同济大学医学院组织学与胚胎学教研室,上海 200092)
·基础研究·
DC-OVA疫苗在裸鼠体内的抗肿瘤效应
陈 晓, 周 薇, 王方策, 王 龙, 蒋 涛, 赵培林
(同济大学医学院组织学与胚胎学教研室,上海 200092)
目的 构建靶向树突状细胞(dendritic cell, DC)的肿瘤疫苗DC-OVA系统,探讨DC-OVA肿瘤疫苗在祼鼠体内的抗肿瘤效应及相关机制。方法 构建表达肿瘤抗原OVA的树突状细胞。建立携带OVA的Lewis肺癌细胞(Lewis lung cancer cell-OVA, LLC-OVA)的皮下荷瘤裸鼠模型,瘤旁注射DC-OVA疫苗,通过记录肿瘤大小观察肿瘤生长抑制状况。以IHC方法观察肿瘤组织CD3、Nestin、CD133阳性细胞;观察脾DC相关分子(CD11c、OVA)的阳性表达以及T细胞(CD3+)的分布、数量和功能变化。同时,应用ELISA方法检测血清中IL-12的表达水平。结果 DC-OVA疫苗预防组与PBS对照组比较,呈现出明显的肿瘤生长抑制(P<0.05)。与对照组相比,DC-OVA疫苗治疗组肿瘤明显缩小(P<0.001)。疫苗治疗3次组与治疗1次组比较,效果更明显(P<0.05)。于实验第4周,疫苗治疗1次组与对照组比较,CD3阳性表达高,Nestin、CD133阳性表达低(P<0.05);治疗1次组血清IL-12含量较对照组升高(P<0.001);第8周,治疗1次组血清IL-12含量较第4周治疗组及第8周对照组低。结论 DC-OVA疫苗特异性杀伤了LLC-OVA肿瘤细胞,使肿瘤干细胞表达Nestin、CD133减少。
树突状细胞; 肺肿瘤细胞; DC疫苗; 肿瘤免疫治疗; 祼鼠
目前,肺癌在全球癌症死亡率中排在首位,每年新增约130万病例,且多数患者就诊时病变已不可切除[1]。近年来,以树突状细胞(dendritic cell, DC)为基础的肿瘤疫苗介导的抗肿瘤免疫应答成为肿瘤治疗研究的热点。DC是体内最重要、功能最强,也是唯一能激活初始T细胞的抗原提呈细胞,可摄取、处理和呈递抗原,启动和调控免疫反应[2]。DC已成为肿瘤免疫治疗策略中倍受关注的靶点。肿瘤患者体内免疫功能低下,DC抗原提呈功能缺陷、肿瘤细胞免疫原性减弱,不能有效激活T细胞,是肿瘤免疫逃逸的主要原因[3]。如何有效地激活T细胞而杀伤肿瘤细胞成为免疫治疗的关键。本课题组前期工作已初步表明所构建的靶向DC的基因工程疫苗对肺癌细胞的体外杀伤效应[4]。本研究通过构建DC-OVA肿瘤疫苗系统,进一步探讨DC-OVA肿瘤疫苗在体内的抗肿瘤效应,为肺癌免疫治疗提供理论依据。
1 材料与方法
1.1 质粒与细胞
pHR-CMV-EGFP-OVA为基因转移质粒,pLTR-VSVG为胞膜质粒,pHIV-packaging为包装质粒,均由本实验室构建、保存;LLC-OVA由本实验室构建、保存。
1.2 实验动物
SPF级6~8周雄性BALB/c裸鼠、雄性BALB/c小鼠,购于上海斯莱克公司,饲养于同济大学实验动物中心。
1.3 主要试剂
去内毒素质粒大提试剂盒购自北京天根公司;LiPofactAMINE 2000购自美国Invitrogen公司;细胞因子购自英国Peprotech公司;小鼠粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)、小鼠IL-4、培养基、胎牛血清购自美国Gibco公司;PE标记仓鼠抗小鼠CD11c、仓鼠抗小鼠CD11c购自美国BD公司;兔抗小鼠CD3、CD8、Nestin购自武汉博士德生物公司;兔抗小鼠CD133购自美国Proteintech公司;兔抗鸡OVA购自美国Abcam公司;IL-12 ELISA试剂盒购自美国RayBio公司。
1.4 细胞培养
293T细胞和LLC-OVA细胞复苏后分别培养于含10%胎牛血清的DMEM高糖培养液和RPMI-1640培养液中,加入双抗(100U/ml青霉素,100μg/ml链霉素),置于5% CO2培养箱,37℃培养,每2~3d传代1次。
1.5 质粒扩增、提取与鉴定
用去内毒素质粒提取试剂提取纯化质粒,并经琼脂糖凝胶电泳检测。具体方法详见文献[4]。
1.6 慢病毒的包装
三质粒以脂质体法共转染293T细胞,具体方法详见文献[4]。
1.7 小鼠骨髓DC(bone marrow dendritic cell, BMDC)的分离纯化与分析鉴定
取小鼠股骨与胫骨,将骨髓从骨髓腔内冲洗出来,吹打成单细胞悬液,行红细胞裂解。用含有25ng/ml GM-CSF和4ng/ml IL-4的RPMI培养液悬浮细胞,调整浓度为1×106个/ml,接种于6孔板中,37℃、5%CO2条件下培养。3d后半量换液。收集第6天骨髓细胞经PE标记的CD11c抗体孵育后,进行流式细胞分析;同时将部分细胞接种于圆形玻片上培养,而后进行CD11c的免疫组织化学染色(immunocytochemistry, ICC)染色。
1.8 慢病毒颗粒转导BMDC细胞
把收集的DC转移到圆底离心管中,添加含有8μg/ml 聚凝胺的病毒上清液至DC悬浮液中,小心混合,离心半径16.5cm,3000r/min,离心4h,保留部分含病毒液体,并随细胞一道转移至培养皿中,孵育过夜,换新鲜RPMI培养液,并补充细胞因子。
1.9 尼龙毛柱分离纯化T细胞
将1g尼龙毛柱填入10ml没有活塞的注射器中制备尼龙毛柱,高压蒸汽灭菌。取小鼠脾,研磨脾细胞,收集细胞并过滤。行红细胞裂解,离心洗、计数,将制备好的细胞置于尼龙毛柱上,37℃孵育45min,而后缓慢连续加入新鲜培养液,并收集前15ml滤液。细胞经离心洗并计数后用于后续实验。
1.10 DC-OVA和T细胞共培养
经OVA转导过的DC与T细胞以1∶4的比例混合,用含有25ng/ml GM-CSF、4ng/ml IL-4、4ng/ml IL-2的RPMI-10培养,共孵育72h,制备DC-OVA肿瘤疫苗系统。
1.11 荷瘤小鼠模型的建立与实验分组
所有受试裸鼠共18只,每只裸鼠躯干部皮下注射7×106/200μl LLC-OVA,建立荷瘤小鼠模型。实验分为对照组、治疗1次组、治疗3次组、预防组。对照组共6只裸鼠,肿瘤细胞接种1周后行PBS注射,分别于肿瘤细胞接种后第4、8周取材,每组3只。治疗1次组共6只裸鼠,于肿瘤细胞接种1周后注射1×107/200μl DC-OVA疫苗,分别于肿瘤细胞接种后第4、第8周取材,每组3只;治疗3次组共3只裸鼠,肿瘤细胞接种后1周开始注射上述剂量的疫苗,每隔1周注射1次,肿瘤细胞接种后第8周取材;预防组共3只裸鼠,肿瘤细胞接种前1周注射1×107/200μl DC-OVA疫苗,即肿瘤细胞接种3周后取材。
每天观察肿瘤生长情况,用游标卡尺测量记录肿瘤长径(a)、短径(b),计算肿瘤体积(V):V=ab2/2。根据肿瘤体积变化绘制肿瘤生长曲线。
1.12 脾脏、肿瘤形态学观察与功能检测
将所取肿瘤组织、脾进行石蜡切片,采用IHC检测观察脾中CD3、CD11c、OVA,肿瘤内CD3、Nestin、CD133的表达。常规烤片,脱蜡,3%H2O2封闭10min,一抗4℃孵育过夜,滴加生物素化二抗室温孵育1h,DAB显色,苏木精复染,脱水、封片。显微镜下观察CD3、CD133、Nestin染色切片,其阳性表达均呈现棕黄色。每张切片在低倍(×100)显微镜下,选取5个有代表性且不重复的区域,两人在高倍(×400)显微镜下双盲计数(误差超过10%则重复计数)。每个视野细胞阳性率=每个视野阳性细胞数/每个视野细胞总数×100%。
1.13 血清中IL-12
在反应板内分别加入标准品或血清样本100μl,将其充分摇匀后室温静置2.5h。用漂洗液将反应孔重复漂洗6次,滤纸吸干。每孔各加入一抗100μl,混匀后置室温1h。每孔加入底物工作液100μl,置37℃避光反应45min。终止反应后30min内用酶标仪在450nm处测吸光度值(D450),获得标准曲线和样品中IL-12浓度。
1.14 统计学处理
采用PRISM 5.0和Adobe Illustrator CC软件绘制图表。应用SPSS 19.0软件处理数据,肿瘤体积、血清IL-12含量用方差分析,阳性率的比较用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 BMDC分离纯化及慢病毒质粒转导DC效率的检测
分离、培养及初步纯化后第6天收集骨髓细胞,通过CD11c抗体孵育,FACS分析,从中分选出CD11c阳性细胞,阳性率为56.60%。ICC染色后,观察到骨髓细胞中CD11c阳性细胞占骨髓细胞总数的50%~60%,阳性反应产物位于细胞胞质,呈较均匀棕黄色,见图1。重组慢病毒质粒转导DC 48h后,在荧光显微镜下可见大量的DC呈绿色荧光,转导效率达70%以上,见图2。
很多父母强烈希望自己的孩子像某些文化标签下的“好孩子”,但事实上,一味盲从榜样的方法会带来很大的麻烦。
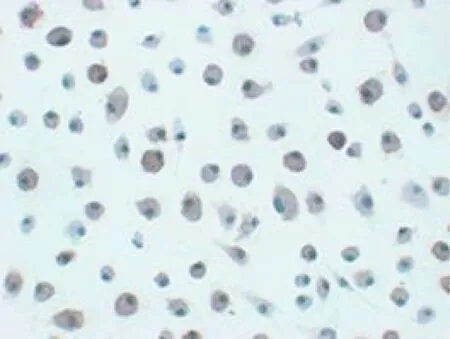
图1 CD11c在BMDC的表达Fig.1 Expression of CD11c in BMDC(ICC,×400)
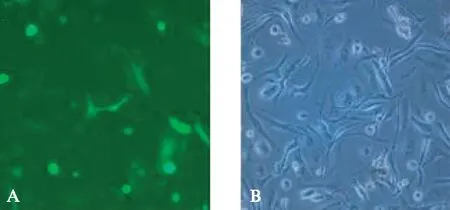
图2 OVA慢病毒质粒转导DC的观察Fig.2 Transduction of DC by OVA lentiviral plasmid(×400)A: 荧光显微镜图像;B: 同一视野相差显微镜图像
2.2 DC-OVA疫苗对荷瘤小鼠肿瘤生长的影响
对照组肿瘤生长较快,DC-OVA疫苗治疗组肿瘤生长抑制明显,肿瘤最终消失,两组间差异有统计学意义(F=44.475,P<0.001)。治疗3次组较治疗1次组肿瘤抑制更明显,肿瘤生长慢,消失快(P=0.035<0.05),其生长曲线见图3。DC-OVA疫苗预防组较PBS对照组肿瘤生长慢,肿瘤生长明显受抑制,两组间差异有统计学意义(F=17.329,P=0.009<0.05),肿瘤生长曲线见图4;肿瘤细胞注射后,裸鼠肿瘤生长状况的大体观察见图5。
2.3 脾组织病理学观察
在脾的动脉周围淋巴鞘及边缘区,CD3、CD11c均有表达,阳性产物定位于细胞质。CD3阳性染色呈棕褐色、着色均匀,见图6。第4周时,DC-OVA疫苗治疗1次组CD3阳性率(15.00%±2.29%)较对照组(9.04%±2.06%)高,差异有统计学意义(t=4.68,P=0.002<0.05);
CD11c阳性染色呈现为较强的不均匀的棕黄色,细胞形态不规则,大小不一。OVA阳性细胞胞质呈棕黄色,其分布区域与CD11c大致相同,见图7。
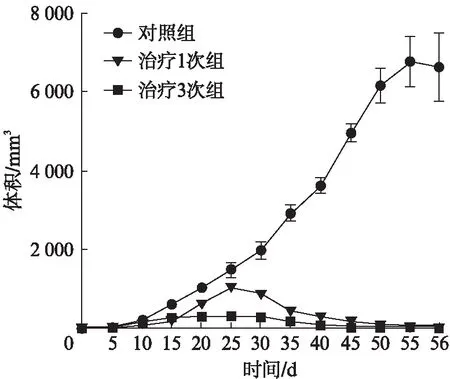
图3 治疗性实验肿瘤生长曲线Fig.3 Growth curve of the tumor in vaccine treatment groups
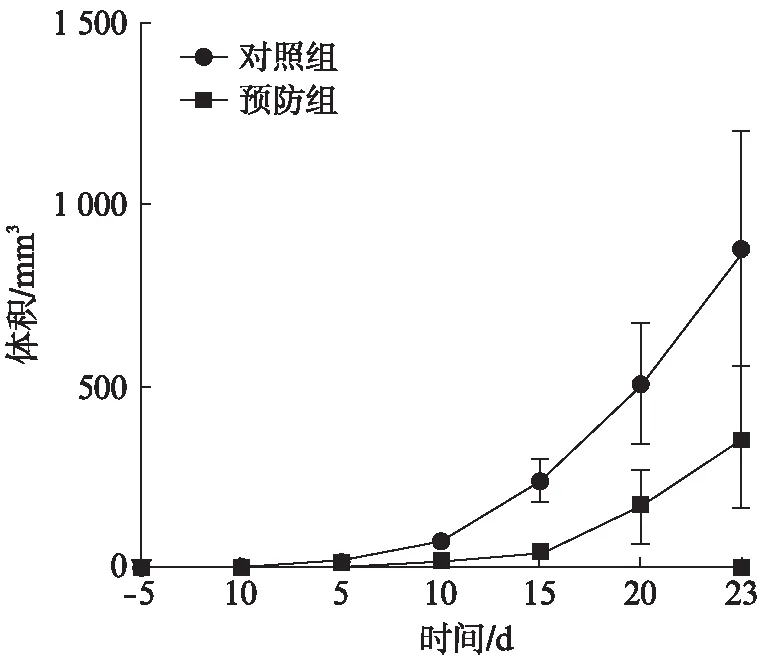
图4 预防性实验肿瘤生长曲线Fig.4 Growth curve of the tumor in vaccine preventiion group
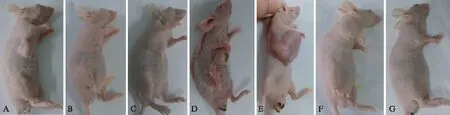
图5 裸鼠肿瘤生长的大体观察Fig.5 Gross observation of the tumor growth in nude miceA: 对照组(第3周);B: DC-OVA疫苗预防组(第3周);C: 对照组(第4周);D: DC-OVA疫苗治疗1次组(第4周);E: 对照组(第8周);F: DC-OVA疫苗治疗1次组(第8周);G: DC-OVA疫苗治疗3次组(第8周)
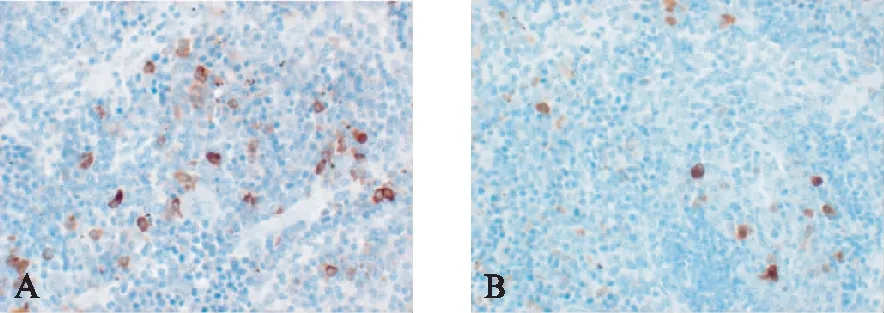
图6 CD3在脾中的表达Fig.6 Expression of CD3 in spleen(IHC,×400)A: DC-OVA疫苗治疗1次组;B: PBS对照组
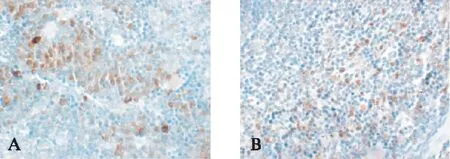
图7 CD11c、OVA在脾中的表达Fig.7 Expression of CD11c and OVA in spleen(IHC,×400)A: CD11c; B: OVA
2.4 肿瘤组织病理学观察
显微镜下可见肿瘤灶边缘有淋巴细胞浸润,亦见散在分布于肿瘤组织内,CD3阳性染色主要定位于淋巴细胞胞质中,呈均匀棕褐色。CD133阳性表达在细胞质中呈棕黄色沉淀,胞核不着色,细胞形态不规则,大小基本一致,大部分阳性细胞散在于肿瘤组织边缘,不甚均匀,见图8。Nestin染色较强,在胞质呈棕黄色颗粒、分布均匀,细胞形态不规则,大小一致,见图9。CD133、Nestin在所有肿瘤标本均有表达,第4周时,对照组CD133、Nestin阳性表达率(20.21%±8.69%、21.59%±3.84%)较DC-OVA疫苗治疗1次组(9.93%±1.86%、11.74%±2.95%)高,差异有统计学意义(t=2.58,P=0.03<0.05;t=4.54,P=0.002<0.05)。
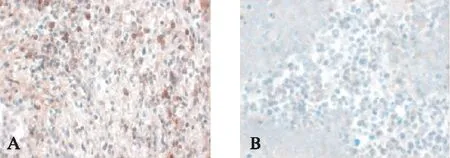
图8 CD3、CD133在肿瘤组织中的表达Fig.8 Expression of CD3 and CD133 in tumor tissus(IHC,×400)A: CD3;B: CD133

图9 Nestin在肿瘤组织中的表达Fig.9 Expression of Nestin in tumor tissus(IHC,×400)A: DC-OVA疫苗治疗1次组;B: 对照组
2.5 血清IL-12含量检测
第4周时,DC-OVA疫苗治疗1次组IL-12水平为(105.85±4.0)pg/ml,明显高于对照组(37.91±1.90)pg/ml,差异有统计学意义(F=244.4,P<0.001)。第8周时疫苗治疗1次组IL-12的水平为(43.71±4.50)pg/ml,明显低于对照组(87.41±4.35)pg/ml,差异有统计学意义(P<0.001)。治疗1次组第4周IL-12的水平较第8周时高,差异有统计学意义(P<0.001)。
3 讨 论
DC的数量、相关的生物活性、抗原提呈并激活特异性T细胞的能力是靶向DC肿瘤免疫治疗的几个重要环节[5]。本研究中,经DC-OVA疫苗治疗,肿瘤生长速度明显减缓,肿瘤体积减小,甚至最后消失。预防组肿瘤出现迟、发展慢。这些结果表明,本实验所构建的DC-OVA疫苗在裸鼠体内保持了良好的生物免疫活性及足够的DC数量;不仅具有抑制、杀伤肿瘤的作用,而且具有阻止肿瘤发生的作用。进一步的结果显示,疫苗治疗3次组较治疗1次组效果更为明显,并且治疗3次组在40d左右肿瘤完全消失,提示DC-OVA疫苗与抗肿瘤免疫反应之间有着直接的量效关系。
在靶向DC的肿瘤免疫治疗中,DC的归巢显得尤为重要。由于T细胞主要居于周围淋巴器官的胸腺依赖区,DC只有迁移归巢至周围淋巴器官才能与T细胞形成免疫接触,激发免疫应答。有研究[6]表明,影响以DC为基础的肿瘤免疫治疗疗效的重要因素是体外回输的外源性DC归巢的能力和数量。免疫组织化学染色显示裸鼠脾脏中DC-OVA细胞的存在,主要分布于动脉周围淋巴鞘及边缘区,即T细胞所在区域。由此表明,瘤体周围注射的DC-OVA在裸鼠体内存活并迁移归巢,继而DC-OVA才有可能刺激T细胞使之活化为CTL,并最终杀伤LLC-OVA肺癌细胞,抑制裸鼠皮下瘤的生长。T细胞标记分子CD3的实验显示,第4周时,DC-OVA疫苗治疗1次组脾组织中CD3阳性细胞明显增多,这反映了在体外经OVA抗原活化的T细胞经瘤旁注射后归巢至脾,并在脾内增殖,进而产生特异性抗肿瘤免疫反应。第8周时DC-OVA疫苗治疗组CD3的阳性表达与治疗次数之间无明显差别;且DC-OVA疫苗治疗组CD3的阳性表达低于对照组。产生这两个结果可能的原因: 治疗多次的优势可能更多体现在时间效应上而非强度效应;治疗末期,治疗组肿瘤逐渐消失,导致T细胞数量缩减,而对照组肿瘤体积依然增大,裸鼠体内产生一定的免疫反应,一定的数量T细胞亦可增殖,然而这些T细胞可能为非特异性的或功能缺陷型的,并无明显的抗肿瘤效应。
肿瘤干细胞理论认为肿瘤干细胞是导致肿瘤细胞不同分化程度和促使肿瘤不断生长和复发的根源。研究发现肿瘤干细胞标志物Nestin、CD133在肺癌[7]、胰腺癌[8]、卵巢癌[9]、神经胶质瘤[10]等表达;Nestin和CD133的表达强度与肿瘤恶性程度和预后具有相关性[8-10]。本研究显示,CD133、Nestin在LLC-OVA细胞形成的肿瘤组织中均有表达。第4周时DC-OVA疫苗治疗1次组CD133和Nestin表达量明显低于对照组,提示DC-OVA疫苗激活的效应性T细胞不仅特异性杀伤了LLC-OVA肿瘤细胞且有效地杀伤了CD133和Nestin标志的肿瘤干细胞,因而更有效地抑制了肿瘤的生长。提示DC-OVA疫苗除治疗作用外,还有可能降低肿瘤的恶性程度,降低复发率,提示预后较好。
IL-12主要由DC等抗原提呈细胞分泌产生,在原发性、自发性肿瘤的免疫中均发挥重要作用,其机制主要是通过促进T细胞增殖和诱导T细胞杀伤活性,调节T细胞介导细胞免疫发挥抗肿瘤作用。本研究检测裸鼠血清中IL-12含量,发现第4周时DC-OVA疫苗治疗1次组IL-12的水平明显高于对照组;肿瘤生长曲线可见在第4周时肿瘤开始缩小,表明在抗肿瘤过程中,DC-OVA大量分泌IL-12诱导免疫反应。第8周时疫苗治疗1次组IL-12的水平明显低于第4周治疗组和第8周对照组,表明随着肿瘤的逐渐消退DC-OVA功能逐渐下降,分泌的IL-12也随之减少,趋于恢复至常态。
综上所述,DC-OVA疫苗特异性地杀伤了LLC-OVA肿瘤细胞,且有效地杀伤了其中的肿瘤干细胞,在体内具有强大的抗肿瘤效应,包括肿瘤治疗及预防性作用,并且有可能降低肿瘤复发风险。
[1] Mostafa AA, Morris DG. Immunotherapy for lung cancer: Has it finally arrived?[J]. Front Oncol, 2014,4: 288.
[2] Frankenberger B, Schendel DJ. Third generation dendritic cell vaccines for tumor immunotherapy[J]. Eur J Cell Biol, 2012,91(1): 53-58.
[3] Mody N, Dubey S, Sharma R, et al. Dendritic cell-based vaccine research against cancer[J]. Expert Rev Clin Immunol, 2015,11(2): 213-232.
[4] 陈帅,李浩博,李牧,等.靶向树突状细胞的肿瘤疫苗OVA慢病毒载体构建及其体外抗肿瘤效应[J].同济大学学报: 医学版,2012,33(1): 13-23.
[5] Hu B, Dai B, Wang P. Vaccines delivered by integration-deficient lentiviral vectors targeting dendritic cells induces strong antigen-specific immunity[J]. Vaccine, 2010,28(41): 6675-6683.
[6] Pham W, Kobukai S, Hotta C, et al. Dendritic cells: therapy and imaging[J]. Expert Opin Bio Ther, 2009,9(5): 539-564.
[7] Janikova M, Skarda J, Dziechciarkova M, et al. Identification of CD133+/nestin+ Putativecancer stem cells in non-small cell lung cancer[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2010,154(4): 321-326.
[8] Kim HS, Yoo SY, Kim KT, et al. Expression of the stem cell markers CD133 and nestin in pancreatic ductal adenocarcinoma and clinical relevance[J]. Int J Clin Pathol, 2012,5(8): 754-761.
[9] Qin Q, Sun Y, Fei M, et al. Expression of Putative stem marker nestin and CD133 in advanced serous ovarian cancer[J]. Neo Plasma, 2012,59(3): 310-315.
[10] Dahlrot RH, Hansen S, Jensen SS, et al. Clinical value of CD133 and nestin in patients with glioma: a population-based study[J]. Int J Clin Exp Pathol, 2014,7(7): 3739-3751.
Anti-tumor effect of DC-OVA vaccine in nude mice
CHENXiao,ZHOUWei,WANGFang-ce,WANGLong,JIANGTao,ZHAOPei-lin
(Dept. of Histology & Embryology, Medical College, Tongji University, Shanghai 200092, China)
Objective To prepare DC-OVA vaccine system and to investigate its anti-tumor effect in Lewis lung cancer bearing nude mice. Methods Ovalalbumin(OVA) plasmid was transfected into dendritic cells(DC) to construct DC-OVA and cytotoxic T cells were activated by DC-OVA. The DC-OVA vaccine system was prepared. Lewis lung cancer cells+OVA were inoculated in nude mice, and the tumor-bearing(LLC-OVA) nude mice were treated with DC-OVA. The tumor growth was measured by vernier caliper; the expression of CD11c, OVA and CD3 in mice spleen, the expression of CD3, Nestin and CD133 in tumor tissue were detected by immunohistochemistry(IHC); serum IL-12 in nude mice was measured by ELISA. Results Compared with control group, vaccine prevention group presented significant inhibition effect on tumor growth(P<0.05). Compared with control group the tumor size was significantly smaller in vaccine treatment group(P<0.001). The tumor-inhibition effect in nude mice with 3-time treatment was more marked than that with one-time treatment(P<0.05). In week 4 compared with control group, the expression of CD3 in vaccine treatment group was higher and expression of Nestin and CD133 was lower(P<0.05). The serum IL-12 in vaccine treatment group was significantly increased(P<0.001) at week 4; however, serum IL-12 in treatment group at week 8 was lower than that in treatment group at week 4 and control group at week 8(bothP<0.001). Conclusion DC-OVA vaccine system can prevent and treat tumor-bearing nude mice, and it is effective in inhibiting tumor stem cells expressing Nestin and CD133.
dendritic cells; lung cancer cell; DC vaccine; tumor immunotherapy; nude mice
10.16118/j.1008-0392.2015.04.001
2015-01-22
上海市教委科研创新重点项目(08ZZ19)
陈 晓(1987—),女,硕士研究生.E-mail: 448346726@qq.com
赵培林.E-mail: plzhao@yahoo.com
R 73
A
1008-0392(2015)04-0001-06

