Kex2蛋白酶在毕赤酵母中的表达、纯化和性质研究
刘颖颖,王之可,李素霞
(生物反应器工程国家重点实验室,华东理工大学,上海 200237)
Kex2蛋白酶在毕赤酵母中的表达、纯化和性质研究
刘颖颖,王之可,李素霞Δ
(生物反应器工程国家重点实验室,华东理工大学,上海 200237)
目的 研究Kex2(EC.3.4.21.61)蛋白酶在毕赤酵母中的重组表达、纯化和部分性质。方法 Kex2基因整合进pPIC9K质粒中,通过电转构建重组毕赤酵母GS115-Kex2,G418筛选多拷贝子,甲醇诱导得到目的蛋白。通过强阴离子交换层析Q-FF对重组蛋白进行纯化,对纯化后的蛋白进行酶学性质研究。结果 通过毕赤酵母表达可以得到具有活性的重组Kex2蛋白酶,以Boc-Gln-Arg-Arg-pNA(叔丁氧羰-谷氨酰胺-精氨酸-精氨酸-对硝基苯胺,Boc-QRR-pNA)为底物检测酶的活性,发酵外液活性达270U/L,SDS-PAGE检测目的蛋白的分子量为67kDa,经Q-FF纯化后,目的蛋白的活性回收率为84%。重组Kex2蛋白酶在pH 5.0~6.0之间稳定,pH 9.0时活性最高。在25 ℃,pH 5.0条件下放置12 h活力可保持88.2%。以Boc-QRR-pNA为底物,测得重组Kex2蛋白酶的Km值为0.0167 mmol/L,Vmax值为333.3 μmol/min。结论 利用毕赤酵母可成功表达分泌Kex2蛋白,经Q-FF纯化后可得到较纯的Kex2蛋白酶。
Kex2;毕赤酵母;表达; 纯化; 稳定性
Kex2蛋白酶是酵母自身编码的一种前体加工酶,是一个钙离子依赖型的丝氨酸蛋白酶,属于枯草杆菌蛋白酶家族,其专一性地切割Lys-Arg, Arg-Arg, Pro-Arg的C末端肽键[1-3]。Kex2负责在毕赤酵母中重组表达蛋白的分泌和成熟,通过在酵母表达的外源蛋白前体中加入Kex2的识别位点,实现对外源蛋白前体进行加工的目的。如王秀青[4]等研究在毕赤酵母中表达抗菌肽天蚕素及其串联体,在串联体中间插入Kex2识别的双碱基氨基酸残基,可得到分泌表达的单体抗菌肽。Screenivas[5]等在毕赤酵母中,将单链甘精胰岛素前体和Kex2蛋白酶共表达,可得到分泌表达的甘精胰岛素。 由于Kex2蛋白酶识别位点的特异性,其在重组蛋白的后加工中具有潜在的用途,如在甘精胰岛素Lantus的制备过程中使用Kex2蛋白酶取代胰蛋白酶,可以提高甘精胰岛素回收率,而大量获得较纯的Kex2是其应用的前提。但目前为止,对于活性Kex2蛋白酶高表达和性质的研究报道还相对较少。
天然Kex2蛋白酶由814个氨基酸残基组成,包括信号肽(1-19残基),前肽(20-113残基),催化结构域(114-410残基),P结构域(411-624残基),Thr/Ser富集区(625-679残基),跨膜区(679-699残基),C端尾巴(700-814残基)[6]。研究表明[7],缺少Thr/Ser富集区的Kex2分子活性与天然分子相同。Kex2在酿酒酵母和昆虫细胞中已得到成功表达,但表达量均很低[8-10]。艾敏榕等[11]研究了去除C端201个氨基酸残基(跨膜区和C端尾巴)的Kex2肽段在甲醇酵母中的分泌表达,在发酵上清液中检测到酶活,并且观察到该Kex2肽段在培养基中的自降解,但未成功纯化得到Kex2蛋白。
本文利用毕赤酵母表达系统,选择了含有Kex2前肽,催化结构域和P结构域的20-599位氨基酸残基序列,同时利用毕赤酵母α-因子的信号肽取代原Kex2的信号肽(1-19残基),对Kex2(20-599残基)进行表达,获得了较高表达量的活性Kex2,并通过纯化获得电泳纯的Kex2,并对其稳定性进行了研究,为其应用和大量生产奠定了基础。
1 材料与方法
1.1 质粒、菌株、和试剂 含有Kex2基因的重组质粒pPIC9K,宿主细胞毕赤酵母GS115均由本实验室保存,蛋白分子量标准购自Takara,检测蛋白酶活性所用底物Boc-Gln-Arg-Arg-pNA购自Sigma,其它试剂均为国产分析纯。
1.2 重组Kex2蛋白酶的表达和鉴定 按照常规方法构建Kex2的表达菌株GS115-Kex2。取-80℃的菌株在YPD(1%酵母提取物, 2%蛋白胨, 2%葡萄糖)平板上划线,挑取单菌落到YPD试管中培养16~18 h,转接到BMGY培养基(1% 酵母提取物, 2% 蛋白胨, 1.34% YNB,100 mM 磷酸钾缓冲液pH 5.0,1%甘油)中,培养16~18 h,3000 r/min离心20 min去上清,菌体转移到BMMY培养基(1% 酵母提取物, 2% 蛋白胨, 1.34% YNB,100 mM 磷酸钾缓冲液pH 5.0,1%甲醇)中,每隔24 h添加1%的甲醇,诱导72 h。3000 r/min离心20 min,上清液进行下一步纯化。
1.3 重组Kex2蛋白酶的纯化 上清液对10 mM NaAc-HAc pH 5.0缓冲液透析,每4h更换透析外液,共透析4次。透析后的样品利用Q-FF(3 cm×30 cm)离子交换柱纯化,用10 mM NaAc-HAc pH 5.0平衡柱子至基线,之后用含0~500 mM的NaCl的缓冲液进行连续梯度洗脱,分部收集。洗脱后测定各收集管中液体的A280和蛋白酶活性,绘制洗脱曲线。SDS-PAGE鉴定蛋白纯度,根据电泳结果,合并蛋白条带单一的收集管,超滤除盐,-20 ℃保存。
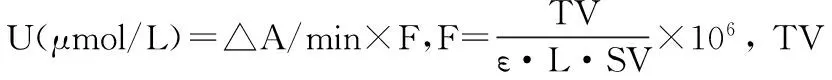
1.5 重组Kex2蛋白酶性质研究
1.5.1 最适pH和 pH稳定性 分别配制缓冲液如下: 50 mM的NaAc-HAc(pH 3~6),Tris-HCl(pH 7~8),Gly-NaOH(pH 9~11),所有缓冲液均25 ℃配制。
最适pH的测定方法:用上述pH 3~11的缓冲液分别配制底物Boc-QRR-pNA溶液,测定纯化后的Kex2蛋白酶在不同pH下的活性,结果表示为占最高酶活的百分比。
考察学习中,考察团一行先后来到长治市武乡八路军纪念馆和平顺县,进行重温入党誓词,并听全国劳动模范申纪兰老人上党课,接受爱国主义教育。同时结合此行考察重点,考察团还对长治市几个乡、县的种植、养殖合作社、集体经济示范村、乡村旅游示范点的运营管理、农村“两委”建设、民主管理、村委会民主监督等典型经验进行了学习和交流。对长治市城区相关社区基层党建和社会管理工作进行了深入了解。
pH稳定性的测定方法:Kex2纯酶液分别在pH 3~11 缓冲液中稀释20倍,于25 ℃下温浴,分别在1、2、4、8、12 h取样按常规方法测定酶活,以水浴前酶液的初始活性作为100%,计算残余率。
1.5.2 最适温度和温度稳定性 最适温度:将底物Boc-QRR-pNA分别置于4 ℃、16 ℃、25 ℃、37 ℃、45 ℃、60 ℃水浴中温育30 min,测定Kex2纯酶液在不同温度底物溶液中的反应速率,结果表示为A405随时间的变化曲线。
温度稳定性:取Kex2纯酶液分别置于16 ℃、25 ℃、37 ℃、45 ℃、60 ℃水浴中温育,在1、2、4、8、12h取样按常规方法测定酶活,以水浴前酶液的初始活性作为100%计算活性残余率。
1.5.3 Km值和Vmax的测定 用测活缓冲液(50 mM的Tris-HCl,pH 8.0,2 mM Ca2+)溶解不同浓度的测活底物Boc-QRR-pNA ,[S]:2×10-5、5×10-5、8×10-5、1×10-4、2×10-4mol/L,在405 nm波长下分别测定重组Kex2蛋白酶在不同底物浓度下的反应速率,按双倒数作图法,以1/V~1/[S]作图,得出一条直线,横轴截距为-1/Km,纵轴截距为1/Vmax。
2 结果
2.1 重组 Kex2蛋白酶的制备 GS115-Kex2菌株按照常规方法培养诱导,SDS-PAGE检测上清液中的蛋白,结果如图1A所示,泳道1为含有pPIC9K空载的GS115菌株培养外液,可见无目的蛋白,且外液中无Kex2蛋白酶活性。泳道2为GS115-Kex2菌株培养外液,可见目的蛋白为分泌型表达,在培养液中得到富集,表观分子量约为67 kDa。
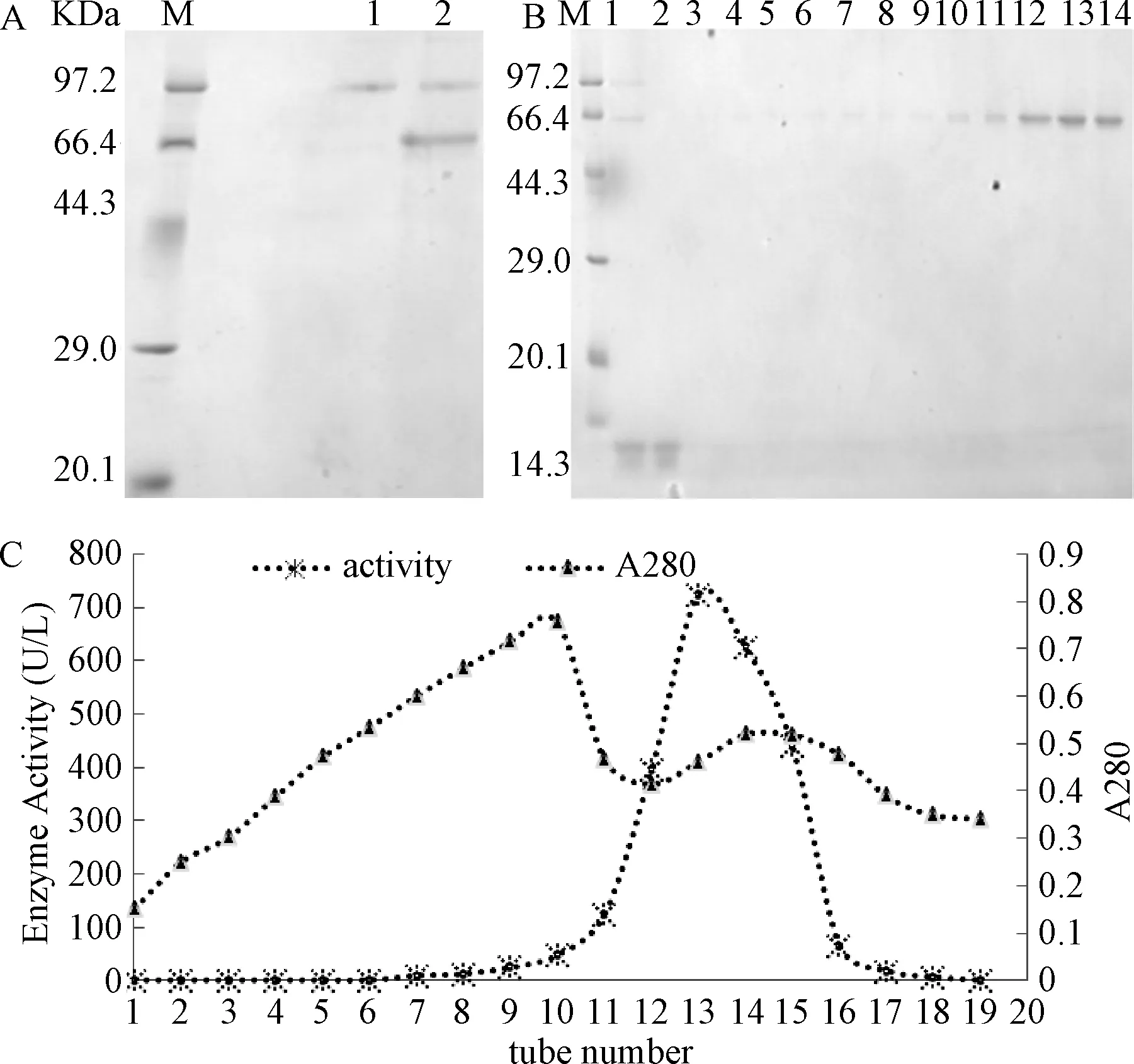
图1 Kex2蛋白酶的表达鉴定和纯化A:重组GS115-Kex2 SDS-PAGE表达鉴定 M:marker; 1:GS115含pPIC9K空载质粒诱导后细胞培养外液;2:GS115 -Kex2诱导后细胞培养外液; B:SDS-PAGE鉴定纯化样品 M:marker;1:上样液;2:流出液;3:平衡液;4~14:洗脱流出液; C:Kex2蛋白酶的洗脱曲线Fig.1 Identification and purification of Kex2 A:Identification of recombinant GS115-Kex2 by SDS-PAGE M:marker;1: contrast ; 2: GS115-Kex2; B: Detection of purification SDS-PAGE M:maker; 1:sample solution; 2: flow solution; 3: equilibrium solution; 4~14:NaCl elution; C: elution curve of Q-FF
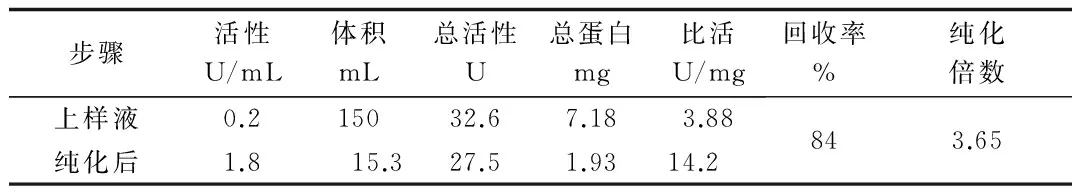
步骤活性U/mL体积mL总活性U总蛋白mg比活U/mg回收率%纯化倍数上样液0.215032.67.183.88纯化后1.815.327.51.9314.2843.65
2.2 重组 Kex2蛋白酶性质研究
2.2.1 最适pH和pH稳定性 最适pH检测结果见图2A。在pH 5.0以下,重组Kex2蛋白酶没有活性,pH 5.0~pH 6.0之间活性升高65%。在pH7.0~9.0之间能够保持较高的活性,在pH 9.0时活性达到最高,随后活性开始降低,在pH11仍有20%以上的活性。
pH稳定性结果见图2B。过酸或过碱都会造成Kex2蛋白酶的严重失活。重组Kex2蛋白酶在pH 3.0、10.0、11.0下1 h内均完全失活。在pH 4.0~8.0之间,酶失活较慢,1h内酶活残余率都保持在80%以上。温浴12 h之后,Kex2在pH≤4,pH≥8时,酶活的残余率均低于20%,几乎全部失活。在pH5.0~7.0之间,Kex2蛋白酶较为稳定,在pH 6.0时Kex2在25 ℃可以保持12 h活性不降低,这一条件适合酶液的保存。
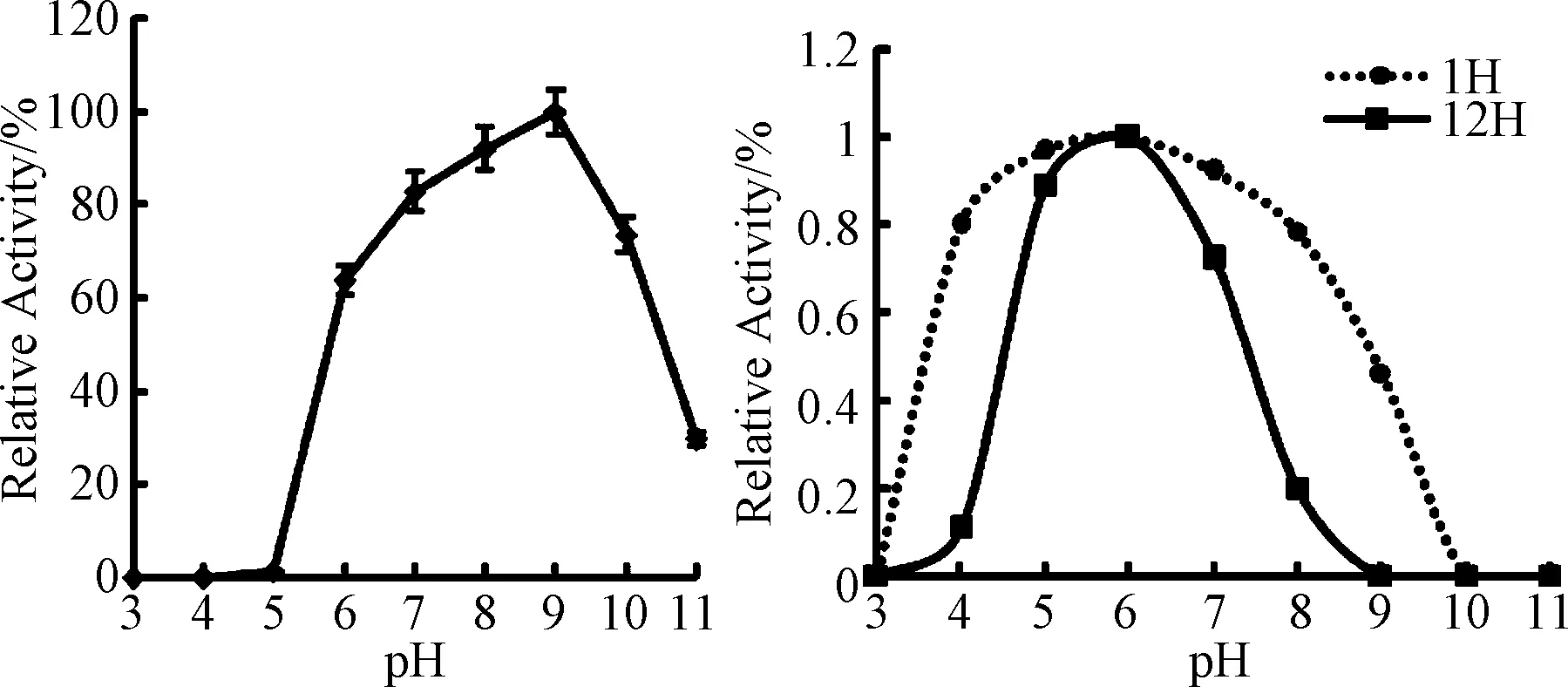
图2 重组Kex2蛋白酶最适pH(A) 和pH稳定性(B)Fig.2 Optimal pH of recombinant Kex2(A) and its pH stability (B)
2.2.2 重组 Kex2蛋白酶最适温度和温度稳定性 将底物分别置于4 ℃、16 ℃、25 ℃、37 ℃、45 ℃、60 ℃水浴中温育30 min,加入Kex2的纯酶液测活。结果显示,随着底物温度的升高,测得酶的反应速率增大。在测活的5 min内,均能保持良好的线性关系。
温度稳定性研究结果见图3。16 ℃条件下Kex2蛋白酶相对最为稳定,12 h内酶活几乎不损失;25 ℃温育12 h后活性尚能残余88.2%;随温度的升高,重组Kex2蛋白酶分子的活性降低速率也随之加快,这可能与Kex2蛋白酶在温度高的情况下,产生自降解所致;45 ℃条件下12 h内酶活残余有40%。
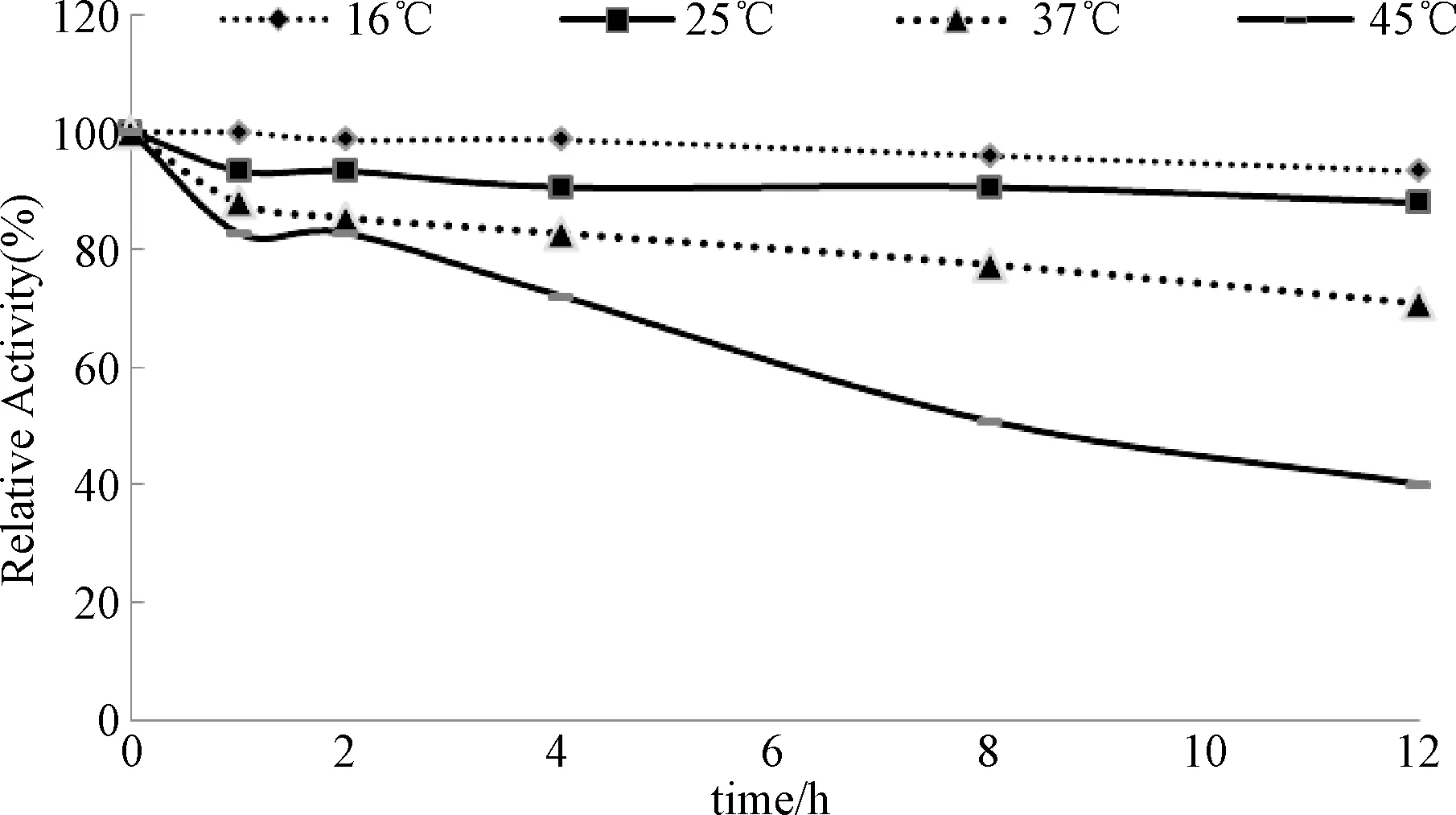
图3 Kex2蛋白酶温度稳定性Fig.3 The temperature stability of Kex2
2.2.3 重组Kex2蛋白酶Km值和Vmax的测定 依据 1/[S]~1/V 双倒数作图法,得到直线方程y=5×10-5x+0.003,其中直线的R2=0.995,横轴截距为-1/Km,重组Kex2蛋白酶对底物Boc-QRR-pNA的Km值为0.0167 mmol/L,Vmax值为333.3 μmol/min。
3 讨论
我们曾尝试在大肠杆菌体系中表达Kex2,表达方式为不溶性的包涵体,尝试利用变复性的方法得到有活性的Kex2蛋白酶,但均未成功。进一步分析Kex2蛋白的氨基酸序列和高级结构发现,Kex2蛋白分子中含有7个半胱氨酸,其中仅4个形成了二硫键,其他3个半胱氨酸为自由的半胱氨酸,这可能对复性过程中二硫键的正确形成造成阻碍[13],使得很难通过复性得到有活性的Kex2蛋白酶。
本研究利用毕赤酵母的α因子的信号肽取代原Kex2的信号肽,获得了较高的外分泌表达的可溶的活性Kex2,培养外液活性高达270U/L。SDS-PAGE电泳检测细胞内无未分泌的重组蛋白(SDS-PAGE结果未给出)。与之前艾敏榕[11]所得到的培养外液中活性最高为140 U/L相比,增加了约2倍。相对于Brenner[14]报道的在酿酒酵母中获得外分泌型可溶的活性蛋白酶,表达量很低的Kex2的1-614位肽段,我们的研究结果显示在毕赤酵母中的表达量和活性均显著提高,这可能与毕赤酵母的α因子的信号肽取代原Kex2的信号肽,并且毕赤酵母的甲醇诱导型的强启动子[15]等有关。
本文成功表达了Kex2蛋白,并对其进行纯化和部分性质研究,结果表明其有活性,且稳定的pH 为6.0,因此该pH也是该酶的最适pH使用范围,pH 5.0条件下稳定,但没有活性,可以在pH 5.0保存该酶,这一研究结果为重组Kex2蛋白酶的应用提供了参考。
[1] Holyoak T, Wilson MA, Fenn TD. 2.4 Å Resolution Crystal Structure of the Prototypical Hormone-Processing Protease Kex2 in Complex with an Ala-Lys-Arg Boronic Acid Inhibitor [J].Biochemistry, 2003,42(22): 6709-6718.
[2] Julius D, Blair L, Kunisawa R. Isolation of the putative structural gene for the lysine-arginine-cleaving endopeptidase required for processing of yeast prepro-α-factor [J].Cell, 1984, 37:1075-1089.
[3] Fuller RS, Sterne RE, Thorner J. Enzyme required for yeast prohormone processing [J].Annual Reviews Physiol, 1988,50(1):345-362.
[4] 王秀青,张素芳,曹瑞兵,等.抗菌肽天蚕素b基因及其串联体在毕赤酵母中的表达 [J].南京农业大学学报. 2007.3: 120-123.
[5] Sreenivas S,Krishnaiah S, Govindappa N.Enhancement in production of recombinant two-chain Insulin Glargine by over-expression of Kex2 protease in Pichia pastoris [J].Applied Microbiology and Biotechnology, 2014, 5:178-199.
[6] Kensaku M,Tomoko N.Yeast Kex2 gen encodes an endopeptidase homologous to subtilisin-like serine proteases[J].Biochemical and Biophysical research communications, 1988, 156:246-254.
[7] Fuller RS, Brake AJ, Thorner J.Intracellular targeting and structural conservation of a prohormone-processing endoprotease [J].Science,1989,246:482-485.
[8] Fuller RS, Brake AJ,Thorner J.Yeast prohormone processing enzyme (Kex2 gene product) is a Ca2+-dependent serine protease[J].Proc.Natl.Acad.Sci,1989,86:1434-1438.
[9] Wilcox CA,Fuller RS.Posttranslational processing of prohormone-cleaving Kex2 protease in the saccharomyces cerevisiae secretory pathway[J].The journal of Cell Biology,1991,115(2):297-307.
[10] Germain D, Vernet T, Boileau G,et al.Expression of the Saccharomyces cerevisiae Kex2p endoprotease in inset cells[J].Eur J Biochem 1992,204(1):121-126.
[11] 艾敏榕,杨曜中, Kex2p在甲醇酵母中的分泌表达[J]. 华东理工大学学报:自然科学版, 2002,28(2): 161-163.
[12] Wheatley JL, Holyoad T. Differential P1 arginine and lysine recognition in the prototypical proprotein convertase Kex2[J].Proc.Natl.Acad.Sci,2007,104(16): 6626-6631.
[13] Suxia L, Luosheng Z. Increasing the refolding efficiency in vitro by site-directed mutagenesis of Cys383 in rat procarboxypeptidase B[J].Enzyme and Microbial Technology,2011,49:139-145.
[14] Brenner C, Fuller RS. Structural and enzymatic characterization of purified prohormone-processing enzyme: Secreted, soluble Kex2 protease[J].Proc.Natl.Acad.Sci,1992,89:922-926.
[15] Niles AL,Haak-Frendscho M,Wheeless CJ,et al. Recombinant human mast cell tryptase beta: stable expression in Pichia pastoris and purification of fully active enzyme[J].Biotechnol Appl Biochem,1998,28:125-131.
(编校:吴茜)
Expression,purification and properties of recombinant Kex2 inPichiaPastoris
LIU Ying-ying,WANG Zhi-ke, LI Su-xiaΔ
(State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237,China)
ObjectiveTo study Kex2(EC.3.4.21.61)expression, inPichiaPastoris, purification and properties of the purified recombinant Kex2 proteinase. MethodsThe gene encoding Kex2 was cloned in pPIC9K plasmid and transformed into GS115 by electroporation.After screened recombinant yeast strain with G418, induced yeast strain with methanol and analyzed with SDS-PAGE and activity detection, the recombinant Kex2 was successfully obtained. The secreted protein was purified with anion exchange chromatography (Q-FF), and some properties of the purified recombinant Kex2 was investigated. ResultsMolecular weight of Kex2 was about 67 kDa in SDS-PAGE, total activity recovery rate of Q-FF purification was 84%. The recombinant Kex2 was stable from pH 5.0 to pH 6.0, and optimal pH of recombinant Kex2 was pH 9.0. 88.2% activity was remained at 25 ℃,pH 5.0 for 12 h .Km was 0.0167 mmol/L and Vmax was 333.3 μmol/min with Boc-Gln-Arg-Arg-pNA as substrate. ConclusionThe recombinant Kex2 is expressed successfully in Pichia yeast, and purified Kex2 is obtained after purification with anion exchange chromatography.
Kex2;PichiaPastoris; expression; purification; stability
刘颖颖,女,硕士,研究方向:分子生物学,E-mail:xsliuyingying@126.com;李素霞,通讯作者,女,副教授,研究方向:酶学及重组蛋白的变性、复性研究,E-mail:lisuxia@ecust.edu.cn。
Q 566+.9
A
1005-1678(2015)01-0037-04

