Foxp3与突变型p53在食管鳞癌中的表达及意义
郭长峰, 彭 沪, 陈远卓, 陈艳清, 庄育刚, 周书琴
(同济大学附属第十人民医院急诊医学科,上海 200072)
·基础研究·
Foxp3与突变型p53在食管鳞癌中的表达及意义
郭长峰, 彭 沪, 陈远卓, 陈艳清, 庄育刚, 周书琴
(同济大学附属第十人民医院急诊医学科,上海 200072)
目的 探讨Foxp3和突变型p53在食管鳞癌中的表达及其意义。方法 利用免疫组织化学方法对83例食管鳞癌患者的肿瘤组织标本进行Foxp3和突变型p53蛋白检测,并采用配对t检验和K-W检型对两种蛋白检测结果进行统计学分析。结果 83例食管鳞癌患者的肿瘤组织中,Foxp3和突变型p53蛋白的阳性表达率分别为59.04%、61.45%。性别和年龄方面,Foxp3和突变型p53表达差异无统计学意义(P>0.05);Foxp3和突变型p53的表达与肿瘤分化程度,浸润深度和淋巴结转移有关(P<0.01);Foxp3和突变型p53的表达呈负相关(r=-0.474,P<0.01)。结论 Foxp3和突变型p53的表达与不良预后关系密切,可能是预后不良的预测因子。
食管鳞癌; Foxp3; 突变型p53
Foxp3作为叉头样转录因子家族的重要成员之一,最初被认为是CD4+CD25+调节性T细胞(Treg)的特异性标志。野生型p53是一种核蛋白,参与细胞周期调控,DNA修复和凋亡诱导,属于抑癌基因。但在多数肿瘤中,p53发生突变,而多数突变型p53与肿瘤的发生、发展及化疗抵抗等有关[1]。目前,关于食管癌细胞中Foxp3的表达及与其他肿瘤因子关系的研究较少。本研究通过免疫组化方法,探讨Foxp3与突变型p53在食管鳞癌中的表达及其意义。
1 材料与方法
1.1 组织标本
收集同济大学附属第十人民医院2005年2月至2011年7月颈段食管鳞癌的手术切除标本83例。患者均为首次接受手术治疗的患者,术前未行放疗、化疗及免疫治疗,行常规的影像学检查。标本均于手术中取材,置于预冷的10%中性福尔马林中固定,用于免疫组织化学法检测,经医院病理医师确认病理类型均为食管鳞癌。
1.2 试剂
小鼠抗人Foxp3单克隆抗体购自Abcam公司;小鼠抗人p53单克隆抗体购自Cell Signaling Technology公司;即用型兔/小鼠通用型免疫组化试剂盒购自DAKO公司。
1.3 方法
新鲜的食管鳞癌手术组织用10%的中性福尔马林溶液固定,常规石蜡包埋、切片,切片厚4μm。切片脱蜡、水化。采用二步法进行免疫组化染色,高压锅修复法进行抗原修复(pH 10.0),用DAB显色,苏木精细胞核复染。正常兔血清代替一抗作为阴性对照,PBS作为空白对照。
1.4 结果判断
显微镜下观察良好的组织结构以及清晰的背景细胞核内出现棕黄色颗粒反应物为阳性,根据细胞着色强度和阳性细胞百分比确定Foxp3和p53表达的半定量分级: 按细胞着色强度,无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;按阳性细胞百分比,≤10%为0,10%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分;两者的乘积,0分为阴性,≥1分为阳性。
1.5 统计学处理
采用SPSS 16.0进行统计分析。组间比较满足正态性和方差齐时采用配对t检验,不满足条件者采用非参数K-W检验。P<0.05为差异有统计学意义。
2 结 果
2.1 Foxp3蛋白在食管鳞癌组织中表达
Foxp3蛋白在食管鳞癌实质细胞中呈灶性弥漫性分布,主要表达于食管鳞癌细胞中,定位于细胞核(图1)。颈段食管鳞癌实质细胞Foxp3表达的阳性率为59.04%(49/83)。在性别和年龄方面,Foxp3表达差异无统计学意义(P>0.05);在病理分级高、中、低分化组中,阳性率依次降低,组间差异有统计学意义(P=0.007);黏膜内和浅肌层组的阳性率高于全层组,差异有统计学意义(P<0.0001);无转移组阳性率高于有转移组,差异有统计学意义(P<0.0001),见表1。
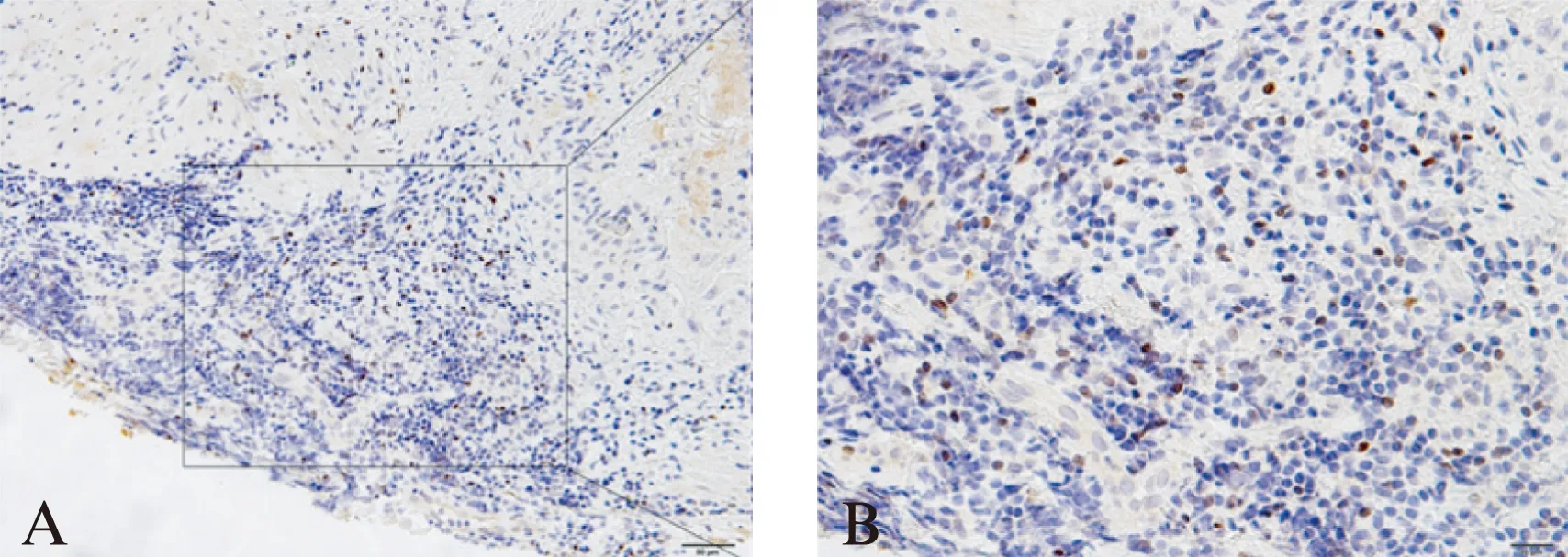
图1 Foxp3在食管鳞癌组织中的表达Fig.1 Expressions of Foxp3 protein in esophageal squamous cell carcinoma tissues (A×200,B×400)
2.2 p53蛋白在食管鳞癌组织中表达
p53蛋白主要表达于食管鳞癌细胞中,定位于细胞核(图2)。颈段食管鳞癌实质细胞p53表达的阳性率为 61.45%(51/83)。在性别和年龄方面,Foxp3表达差异无统计学意义(P>0.05);在病理分级高、中、低分化组中,阳性率依次升高,组间差异有统计学意义(P=0.001);黏膜内和浅肌层组阳性率低于全层组,差异无统计学意义(P=0.074>0.05);有淋巴结转移组的阳性率高于无淋巴结转移组,差异有统计学意义(P=0.005),见表1。

图2 p53在食管鳞癌组织中的表达Fig.2 Expressions of p53 protein in esophageal squamous cell carcinoma tissues (A×200,B×400)
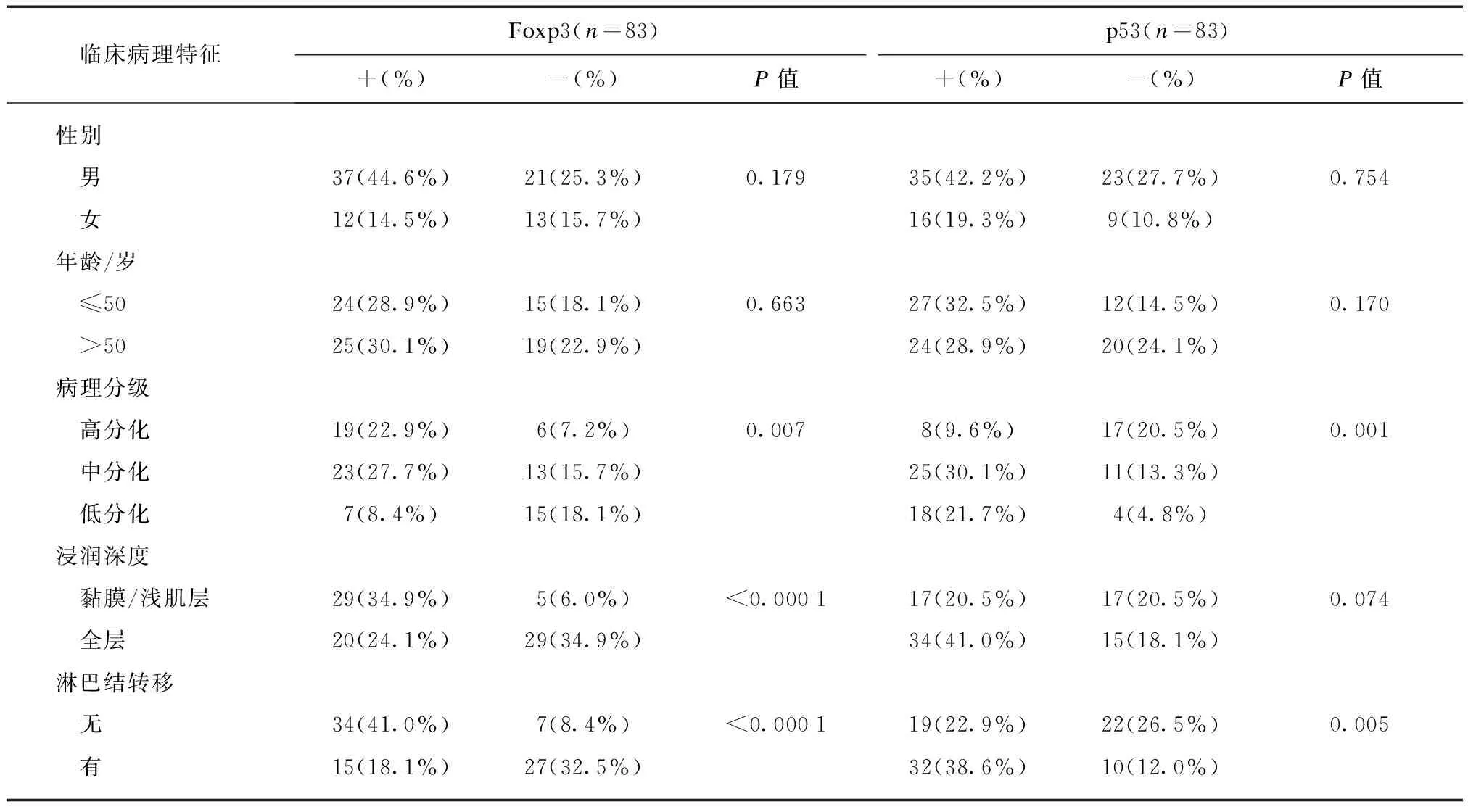
临床病理特征Foxp3(n=83)p53(n=83)+(%)-(%)P值+(%)-(%)P值性别 男37(44.6%)21(25.3%)0.17935(42.2%)23(27.7%)0.754 女12(14.5%)13(15.7%)16(19.3%)9(10.8%)年龄/岁 ≤5024(28.9%)15(18.1%)0.66327(32.5%)12(14.5%)0.170 >5025(30.1%)19(22.9%)24(28.9%)20(24.1%)病理分级 高分化19(22.9%)6(7.2%)0.0078(9.6%)17(20.5%)0.001 中分化23(27.7%)13(15.7%)25(30.1%)11(13.3%) 低分化7(8.4%)15(18.1%)18(21.7%)4(4.8%)浸润深度 黏膜/浅肌层29(34.9%)5(6.0%)<0.000117(20.5%)17(20.5%)0.074 全层20(24.1%)29(34.9%)34(41.0%)15(18.1%)淋巴结转移 无34(41.0%)7(8.4%)<0.000119(22.9%)22(26.5%)0.005 有15(18.1%)27(32.5%)32(38.6%)10(12.0%)
2.3 食管鳞癌中Foxp3和p53表达相关性分析
83例食管鳞癌患者中,Foxp3阳性表达49例,其中p53阳性表达17例;在34例Foxp3阴性患者中,有23例p53阳性表达。用Spearman法进行相关性检验,在食管鳞癌中Foxp3与p53表达呈负相关(r=-0.474,P<0.001),见表2。

表2 食管癌组织中Foxp3和p53表达相关性分析
3 讨 论
2001年,Brunkow等[2]首次报道了叉头转录因子Foxp3。研究[3-4]发现其对Treg的发育及抑制功能获得起着重要的作用,是Treg获得免疫调节特性的关键性转录因子。以往大部分的研究[5]都聚焦到Foxp3的表达和调节Treg细胞。目前,许多研究显示Foxp3在肿瘤细胞上有所表达,并且对于调控局部免疫反应和促进肿瘤的免疫逃逸发挥着至关重要的作用。但是因为关于Foxp3在肿瘤细胞上的功能研究甚少,许多问题还存在着争议。即使在同一种肿瘤上,一些研究结果仍然是不一致的。目前为止,关于肿瘤细胞高表达Foxp3影响肿瘤发展的机制仍然不是很清楚。Hintz等[6]报道显示,在胰腺癌中Foxp3表达阳性的癌细胞可能具有Treg样的免疫抑制功能,从而逃避死亡。另一方面,Merlo等[7]报道提示,Foxp3上调与肿瘤转移潜能相关,而不是免疫抑制反应。还有一些研究[8]发现在乳腺癌中,Foxp3作为一些特异性的乳腺癌原癌基因的联合抑癌基因。
p53是迄今为止发现的与人类肿瘤相关性最高的一种基因,目前研究较为成熟。它的表达能诱导生长抑制和细胞凋亡,其功能缺失或基因突变将导致细胞周期失去正常的调控,进一步导致细胞生长失去控制,促使恶性肿瘤形成。p53基因分为野生型和突变型两种,其产物也有野生型和突变型。野生型p53蛋白极不稳定,半衰期仅数分钟,并具有反式激活功能和广谱的肿瘤抑制作用[1]。突变型p53蛋白稳定性增加,半衰期延长,可被免疫组化方法检测出来。Yamasaki等[9]在食管癌中的研究提示,突变型p53损害其DNA结合性和转录因子功能,发挥癌基因的作用,能导致细胞周期失控、肿瘤侵袭性增强,加速肿瘤的进程。随着人们对p53基因信号通路与肿瘤发生机制研究的深入,尤其是综合探究信号通路中关键基因多态位点与肿瘤发生、分期及预后转移的相关性,将极有助于揭示肿瘤病因,并为特异性肿瘤标志物的产生提供实证,从而也为肿瘤的早期诊断及临床特异性的治疗奠定坚实可靠的基础。
在本研究中,Foxp3蛋白在食管鳞癌组织中表达阳性率为59.04%(49/83),Foxp3表达与肿瘤分化程度、浸润深度和淋巴结转移密切相关;突变型p53蛋白在食管鳞癌组织中表达阳性率为61.45%(51/83),突变型p53表达与食管鳞癌分化程度和淋巴结转移密切相关,高分化的癌组织中p53低表达,而在低分化的癌组织中p53是高表达的,这个结果与Murtaza等[10]报道一致。可见,Foxp3和p53对于食管鳞癌预后的重要影响,两者之间的相关性研究对于揭示食管鳞癌的病因以及早期诊断和治疗都有重要意义。本研究发现,食管鳞癌组织中Foxp3的表达与突变型p53的表达水平呈现显著的负相关性。Jung等[11]报道,正常野生型p53肿瘤抑制活性对于肿瘤细胞Foxp3的表达至关重要,Foxp3对于p53介导的细胞生长抑制起到重要作用,而不是影响细胞凋亡。Won等[12]报道,肿瘤细胞来源的Foxp3的表达与p53介导的细胞周期阻滞相关,同时也依赖于正常野生型p53的调节功能。以上结果初步提示食管鳞癌肿瘤细胞表达的Foxp3可能是潜在的抑癌基因,p53基因的突变影响了Foxp3的表达。Foxp3和p53一定程度上可作为预后不良预测因子。Foxp3是否可能成为食管鳞癌治疗的新靶标,仍需要进一步的深入探讨。
[1] Muller PA, Vousden KH. Mutant p53 in cancer: new functions and therapeutic opportunities[J]. Cancer Cell, 2014,25(3): 304-317.
[2] Brunkow ME, Jeffery EW, Hjerrild KA, et al. Disruption of a new forkhead/winged-helix protein, scurfin,results in the fatal lymphoproliferative disorder of the scurfy mouse[J]. Nat Genet, 2001,27(1): 68- 73.
[3] Hori S, Sakaguchi. Foxp3: a critical regulator of the development and function of regulatory T cells[J]. Microbes Infect, 2004,6(8): 745-751.
[4] Chen W, Jin W, Hardegen N, et al. Conversion of peripheral CD4+CD25-naive T cells to CD4+CD25+regulatory T cells by TGF-β induction of transcri-ption factor Foxp3[J]. J Exp Med, 2003,198(12): 1875- 1886.
[5] Ziegler SF, Buckner JH. Foxp3 and the regulation of Treg/Th17 differentiation[J]. Microbes Infect, 2009,11(5): 594-598.
[6] Hinz S, Pagerols-Raluy L, Oberg HH, et al. Foxp3 expression in pancreatic carcinoma cells as a novel mechanism of immune evasion in cancer[J]. Cancer Res, 2007,67(17): 8344-8350.
[7] Merlo A, Casalini P, Carcangiu ML, et al. Foxp3 expression and overall survival in breast cancer[J]. J Clin Oncol, 2009,27(11): 1746-1752.
[8] Zuo T, Wang L, Morrison C, et al. Foxp3 is an X-linked breast cancer suppressor gene and an important repressor of the HER-2/ErbB2 oncogene[J]. Cell, 2007,129(7): 1275-1286.
[9] Yamasaki M, Miyata H, Fujiwara Y, et al. p53 genotype predicts response to chemotherapy in patients with squamous cell carcinoma of the esophagus[J]. Ann Surg Oncol, 2010,17(2): 634-642.
[10] Murtaza I, Mushtaq D, Margoob MA, et al. A study on p53 gene alterations in esophageal squamous cell carcinoma and their correlation to common dietary risk factors among population of the Kashmir valley[J]. World J Gastroenterol, 2006,12(25): 4033-4037.
[11] Jung DJ, Jin DH, Hong SW, et al. Foxp3 expression in p53-dependent DNA damage responses[J]. J Biol Chem, 2010,285(11): 7995-8002.
[12] Won KY, Kim HS, Sung JY, et al. Tumoral Foxp3 has potential oncogenic function in conjunction with the p53 tumor suppressor protein and infiltrated Tregs in human breast carcinomas[J]. Pathol Res Pract, 2013,209(12): 767-773.
Expression of Foxp3 and mutated p53 in esophageal squamous cell carcinomas and its significance
GUOChang-feng,PENGHu,CHENYuan-zhuo,CHENYan-qing,ZHUANGYu-gang,ZHOUShu-qin
(Dept. of Emergency, Tenth People’s Hospital, Tongji University, Shanghai 200072, China)
Objective To investigate the expressions of Foxp3 and mutated p53 in esophageal squamous cell carcinoma and its significance. Methods Immunohistochemistry was used to detect the expressions of Foxp3 and mutated p53 in tissues of 83 cases with esophageal squamous cell carcinoma. The differences of two proteins were tested usingttest for parametric data or usingK-Wtest for nonparametric data. Results Foxp3 and mutated p53 expressions were positive in 59.0%(71/83) and 61.5%(51/83) cases of esophageal squamous cell carcinoma, respectively. The expressions of Foxp3 and mutated p53 were significantly correlated with differentiation, depth of tumor infiltration and lymph node metastasis (P<0.01), but not correlated with gender and age of patients (P>0.05). There was negative correlation between the expressions of Foxp3 and mutated p53 in esophageal squamous cell carcinoma with a Spearman correlation coefficient of -0.474(P<0.01). Conclusion The expression of Foxp3 and p53 protein is correlated with the poor prognosis and may serve as a prognostic factor for esophageal squamous cell carcinoma.
esophageal squamous cell carcinoma; Foxp3; mutational p53
10.16118/j.1008-0392.2015.01.007
2014-07-31
郭长峰(1985—),男,主治医师,硕士研究生.E-mail: shgcf2007@sina.com
彭 沪.E-mail: 18917683122@189.cn
R 735.1
A
1008-0392(2015)01-0029-04

