Dickkopf-4激活Wnt/PCP通路促进肾透明细胞癌的增殖及侵袭
胡光辉, 赖 鹏, 刘 欢, 罗 明, 张海民, 许云飞
(同济大学附属第十人民医院泌尿外科,上海 200072)
·基础研究·
Dickkopf-4激活Wnt/PCP通路促进肾透明细胞癌的增殖及侵袭
胡光辉, 赖 鹏, 刘 欢, 罗 明, 张海民, 许云飞
(同济大学附属第十人民医院泌尿外科,上海 200072)
目的 研究Dickkopf-4(DKK4)在肾透明细胞癌(clear cell Renal cell carcinoma, ccRCC)组织中的表达及其与ccRCC生物学行为、临床分期分级和预后之间的的相关性。方法 采用RT-PCR、免疫组织化学及Western印迹法比较42例肾癌和癌旁正常组织中DKK4的表达水平,观察其表达与肿瘤大小、临床分期、分级之间的关系;使用pCMV6-DKK4表达载体转染786-O和A498人肾透明细胞癌细胞,检测、观察转染后的肿瘤细胞的增殖活性、侵袭力及细胞凋亡水平,检测Wnt/β-Catenin(β-Catenin、Cyclin D1)及Wnt/Planar Cell Polarity信号通路(JNK、Rac1)蛋白表达。结果 28例(66.7%)肾癌组织中,DKK4的表达明显高于正常组织,其表达水平与肿瘤病理分级分期和临床特征之间无明显相关(P>0.05);过表达DKK4的肾癌细胞株的增殖活性及侵袭力明显增强;细胞内Wnt经典通路蛋白β-Catenin表达下调而Cyclin D1表达上调;Wnt/PCP通路下游蛋白JNK、Rac1表达上调。结论 Wnt/β-Catenin通路抑制剂DKK4通过激活Wnt/PCP非经典通路促进肾癌细胞增殖,增强肾癌细胞侵袭力。
DKK4; 肾肿瘤; 增殖活性; 侵袭力; Wnt/PCP
肾细胞癌(renal cell carcinoma, RCC)是常见的肾实质恶性肿瘤,约占成人恶性肿瘤的3%[1]。肾透明细胞癌(clear cell renal cell carcinoma, ccRCC)是肾癌最常见的亚型,预后较差。Wnt蛋白参与的信号通路在胚胎发育、细胞增殖、再生及自我更新中有着极其重要的作用[2],并且与肿瘤的发生发展联系密切[3-5]。Dickkopf(DKK)家族蛋白是Wnt信号通路拮抗剂,其家族有4个成员(DKK1~4),DKK1、DKK4对Wnt/β-catenin通路只起阻断作用;DKK2对Wnt/β-catenin通路既可抑制亦可激活;DKK3对该通路不起作用[6]。DKK4与ccRCC发生的相关研究报道却很少。本实验通过研究ccRCC组织DKK4的表达情况及其与临床病理特征之间的相关性,探讨DKK4对ccRCC细胞生物学行为的影响。
1 材料与方法
1.1 一般资料
选取从2001至2011年在同济大学附属第十人民医院手术切除并均经病理确诊的42例ccRCC组织标本,同时取距肿瘤边缘3cm以上的癌旁组织42例。其中男性23名,女性19名;平均年龄(59±7.8)岁。T1期11例,T2期15例,T3期7例,T4期9例。淋巴结转移阴性(pN0)34例,阳性(pN1~2)8例;远处转移阴性32例,阳性10例。所有患者均未接受放射治疗、化学治疗或者免疫治疗。
1.2 方法
1.2.1 细胞培养 786-O和A-498 ccRCC细胞株用含10%胎牛血清的RPMI 1640培养基接种于50ml培养瓶,在37℃、5% CO2孵箱中培养。实验时所用细胞均处于对数生长期且生长状态良好。
1.2.2 DKK4载体构建及转染 构建包含有人类全长DKK4的DNA片段的质粒,用pCMV6-DKK4表达载体转染人ccRCC 786-O和A-498细胞株(FuGENE HD法),建立稳定转染细胞株,以未转染DKK4的786-O和A498细胞株作为对照。选择在786-O细胞株中DKK4表达水平最高的两份,稳定克隆细胞株(Ⅰ和Ⅱ),用于后续研究。
1.2.3 细胞增殖活性检测 培养稳转DKK4后的786-O、A-498细胞株1周,采用CCK8试剂盒检测细胞增殖活性。传代后细胞培养48、72、96h,向96孔培养板每孔加入10μl CCK8(上海和元生物技术有限公司)。3~4h后,用酶标仪检测波长450nm处吸光度值(D450)。
1.2.4 细胞侵袭力检测 Matrigel胶包被Transwell小室底膜。无血清培养液重悬细胞,密度2×105/ml,取200μl加入上室,下室为含10%血清的培养液500μl,37℃温箱孵育12~18h。用棉签擦掉小室内细胞,予95%乙醇固定,0.1%结晶紫染色,洗净风干,在Leica荧光倒置显微镜200倍视野下拍照。33%冰醋酸洗脱结晶紫,用酶标仪检测波长490nm处吸光度值(D490)。实验重复3次。
1.2.5 流式细胞仪检测分析细胞凋亡水平 收集细胞,消化,离心后,PBS清洗2次,加入Binding Buffer 100 μl和FITC标记的Annexin-V(20 μg/ml)5 μl,室温避光15~20 min,再加入PI(50 μg/ml)5 μl,避光反应5min后,加入400 μl Binding Buffer。上机分析。
1.2.6 RT-PCR 使用TRIzol提取组织和细胞的总RNA,鉴定RNA纯度,Prime Script RT Master Mix (TaKaRa公司)进行反转录,PCR反应体系: 2×PCR premix 10μl,Primers 0.8μl,cDNA 1μl;反应条件: 95℃ 30s,95℃ 5s,60℃ 31s,读板,共40个循环;融解曲线分析。每个样设置3个复孔。
1.2.7 Western印迹法 Proteo JETTM细胞质和细胞核蛋白提取试剂盒提取细胞核和细胞质蛋白,RIPA裂解液提取细胞总蛋白。BCA法进行蛋白定量。取蛋白样品电泳,转膜,封闭,敷一抗(anti-DKK4、anti-β-catenin、anti-Cyclin D1、anti-JNK、anti-Rac1(1∶1000);anti-GAPDH、anti-β-actin、anti-Lamin B(1∶2000)),4℃过夜,敷二抗(1∶2000)室温反应,洗涤,显色,显影,扫描。选取Lamin B组织标本细胞核内参蛋白,β-actin作为细胞质内参蛋白,GAPDH作为体外细胞内参蛋白。
1.2.8 免疫组织化学 取已制好的石蜡切片,脱蜡、水化,修复抗原,3%H2O2溶液中孵育灭活内源性过氧化物酶活性;封闭,敷一抗anti-DKK4(1∶250)4℃过夜;室温孵育二抗(1∶400)1h,滴加链酶亲和素-过氧化物酶,室温孵育30min;加DAB显色,苏木精复染;常规脱水、透明、封片、镜检。选取200、400倍视野下拍照。
1.3 统计学处理
采用SPSS 14.0软件进行数据处理,Image Pro Plus软件分析免疫组化结果,Graphpad Prism 5.0绘图,t检验分析组间年龄差异,χ2检验分析性别差异,Spearman相关性分析DKK4表达水平与肿瘤分期、淋巴转移、远处转移以及复发、生存的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 DKK4在ccRCC和癌旁正常组织中的表达
28例ccRCC组织中,DKK4基因表达水平相对于癌旁正常组织显著上调(图1),纳入DKK4高表达组。免疫组织化学结果显示: DKK4在肾正常组织中细胞核、细胞质均有染色,主要集中在细胞核(图2)。而在肿瘤组织中,DKK4同样在胞核、胞质内均有表达,但细胞核内染色明显较细胞质以及肾正常细胞核内染色深(图3),差异有统计学意义(t=2.160,P=0.0337<0.05)。DKK4表达水平与患者性别、肿瘤分期、淋巴转移、远处转移及复发的相关性见表1。
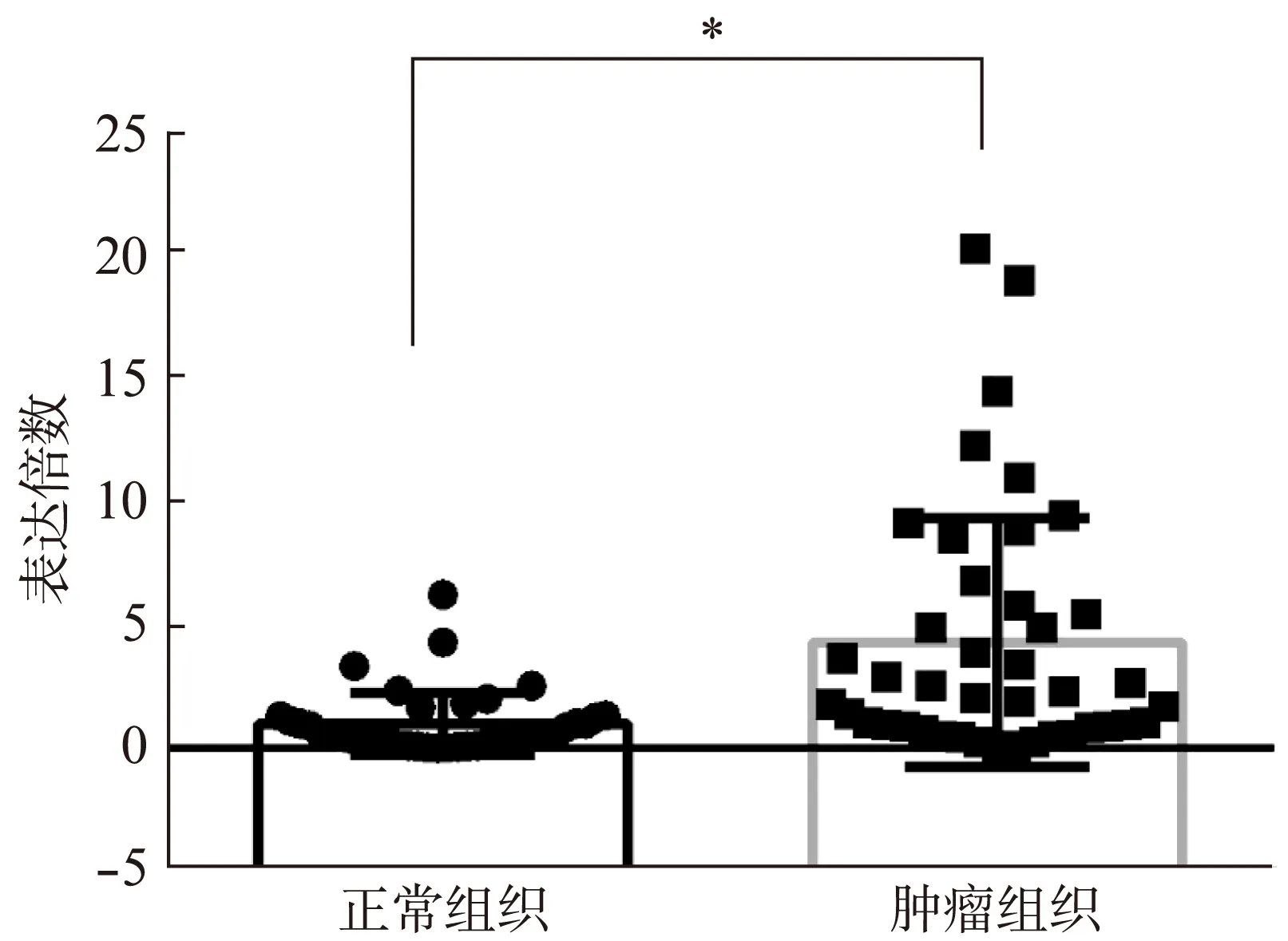
图1 DKK4 mRNA在肾透明细胞癌组织中的相对表达水平Fig.1 DKK4 mRNA expression level in clear cell renal carcinoma by RT-PCR*P<0.0001
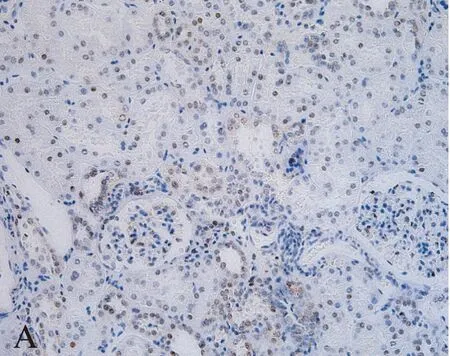
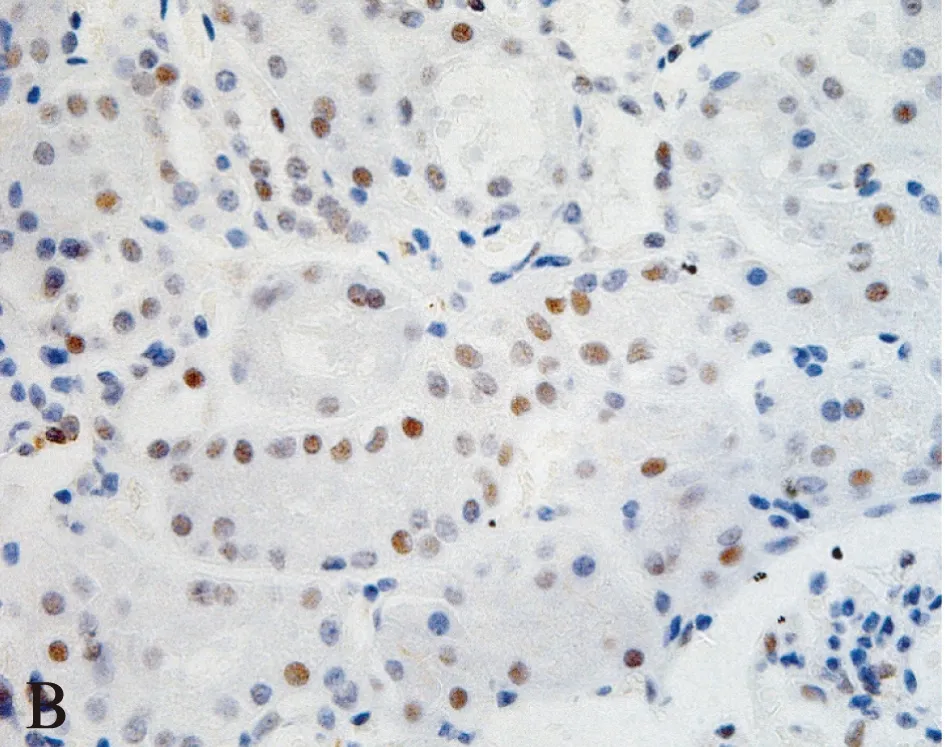
图2 正常肾脏组织中DKK4蛋白表达分析Fig.2 DKK4 protein expression in normal kidney tissues(A×200 and B×400)
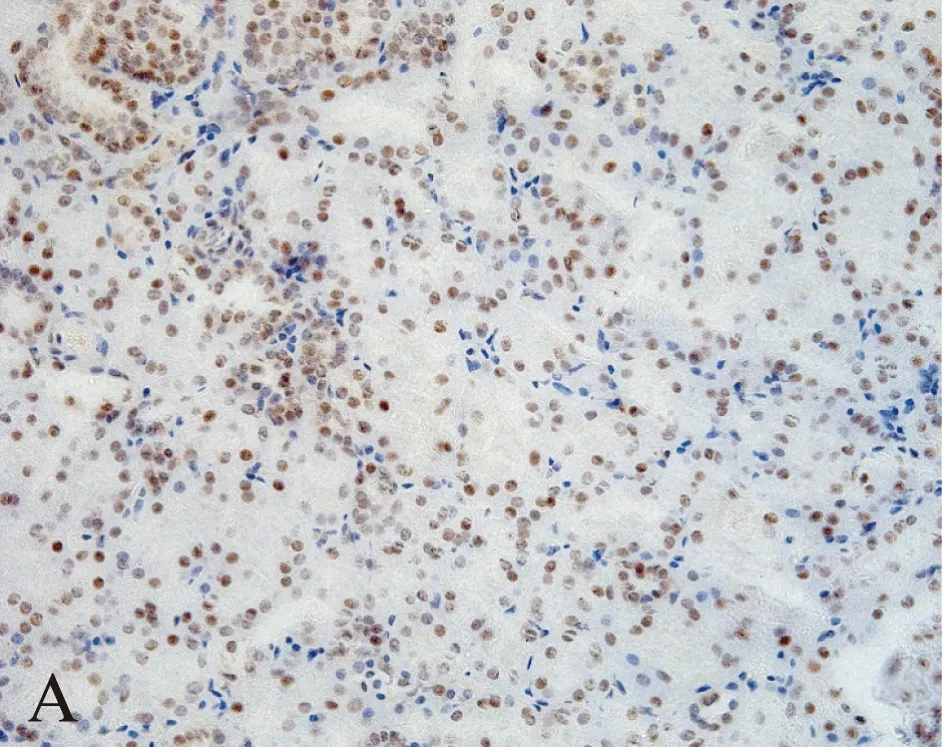
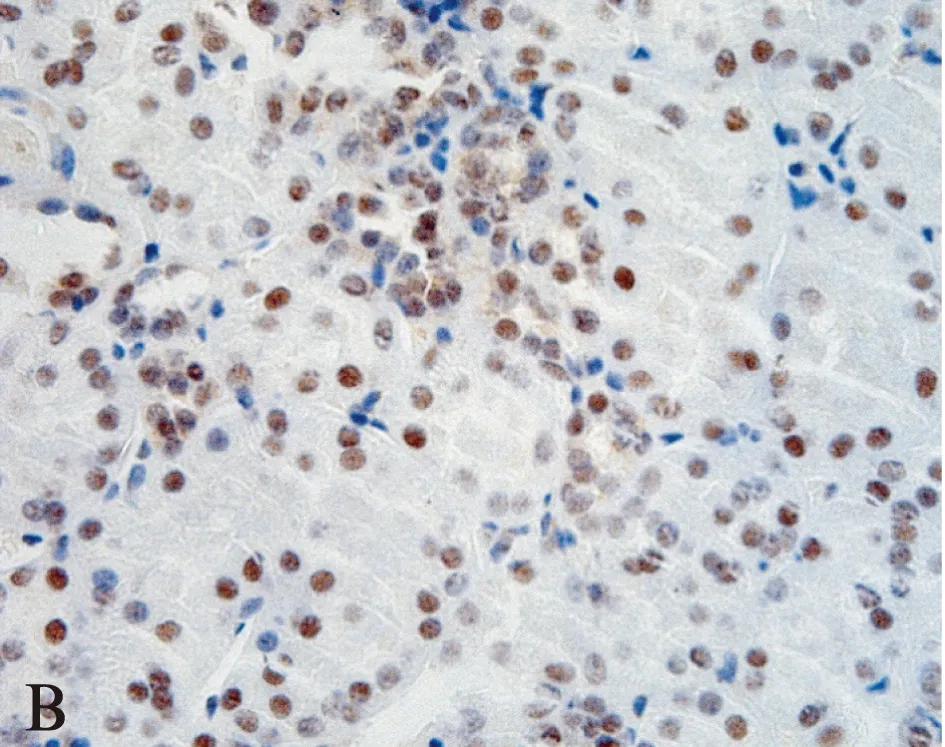
图3 肾透明细胞癌中DKK4蛋白表达分析Fig.3 DKK4 protein expression in ccRCC tissues(A×200 and B×400)
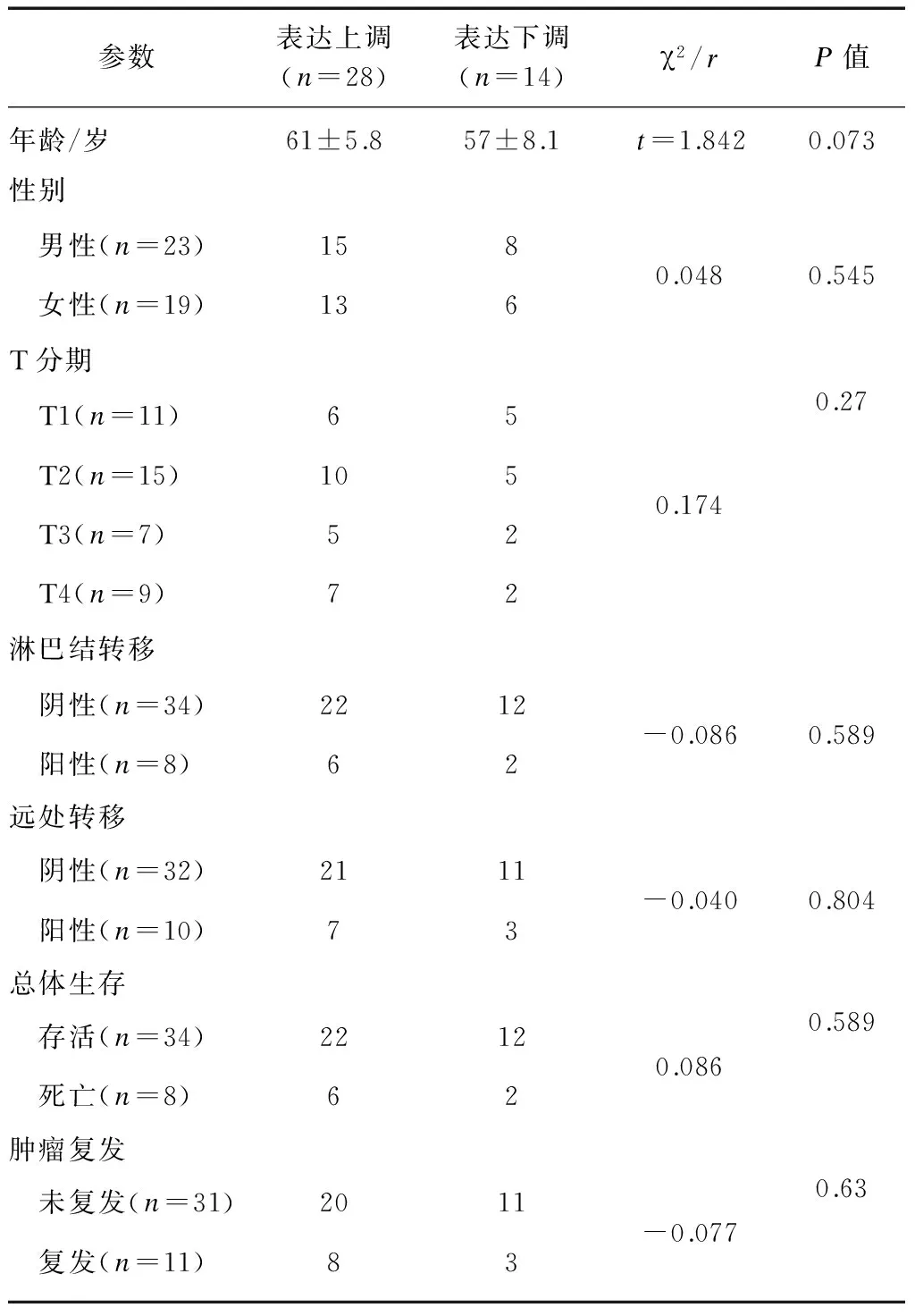
参数表达上调(n=28)表达下调(n=14)χ2/rP值年龄/岁61±5.857±8.1t=1.8420.073性别 男性(n=23)158 女性(n=19)1360.0480.545T分期 T1(n=11)65 T2(n=15)105 T3(n=7)52 T4(n=9)720.1740.27淋巴结转移 阴性(n=34)2212 阳性(n=8)62-0.0860.589远处转移 阴性(n=32)2111 阳性(n=10)73-0.0400.804总体生存 存活(n=34)2212 死亡(n=8)620.0860.589肿瘤复发 未复发(n=31)2011 复发(n=11)83-0.0770.63
2.2 转染DKK4后ccRCC细胞株活力、侵袭力及肿瘤细胞凋亡水平检测
qRT-PCR显示,786-OⅠ、786-OⅡ和A498细胞株中DKK4成功过表达(均P<0.05),见图4。细胞增殖活性及侵袭力检测显示,786-OⅠ 、786-OⅡ和A498肿瘤细胞的增殖活性及侵袭力显著高于对照组(均P<0.05),见图5~6。与对照组相比,两类肿瘤细胞组的细胞凋亡水平差异无统计学意义(P>0.05),见图7。因此,过表达DKK4促进ccRCC细胞增殖和侵袭。
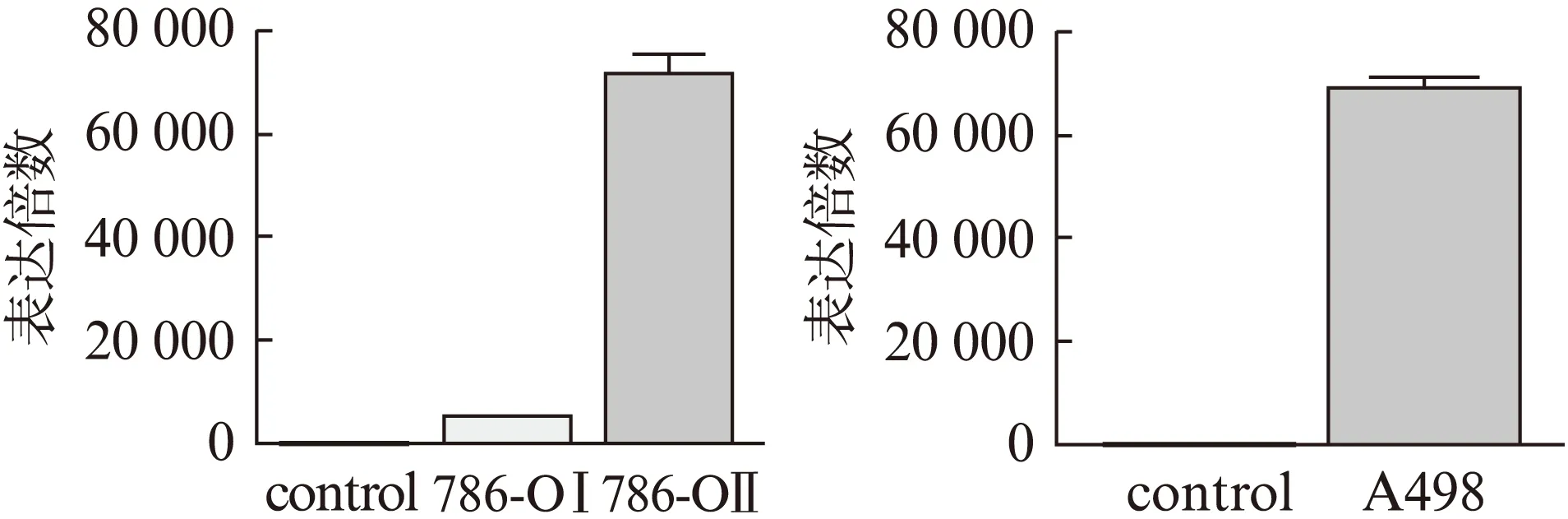
图4 DKK4在转染后肾癌细胞株中的表达Fig.4 Expression of DKK4 in transfected 786-O and A498 cells
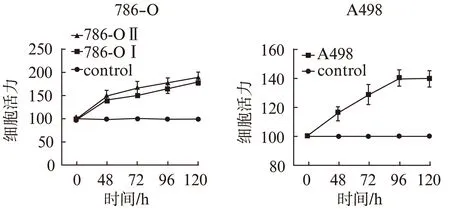
图5 转染后的肾癌细胞增殖活性Fig.5 Cell viability in transfected 786-O and A498 cells
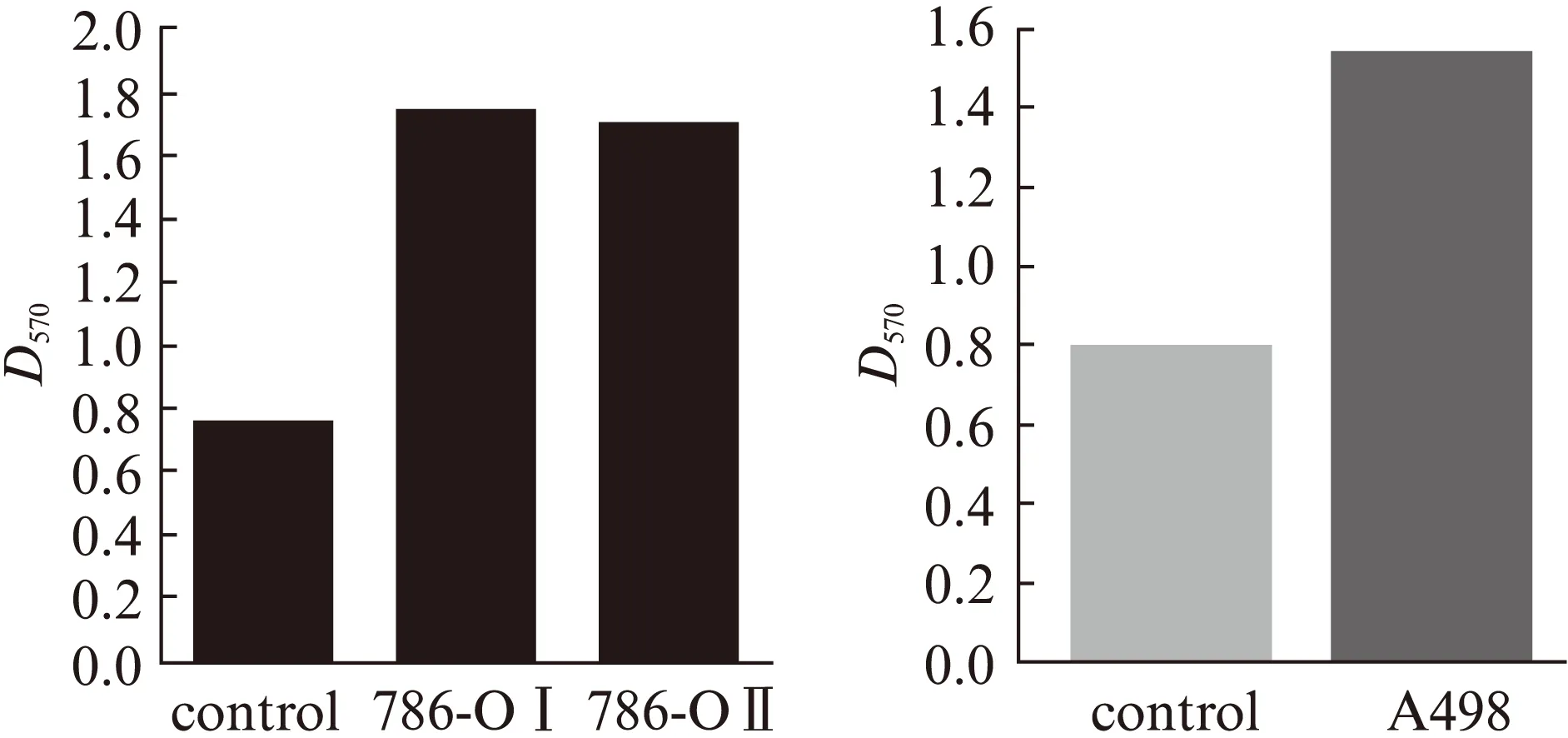
图6 转染后的肾癌细胞侵袭力Fig.6 Cell invasion in transfected 786-O and A498 cells
2.3 下游靶蛋白表达水平检测
肿瘤组织和正常组织细胞质中,β-catenin表达差异无统计学意义(t=0.825,P=0.459>0.05),而肿瘤细胞核内β-catenin表达高于正常组织(t=2.833,P=0.047<0.05),ccRCC细胞核内β-catenin略高于细胞质,但差异无统计学意义(t=1.812,P=0.144>0.05),见图8。Western印迹法果显示,稳转组DKK4蛋白表达水平显著升高(t=38.49,P<0.0001),β-catenin表达水平下调(t=4.174,P=0.014<0.05),Cylin D1表达上调(t=3.603,P=0.0227<0.05),Rac1表达上调(t=3.659,P=0.022<0.05),JNK表达上调(t=2.799,P=0.048<0.05),见图9。

图7 肾癌细胞株中的肿瘤细胞凋亡水平Fig.7 Cell apoptosis in transfected 786-O and A498 cells
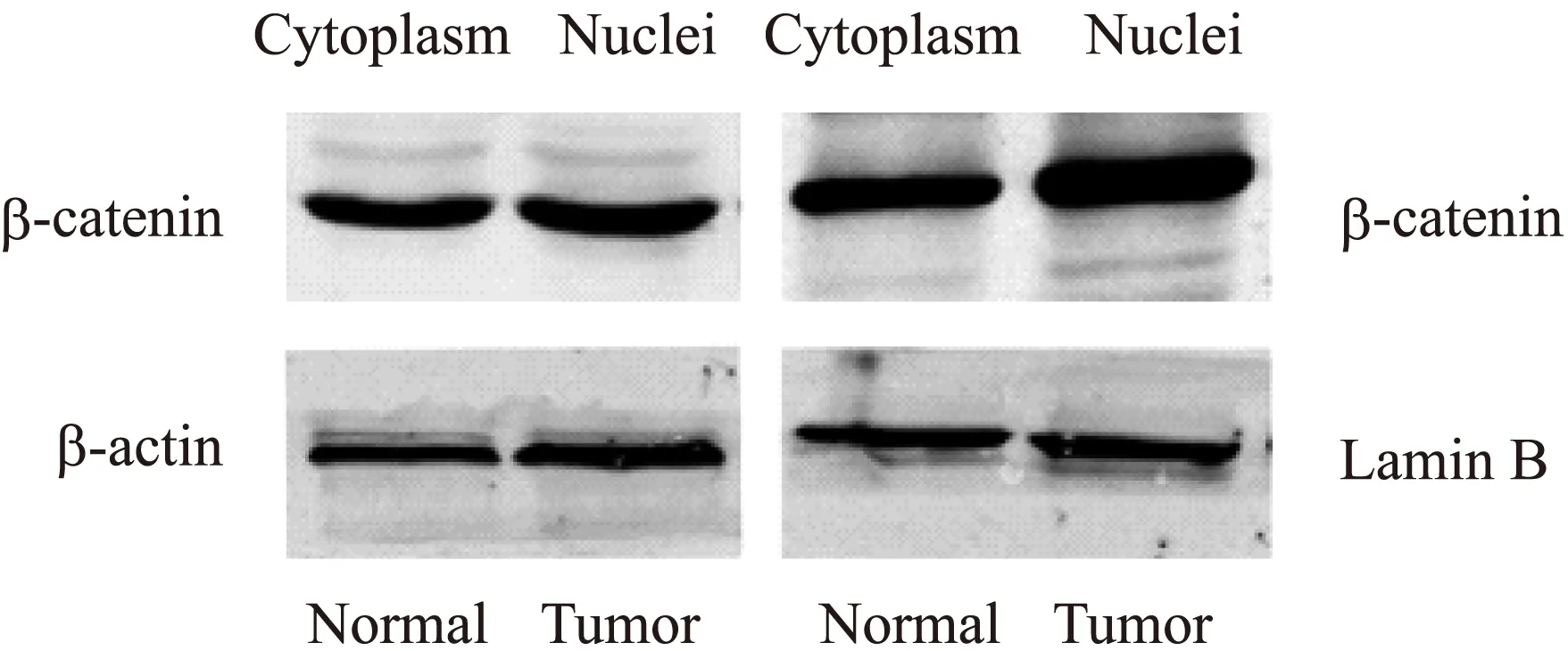
图8 肾透明细胞癌组织的细胞核、细胞质中β-catenin蛋白表达水平Fig.8 Expression level of β-catenin cell plasma,cell nucleus in ccRCC tissues
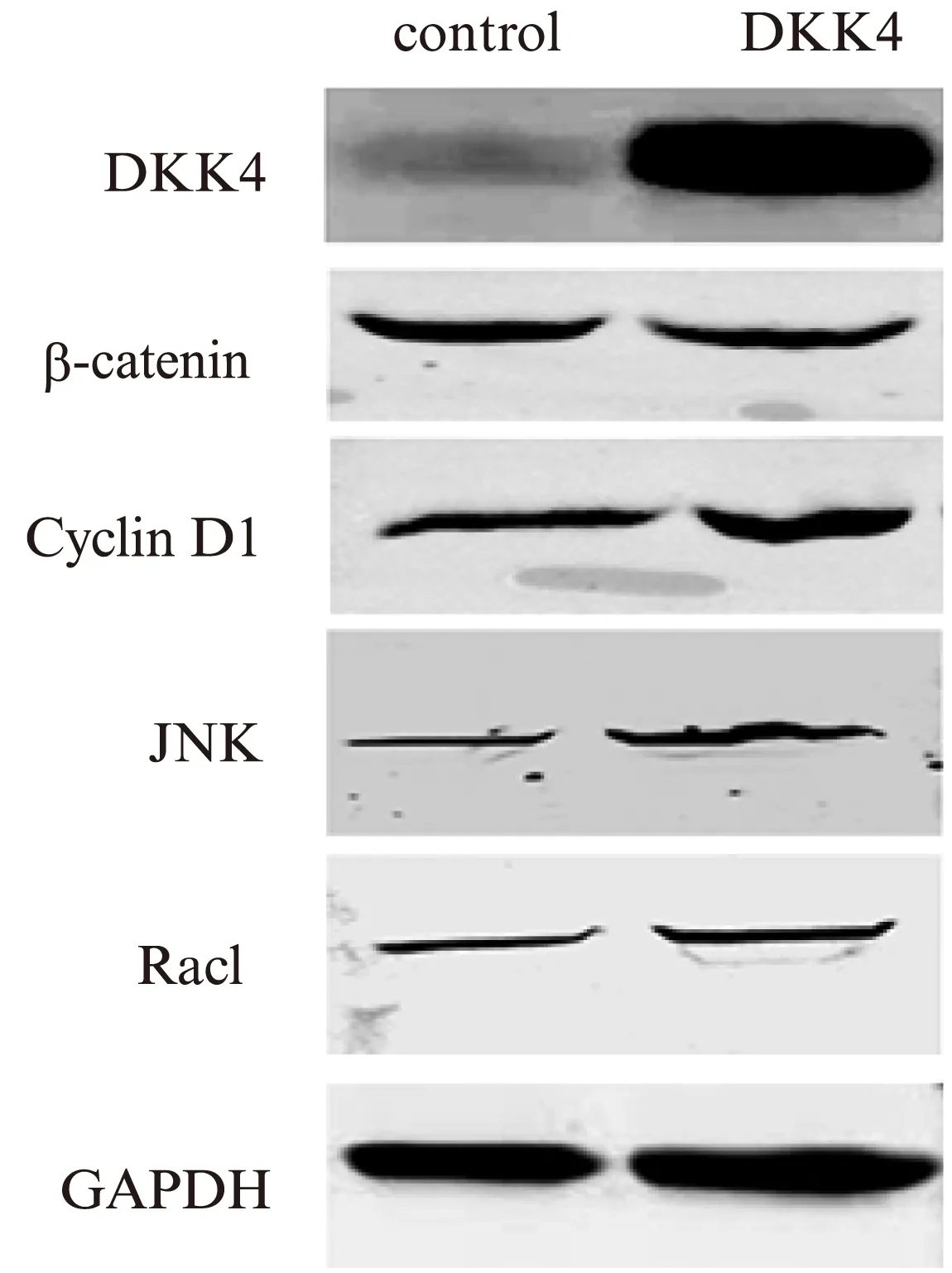
图9 转染后的肾癌细胞株中下游蛋白表达水平Fig.9 Expression level of down-stream target protein in transfected 786-O and A498 cells
3 讨 论
1999年,研究[7]发现DKK4能负性调节Wnt/β-catenin信号通路,但其在ccRCC的发生、发展过程中的研究甚少。作为Wnt/β-catenin通路的上游阻断剂,在DKK蛋白家族中,DKK4与DKK1相似,都与LRP5/6和Krms结合[8]。但是他们在肿瘤的发生、发展及预后中的作用却不相同。研究发现DKK家族的作用具有细胞特异性,在一些肿瘤中具有抑癌基因的作用,抑制肿瘤细胞的侵袭、增殖,诱导肿瘤细胞凋亡,抑制肿瘤的生长[9-11],而在部分肿瘤中却有促癌作用[12]。DKK1、DKK2、DKK3在肾癌中的中被甲基化修饰表达失活[13-14],DKK4表达上调[15],其中DKK1、DKK2表达与肾癌分级和病理分期相关。DKK1、DKK2、DKK3对肾癌细胞功能影响的作用机制不尽相同。DKK1主要通过调控Caspase-3、p53、p21、puma调节细胞凋亡和细胞周期发挥肿瘤抑制基因的作用[14],而DKK2则通过调控Bcl-2和Cyclin D1调节细胞凋亡和细胞周期转化;DKK3则通过调控JNK信号通路而非Wnt/β-catenin通路诱导细胞凋亡[13]。DKK4在ccRCC中DKK4表达上调,在细胞核中的表达增高。同样,β-catenin在肾癌细胞核内积聚,而β-catenin已经被明确是Wnt通路的重要转录因子。DKK4具有类似的亚细胞分布。研究[16]显示,在结直肠癌细胞中,DKK4的表达与β-catenin下游转录基因纤维母细胞生长因子-20(fibroblast growth factor-20)表达水平和细胞核内β-catenin积聚水平呈正相关[16]。Baehs等[17]报道,DKK4存在TCF的结合位点,沉默DKK4后使β-catenin/Tcf-4活动增强,过表达DKK4能有效抑制β-catenin/Tcf-4活动,并且抑制肿瘤细胞的生长和细胞周期转化。荧光素酶报告基因分析[18]显示,细胞转染LEF-1和β-catenin后,能诱导DKK4表达上调。因此,DKK4可能是Wnt/β-catenin通路下游靶基因,可能作为转录因子调控ccRCC的发生、发展。研究[19]显示,DKK3也可能在肝癌中作为转录因子发挥促癌作用。
本研究发现,在体外过表达DKK4后,细胞内总β-catenin蛋白表达量下调,其下游蛋白Cyclin D1的表达上调。作为Wnt通路下游蛋白,β-catenin可以激活Cyclin D1,但同时Cyclin D1的表达也受JNK调控。在人胰腺癌和裸鼠抑制瘤模型中抑制JNK表达后,能显著下调Cyclin D1的表达,并且JNK激活Cyclin D1能调控肝细胞再生。本研究中,过表达DKK4抑制Wnt/β-catenin信号下游转录活动,却使Cylin D1表达上调,这可能与DKK4激活了JNK有关。Wnt通路还包含Wnt/Ca2+非经典信号通路,DKK4是否对此信号通路有作用,将在今后的研究继续探讨。
综上所述,DKK4作为Wnt/β-catenin经典通路抑制剂,DKK4同DKK1、DKK2、DKK3在肾透明细胞癌中发挥着完全不同的作用,DKK4虽然抑制Wnt/β-catenin信号,但通过激活Wnt/PCP信号通路并且作为转录因子而发挥促癌作用。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011,61(2): 69-90.
[2] Katoh M, Katoh M. Wnt signaling pathway and stem cell signaling network [J]. Clin Cancer Res, 2007,13(14): 4042-4045.
[3] Stewart DJ, Chang DW, Ye Y, et al. Wnt signaling pathway in non-small cell lung cancer [J]. Pharmacogenomics J, 2014,14(6): 509-522.
[4] Joksimovic M, Awatramani R. Wnt/β-catenin signa-ling in midbrain dopaminergic neuron specification and neurogenesis [J]. J Mol Cell Biol, 2014,6(1): 27-33.
[5] 方霞,易祥华. Wnt/β-catenin和EGFR信号通路在非小细胞肺癌发生发展中的作用[J].同济大学学报: 医学版,2012,33(1): 105-109.
[6] Niehrs C. Function and biological roles of the Dickkopf family of Wnt modulators [J]. Oncogene, 2006,25(57): 7469-7481.
[7] Krupnik VE, Sharp JD, Jiang C, et al. Functional and structural diversity of the human Dickkopf gene family [J]. Gene, 1999,238(2): 301-313.
[8] Mao B, Wu W, Davidson G, et al. Kremen proteins are Dickkopf receptors that regulate Wnt/β-catenin signalling [J]. Nature, 2002,417(6889): 664-667.
[9] Lee J, Yoon YS, Chung JH. Epigenetic silencing of the Wnt antagonist DICKKOPF-1 in cervical cancer cell lines [J]. Gynecol Oncol, 2008,109(2): 270-274.
[10] Mikheev AM, Mikheeva SA, Maxwell JP, et al. Dickkopf-1 mediated tumor suppression in human breast carcinoma cells [J]. Breast Cancer Res Treat, 2008,112(2): 263-273.
[11] Zhu J, Zhang S, Gu L, et al. Epigenetic silencing of DKK2 and wnt signal pathway components in human ovarian carcinoma [J]. Carcinogenesis, 2012,33(12): 2334-2343.
[12] Hauer K, Calzada-Wack J, Steiger K, et al. Dkk2 mediates osteolysis, invasiveness, and metastatic spread in Ewing sarcoma [J]. Cancer Res, 2013,73(2): 967-977.
[13] Ueno K, Hirata H, Majid S, et al. Wnt antagonist DICKKOPF-3 (DKK-3)induces apoptosis in human renal cell carcinoma [J]. Mol Carcinogen, 2011,50(6): 449-457.
[14] Hirata H, Hinoda Y, Nakajima K, et al. Wnt antagonist DKK1 acts as a tumor suppressor gene that induces apoptosis and inhibits proliferation in human renal cell carcinoma [J]. Int J cancer, 2011,128(8): 1793-1803.
[15] Hirata H, Hinoda Y, Majid S, et al. DICKKOPF-4 activates the noncanonical c-Jun-NH2 kinase signaling pathway while inhibiting the Wnt-canonical pathway in human renal cell carcinoma [J]. Cancer, 2011,117(8): 1649-1660.
[16] Pendas-Franco N, Garcia JM, Pena C, et al. DICKKOPF-4 is induced by TCF/β-catenin and upregulated in human colon cancer, promotes tumour cell invasion and angiogenesis and is repressed by 1alpha,25-dihydroxyvitamin D3 [J]. Oncogene, 2008,27(32): 4467-4477.
[17] Baehs S, Herbst A, Thieme SE, et al. Dickkopf-4 is frequently down-regulated and inhibits growth of colorectal cancer cells [J]. Cancer Lett, 2009,276(2): 152-159.
[18] Bazzi H, Fantauzzo KA, Richardson GD, et al. The wnt inhibitor, Dickkopf 4, is induced by canonical wnt signaling during ectodermal appendage morphogenesis [J]. Dev Biol, 2007,305(2): 498-507.
[19] 王宁,杨斌,骆莹,等.Wnt途径拮抗剂dickkopf-3蛋白在肝细胞癌中表达亚细胞定位及临床意义 [J]. 中国肿瘤临床, 2012,39(2): 93-104.
Dickkopf- 4 activates Wnt/PCP pathway to promote the proliferation and invasion of renal cell carcinoma
HUGuang-hui,LAIPeng,LIUHuan,LUOMing,ZHANGHai-min,XUYun-fei
(Department of Urology, Tenth People’s Hospital, Tongji University, Shanghai 200072, China)
Objective To investigate the expression level of DKK4 in clear cell renal cell carcinoma and its association with tumourigenesis and progression of ccRCC. Methods The expression level of DKK4 in 42 cases of ccRCC compared with matched adjacent normal kidney tissues were detected by RT-PCR, immunohistochemistry and Western blot, and its correlation to the clinical features were explored. Plasmids that contained the human full-length combinational DNA fragment of DKK4 were used to transfected 786-O and A498 cells. Cell viability, cell invasion and apoptosis of stable transfected DKK4 cells were tested. Downstream target protein of Wnt/β-Catenin pathway(β-Catenin, Cyclin D1)and Wnt/PCP pathway(JNK,Rac1)were detected. Results Of the 42 specimens, 28(66.7%)has clearly high expression level of DKK4 mRNA compared to matched adjacent normal kidney tissues. No correlation was found between the overexpressed DKK4 and tumor clinical characters (P>0.05). β-Catenin was downregulated in stable transfected cells but Cyclin D1, JNK and Rac1 up-regulated. Conclusion DKK4 as Wnt/β-Catenin pathway inhibitor may promote the proliferation and invasion of ccRCC.
DKK4; clear cell renal cell carcinoma; cell viability; cell invasion; apoptosis; Wnt/PCP
10.16118/j.1008-0392.2015.01.005
2014-04-13
上海市科委项目(12ZR1423200)
胡光辉(1990—),硕士研究生. E-mail: brianhu13@live.com
许云飞.E-mail: xuyunfeibb@sina.com
R 737.11
A
1008-0392(2015)01-0018-06

