木香烃内酯诱导乳腺癌MCF—7细胞凋亡作用机制的研究
王桂明 史栋栋 彭章晓 鲁阳芳 谷雪 王彦++闫超


摘 要 研究了木香烃内酯诱导人乳腺癌细胞MCF-7细胞凋亡的作用机制。采用流式细胞仪测定不同浓度木香烃内酯(0, 2, 4, 8 μg/mL)作用于MCF-7细胞后细胞凋亡、活性氧(Reactive oxygen species, ROS)含量及线粒体跨膜电位(Mitochondrial transmembrane potential, MTP)的变化,气相色谱-质谱联用(GC-TOF/MS)技术分析加药组与未加药组的代谢差异物。结果表明,木香烃内酯能诱导MCF-7细胞凋亡,并具有浓度依赖性,能够促使ROS含量升高; MTP在2 μg/mL木香烃内酯作用时升高,在4和8 μg/mL时显著下降;基于GC-TOF/MS的细胞代谢组学研究,最终发现15种代谢差异物。基于上述结果,推测木香烃内酯通过引起ROS含量升高、MTP降低,扰乱线粒体的正常功能,进一步阻碍TCA循环,抑制ATP合成,扰乱了细胞内代谢物的平衡,并引起位于膜间隙的凋亡相关蛋白释放,最终导致MCF-7细胞的凋亡。
关键词 MCF-7细胞; 细胞凋亡; 细胞代谢组学; 活性氧; 线粒体跨膜电位
1 引 言
乳腺癌严重威胁着女性健康,居于女性肿瘤患者致死率的第2位,发病率在发展中国家呈逐年上升趋势【1】。木香烃内酯是从中药木香中提取的倍半萜内酯,研究发现其具有抗炎等生物活性【2~4】,可诱导早幼粒白血病HL-60细胞及U937细胞、乳腺癌MDA-MB-231细胞的凋亡【5~7】,对正常细胞无毒性。它可以通过引起ROS的升高、MTP的崩溃诱导膀胱癌细胞的凋亡【8】,研究表明,其通过与微管蛋白作用、抑制端粒酶活性等抑制乳腺癌MCF-7细胞的增殖【9,10】。肿瘤细胞内ROS的含量比正常细胞高,在以ROS为靶点的药物作用下肿瘤细胞内ROS首先达到氧化应激状态,因此可有选择性地杀死癌细胞【11】。MTP的降低可以引起肿瘤细胞的凋亡,ROS含量升高可以引起线粒体通透性转运孔的打开而引起MTP降低,最终促进细胞凋亡【12】。因此,ROS升高、MTP的降低与细胞凋亡之间存在密切联系。
代谢组学被称为“基因型和表型之间的桥梁”【13】,不仅可以测定药物本身的代谢及药代动力学变化,还可以测定药物作用引起的内源性代谢产物的变化【14,15】。因此,将代谢组学与传统生物学研究方法相结合,对于深入探究药物作用机制有重要的意义。
目前,代谢组学结合传统生物学的方法考察药物抑制肿瘤细胞增殖作用的研究已有文献报道【16】,但是将此方法用于细胞凋亡作用机制方面的研究仍未见报道。本研究以木香烃内酯作用于MCF-7细胞,基于细胞内ROS含量以及MTP的变化,结合气相色谱-质谱联用(GC-TOF/MS)技术分析药物作用前后细胞内代谢产物的变化,探讨了木香烃内酯诱导MCF-7细胞凋亡作用的机制。
2 实验部分
2.1 仪器与试剂
CO2培养箱,氮吹仪(Thermo, USA);低速离心机(上海安亭科学仪器厂);LSRFortessa流式细胞仪、 FACSCalibur流式细胞仪(BD, USA);GC×GC-TOF/MS (LECO, USA);FS-150PV超声细胞破碎仪 (上海生析超声仪器有限公司)。木香烃内酯(纯度>98%,上海源叶生物科技有限公司);胎牛血清、DMEM培养基、磷酸盐缓冲液(PBS)、胰蛋白酶(美国赛默飞世尔科技有限公司);甲醇(色谱纯,德国Merck);吡啶(分析纯)、二甲基亚砜(DMSO,分析纯)均购于国药集团化学试剂有限公司;N, O-双(三甲基硅烷基)三氟乙酰胺(BSTFA,含1%三甲基氯硅烷)、甲氧胺、2-氯-苯丙氨酸均购于美国Sigma公司;Annexin V-FITC细胞凋亡检测试剂盒、罗丹明123(Rhodamine123)、2′, 7′-二氯荧光黄双乙酸盐(DCFH-DA)均购于碧云天生物技术研究所。
2.2 细胞凋亡分析
用DMSO配制10 mg/mL木香烃内酯储备液,用培养基逐步稀释至8, 4 和2 μg/mL(DMSO终浓度<0.1%)。用Annexin V-FITC细胞凋亡检测试剂盒测定细胞凋亡情况。试剂盒中具有Annexin V-FITC与碘化丙啶(PI)两种染料。磷酯酰丝氨酸(PS)主要分布在细胞膜内侧,凋亡细胞的PS外翻,Annexin V与PS结合;凋亡晚期及坏死细胞的细胞膜完整性受到破坏,PI可以进入细胞内进行标记,Annexin V-FITC可以进入坏死细胞内与位于内侧的PS结合而标记。
指数生长期的MCF-7细胞接种在六孔板上(2×105/孔),培养12 h后,随机分4组,每组3个平行,分别加入以下各组药物:Control(0 μg/ml), 2, 4和8 μg/mL,培养24 h后,收集细胞,用冷PBS缓冲溶液清洗2遍,加入200 μL凋亡结合液后用移液枪轻轻吹散细胞,加入5 μL Annexin V-FITC 和10 μL PI避光孵育15 min,FACSCalibur流式细胞仪检测10000个细胞。
2.3 细胞内ROS含量的测定
用荧光探针DCFH-DA测定ROS的含量。DCFH-DA本身没有荧光,进入细胞后可最终被ROS氧化为有荧光的2′,7′-二氯荧光黄(DCF),其荧光强度代表细胞内ROS的水平。将处于指数生长期的MCF-7细胞接种在六孔板上(2×105/孔),培养12 h后,随机分4组,每组3个平行,分别加入木香烃内酯2, 4 和8 μg/mL和空白培养基。培养24 h后,弃去培养基,用含8 μmol/L DCFH-DA无血清培养基37 ℃避光孵育20 min,PBS清洗2遍以除去未标记的DCFH-DA探针,收集细胞用LSRFortessa流式细胞仪分析,检测10000个细胞。
2.4 线粒体跨膜电位(MTP)的测定endprint
Rhodamine123是一种携带正电荷的阳离子染料,可依赖较高的负线粒体跨膜电位有选择性的进入线粒体,其荧光强度高说明线粒体内电负性强,MTP高,反之则MTP低。将处于指数生长期的MCF-7细胞接种在六孔板上(2×105/孔),培养12 h后,随机分4组,每组3个平行,加入木香烃内酯(2, 4 和8 μg/mL)、空白培养基。培养24 h后,Rhodamine123(0.2 μmol/L)避光染色30 min,用冷PBS缓冲溶液清洗2遍,收集细胞,LSRFortessa流式细胞仪测定其荧光强度。
2.5 基于GC-TOF/MS的细胞代谢组学研究
2.5.1 细胞代谢物的提取及衍生化 将处于指数生长期的细胞接种在100 mm×20 mm的培养皿中(3×106/皿),培养12 h后加入木香烃内酯(6 μg/mL)、含等量DMSO的培养基,设6个平行。细胞的提取及衍生化过程如下【17】:培养24 h后,弃去培养基,用生理盐水清洗3遍,液氮迅速猝灭。每个培养皿加入1000 μl甲醇-水(4∶1, V/V)溶液,刮取细胞至样品瓶中,为更充分提取细胞,每个样品加入200 μL氯仿。每一样品加入10 μL 2-氯-苯丙氨酸(内标,0.3 mg/mL),涡旋,超声破碎(3 min,5 s开,5 s关,4 ℃)细胞提取代谢物。
将提取后的细胞样品4000 r/min离心10 min,取1000 μL上清液至GC进样瓶中,室温真空干燥,用氮气再次吹干后,加入80 μL甲氧胺(15 mg/mL,吡啶配制),混合1 min,30 ℃反应90 min后,加入80 μL BSTFA和40 μL正己烷,70 ℃下反应90 min。
2.5.2 GC-TOF/MS条件 DB-5 MS色谱柱(30 m × 250 μm I.D., J&W Scientific, Folsom, CA); 载气: 高纯氦气,流速1.0 mL/min。程序升温: 起始温度80 ℃,保持0.2 min;以10 ℃/min升至180 ℃,以5 ℃/min升至240 ℃,以20 ℃/min升至290 ℃,保持11 min。进样口温度280 ℃,接口温度270 ℃,EI源温度220 ℃,电子碰撞能量70 eV。
质量扫描范围: m/z 30~600全扫描,质谱图采集速度:每秒20 幅。
2.5.3 GC-TOF/MS数据分析 GC-TOF/MS得到的原始数据经ChromaTOF(v 4.50, LECO, St Joseph, MI,USA)软件进行预处理,得到包括样品信息、保留时间及峰面积等信息的CSV三维数据矩阵,扣除已知的假峰后对数据进行峰面积归一化,然后导入SIMCA-P 11.5软件进行多维统计分析。本实验主要进行无监督的主成分分析(PCA)和有监督的正交偏最小二乘法分析(OPLS-DA)。PCA分析主要观察样本的总体分布,OPLS-DA来区分加药组与对照组之间的代谢差异物。变量权重值(Variable importance in the projection, VIP)>1的代谢物被认为是差异代谢物,同时结合t检验及Wilcoxon-Mann-Whitney检验验证差异性代谢物,最后将得到的代谢差异物进行NIST库搜索。
3 结果与讨论
3.1 木香烃内酯对MCF-7细胞凋亡的影响
研究木香烃内酯对MCF-7细胞的凋亡作用,流式细胞仪检测各组凋亡率,图1A是其中一组凋亡实验的散点图,①②③和④分别代表细胞碎片、后期凋亡细胞、活细胞、前期凋亡细胞;图1B是对3次平行实验进行分析的结果,从图可以看出随着药物作用浓度的升高,MCF-7细胞的前期凋亡、后期凋亡及总凋亡率逐渐升高(在2 μg/mL处前期凋亡率略降低,但是与对照组没有显著性差异)。由此可知,
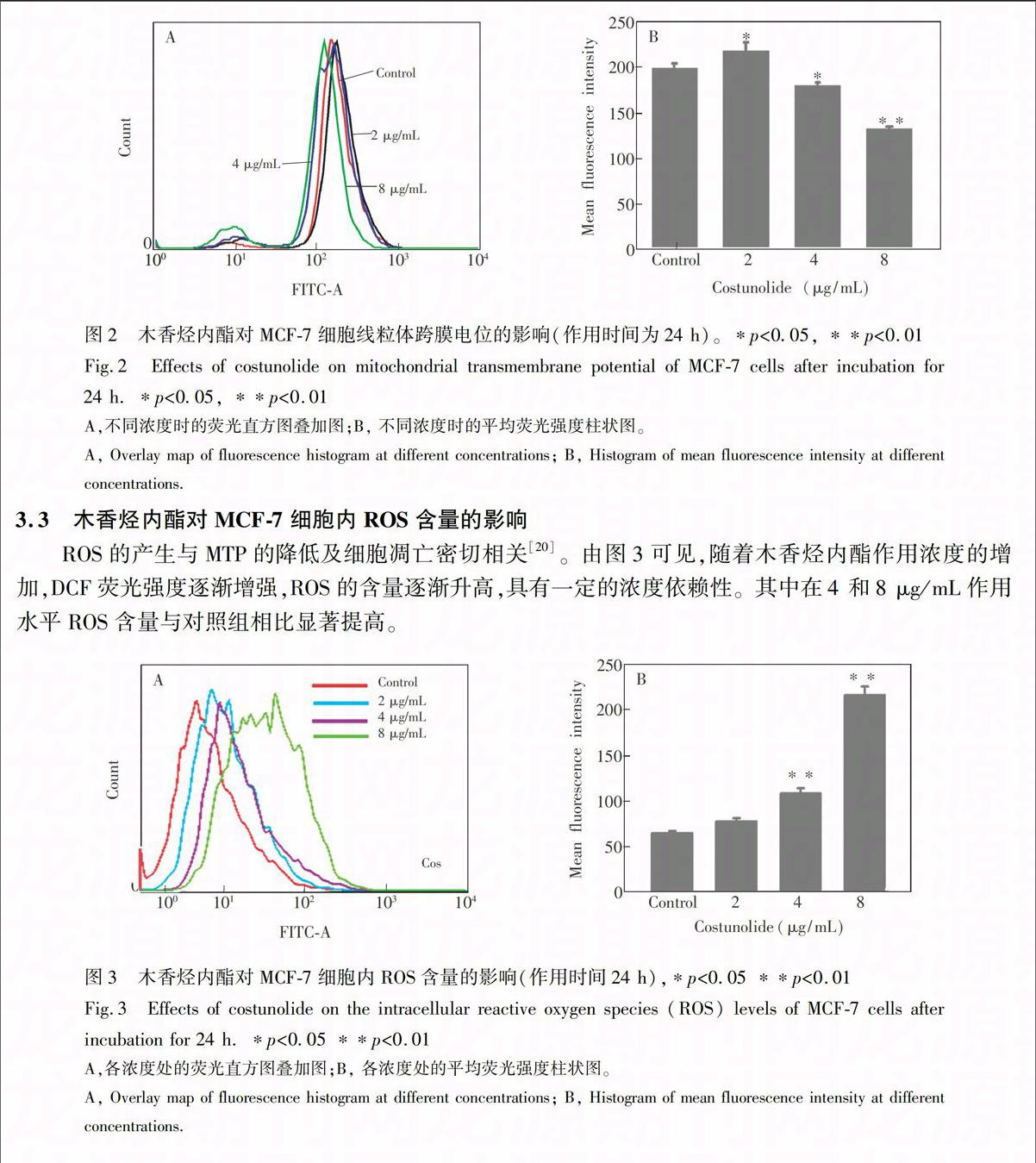
3.2 木香烃内酯对MCF-7细胞线粒体跨膜电位(MTP)的影响
MTP的崩溃能引起细胞凋亡【18】。为探究木香烃内酯诱导MCF-7细胞凋亡的作用机制,本研究考察了其对MCF-7细胞MTP的影响。由图2可见,与对照组相比,在2 μg/mL木香烃内酯作用下MTP升高,在4和8 μg/mL时显著下降,且随着浓度的升高而下降。文献\表1 基于GC-TOF/MS数据的MCF-7细胞木香烃内酯组与对照组对比的代谢差异物代谢差异物中,柠檬酸含量下降、琥珀酸含量上升,可能是由于细胞内ROS含量的升高及MTP的降低破坏了三羧酸循环(TCA)而造成的。已有研究表明,氧化应激与TCA循环功能性障碍相关,ROS可促使α-酮戊二酸转化为琥珀酸【21】。琥珀酸脱氢酶可催化琥珀酸转化为延胡索酸,是TCA循环中唯一与线粒体内膜结合的酶。在上述研究中,MTP降低,琥珀酸脱氢酶活性可能受到抑制,使琥珀酸的含量升高。
线粒体是ATP合成的主要场所,MTP的降低,使氧化磷酸化过程解耦联,ATP水解大于合成,破坏了离子和代谢物平衡【22】。TCA循环是糖类、脂肪和蛋白质最终氧化的重要酶促循环反应系统。在正常情况下,糖酵解、TCA循环的速度以及氧化磷酸化的速度是相互协调的【23】。在上述研究中,MTP降低,使氧化磷酸化过程解耦联,抑制了ATP的合成。因此,推测TCA循环受到抑制,进而抑制了糖酵解过程,使葡萄糖、山梨糖的含量升高。核糖醇是组成核黄素的成分之一,核黄素在生物体内以黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)的形式参与氧化呼吸链、TCA循环。因此推测,氧化呼吸链以及TCA循环受到抑制后,引起核糖醇的含量升高。氨基酸可通过脱氨基作用生成α-酮酸参与到TCA循环中,其中苯丙氨酸、酪氨酸可转化为延胡索酸,谷氨酸可转化为α-酮戊二酸,丝氨酸、甘氨酸可转化为丙酮酸【23】,谷氨酸、苯丙氨酸、酪氨酸含量下降,丝氨酸、甘氨酸含量升高可能是由木香烃内酯抑制了TCA循环进而引起了氨基酸代谢的紊乱而造成的。endprint
4 结 论
以细胞代谢组学和传统生物学方法为基础,探究了木香烃内酯作用于MCF-7细胞后,细胞内ROS含量、MTP及细胞内代谢产物的变化。结果表明,木香烃内酯作用于乳腺癌MCF-7细胞后,使ROS含量升高,MTP降低,导致线粒体的结构受到破坏,可能进一步阻碍了TCA循环,抑制了ATP合成,扰乱了细胞内代谢物的平衡,并引起位于膜间隙的凋亡相关信号的释放,最终导致MCF-7细胞的凋亡。本研究不仅从代谢组学的角度为研究木香烃内酯抗肿瘤的作用机制提供了新线索,而且进一步表明基于GC-TOF/MS的细胞代谢组学方法可以作为研究药物作用机制的有效分析工具。
References
1 Desantis C, Ma J, Bryan L, Jemal A. CA Cancer J. Clin., 2014, 64(1): 52-62
2 Park H J, Jung W T, Basnet P, Kadota S, Namba T. J. Nat. Prod., 1996, 59(12): 1128-1130
3 Wedge D E, Galindo J C, Macias F A. Phytochem., 2000, 53(7): 747-757
4 Chen H C, Chou C K, Lee S D, Wang J C, Yeh S F. Antivir. Res., 1995, 27(1-2): 99-109
5 Choi J H, Ha J H, Park H H, Lee J Y, Park H J, Choi J W, Masuda Y, Nakaya K, Lee K T. Jpn. J. Cancer Res., 2002, 93(12): 1327-1333
6 Hibasami H, Yamada Y, Moteki H, Katsuzaki H, Imai K, Yoshioka K, Komiya T. Int. J. Mol. Med., 2003, 12(2): 147-151
7 Pitchai D, Roy A, Banu S. Phytother Res, 2014, 28: 1499-1505
8 Rasul A, Bao R, Malhi M, Zhao B, Tsuji I, Li J, Li X. Molecules., 2013, 18(2): 1418-1433
9 Bocca C, Gabriel L, Bozzo F, Miglietta A. Chem. Biol. Interact., 2004, 147(1): 79-86
10 Choi S H, Im E, Kang H K, Lee J H, Kwak H S, Bae Y T, Park H J, Kim N D. Cancer Lett., 2005, 227(2): 153-162
11 Schumacker P T. Cancer Cell, 2006, 10(3): 175-176
12 Sinha K, Das J, Pal P B, Sil P C. Arch. Toxicol., 2013, 87(7): 1157-1180
13 Fiehn O. Plant Mol. Biol., 2002, 48(1-2): 155-171
14 SHIDong-Dong, KUANG Yuang-Yuan, WANG Gui-Ming, PENG Zhang-Xiao, WANG Yan, YAN Chao. Chinese Journal of Chromatography, 2014, 32(3): 278-283
史栋栋, 况媛媛, 王桂明, 彭章晓, 王 彦, 闫 超. 色谱, 2014, 32(3): 278-283
15 GU Jin-Ning, NIU Jun, PI Zi-Feng, YUE Hao, WU Sui-Sheng, LIU Shu-Ying. Chinese J. Anal. Chem., 2013, 41(3): 371-376
谷金宁, 牛 俊, 皮子凤, 越 皓, 吴绥生, 刘淑莹. 分析化学, 2013, 41(3): 371-376
16 Jager W, Gruber A, Giessrigl B, Krupitza G, Szekeres T, Sonntag D. OMICS, 2011, 15(1-2): 9-14
17 SHI Dong-Dong, WANG Gui-Ming, KUANG Yuan-Yuan, PENG Zhang-Xiao, WANG Yan, GU Xue, YAN Chao. Chinese J. Anal. Chem., 2014, 42(8): 1088-1093
史栋栋, 王桂明, 况媛媛, 彭章晓, 王 彦, 谷 雪, 阎 超. 分析化学, 2014, 42(8): 1088-1093
18 Wang M, Ruan Y, Chen Q, Li S, Wang Q, Cai J. Eur. J. Pharmacol., 2011, 650 (1): 41-47
19 Scarlett J L, Sheard P W, Hughes G, Ledgerwood E C, Ku H H, Murphy M P. FEBS Lett., 2000, 475(3): 267-272
20 Simon H U, Haj-Yehia A, Levi-Schaffer F. Apoptosis, 2000, 5(5): 415-418
21 Tiziani S, Lodi A, Khanim F L, Viant M R, Bunce C M, Günther U L. PloS One, 2009, 4(1): e4251
22 Duchen M R. Mol. Aspects Med., 2004, 25(4): 365-451
23 JIA Hong-Ti, FENG Zuo-Hua. Biochemistry and Molecular Biology. Beijing: People′s Medical Publishing House, 2010: 194-250
贾弘褆, 冯作化. 生物化学与分子生物学. 北京: 人民卫生出版社, 2010: 194-250endprint

