利巴韦林胶囊溶出曲线测定方法的建立及国产利巴韦林胶囊溶出行为的考察
杨洪淼,蔺娟,闵祺,廖海明,范慧红Δ
(1.中国食品药品检定研究院,北京 100050;2.新疆维吾尔自治区食品药品检验所,新疆 乌鲁木齐 830004;3.锦州市药品检验所,辽宁 锦州 121001)
利巴韦林胶囊溶出曲线测定方法的建立及国产利巴韦林胶囊溶出行为的考察
杨洪淼1,蔺娟2,闵祺3,廖海明1,范慧红1Δ
(1.中国食品药品检定研究院,北京 100050;2.新疆维吾尔自治区食品药品检验所,新疆 乌鲁木齐 830004;3.锦州市药品检验所,辽宁 锦州 121001)
目的 建立利巴韦林胶囊溶出曲线测定方法,考察国内利巴韦林胶囊溶出行为,为该品种仿制药质量一致性评价工作提供实验依据。方法 采用《中国药典》2010年版(二部)附录Ⅹ C第一法(篮法),转速50 r/min,分别以pH 1.2盐酸溶液、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水为溶出介质,溶出介质体积900 mL,于不同时间点取样测定并绘制4种溶出介质下的溶出曲线。采用高效液相色谱法进行溶出度测定。色谱柱为C18柱,流动相为4 g/L的磷酸二氢钠溶液(用5%氢氧化钠溶液调节pH至5.0±0.05)-乙腈(98︰2),流速为1.0 mL/min,检测波长为225 nm,进样量为10 μL。结果 利巴韦林供试品溶液浓度在2.5~200 μg/mL范围内与峰面积呈良好的线性关系(r=1);精密度、稳定性试验的RSD≤0.5%,4种溶出介质中平均回收率分别为101.3%、100.7%、100.2%和100.4%。pH4.5和pH6.8溶出介质中各企业胶囊溶出行为比较一致并可以迅速溶出,pH1.2和水溶出介质中溶出行为差异较大,且有部分企业不能达到15 min的平均溶出量大于85%。结论 建立的溶出曲线测定方法准确、可靠。国产利巴韦林胶囊之间溶出行为存在差异,其制剂工艺水平还有提升的空间。
利巴韦林胶囊;溶出曲线;仿制药质量一致性评价
利巴韦林是一种广谱的抗病毒药物,利巴韦林胶囊的适应症主要为呼吸道合胞病毒引起的病毒性肺炎与支气管炎,以及皮肤疱疹病毒感染等,在临床上应用广泛[1-4]。该品种收载于《国家基本药物目录》(2012年版),同时也是仿制药质量一致性评价工作待完成的品种之一。本文建立利巴韦林胶囊在多种溶出介质中溶出曲线的测定方法,并对国内该品种制剂的溶出行为进行考察,以期为本品种的仿制药质量一致性评价工作提供实验依据。
日本橙皮书中未收载利巴韦林品种,而中国药典中利巴韦林固体口服制剂项下也均未设有溶出度检查项。所以本实验中溶出曲线测定方法的建立将参考《美国药典》36版中利巴韦林片剂溶出度检查的方法和FDA溶出数据库中提供的利巴韦林胶囊的溶出条件。
从国家食品药品监督管理总局网站查到国内现有利巴韦林胶囊生产企业5家,批准文号6个。分别向各企业发函征集样品,最终征集到4家企业的样品,包含0.1g和0.15g 2种规格。
1 材料与方法
1.1 材料
1.1.1 药品与试剂:利巴韦林胶囊(国内生产企业A与B,规格0.15 g;国内生产企业C与D,规格0.1 g),利巴韦林对照品(中国药品生物制品检定所,批号:629-200202);利巴韦林原料(新乡制药股份有限公司,批号:02110338);盐酸、冰醋酸(国药集团化学试剂有限公司,优级纯);磷酸二氢钾、醋酸钠、氢氧化钠、磷酸二氢钠(国药集团化学试剂有限公司,分析纯);乙腈(Fisher试剂公司,色谱纯)。
1.1.2 实验仪器:Agilent 1100高效液相色谱仪(美国安捷伦公司),岛津2010AT高效液相色谱仪(日本岛津公司);SOTAX AT7 Smart型自动取样溶出仪(瑞士SOTAX公司);Mettler XS205型电子天平(Mettler公司);Mettler MP230型酸度计(Mettler公司)。
1.2 与溶出度相关的理化性质的测定
1.2.1 溶解度的测定:在37 ℃水浴条件下,配制利巴韦林在4种溶出介质中的饱和溶液,采用本文的液相方法测定饱和溶液浓度。
1.2.2 不同溶出介质中的稳定性:取利巴韦林原料适量,分别加4种溶出介质制成约0.1 mg/mL的溶液。室温下放置并于0、2、4、6、12 h进行液相测定,计算峰面积RSD。
1.2.3 考察过滤膜对利巴韦林的吸附作用:将利巴韦林水溶液、使用针头过滤器过滤1次的滤液和过滤2次的滤液进行液相测定。
1.3 溶出介质的选择 根据文献[5-7],溶出介质应模拟人体胃肠道的pH值,由于利巴韦林为非pH依赖型药物,所以选择常规的pH1.2、pH4.5和pH6.8的缓冲溶液以及水作为溶出介质。配制方法为:pH1.2溶出介质:取盐酸7.65 mL,加水稀释至1000 mL,摇匀即得;pH4.5溶出介质:取2 mol/L醋酸溶液14.0 mL,与醋酸钠2.99 g,加水溶解并稀释至1000 mL,摇匀即得;pH6.8溶出介质:取0.2 mol/L磷酸二氢钾溶液250 mL,与0.2 mol/L氢氧化钠溶液112 mL混匀后,再加水稀释至1000 mL,摇匀即得;水:纯化水。
1.4 溶液制备 精密称取利巴韦林对照品适量,加水溶解并稀释制成约50 μg/mL的溶液,作为对照品溶液。溶出过程中在每个时间点分别取样并滤过,取续滤液作为供试品溶液。
1.5 溶出方法及取样时间点 取各企业胶囊12粒,按《中国药典》2010年版(二部)附录Ⅹ C第一法(篮法)操作,溶出介质体积900 ml,溶出温度37 ℃,转速50 r/min,测定药品在pH1.2、pH4.5、pH6.8缓冲液和水4种溶出介质中的溶出曲线。取样时间点为5、10、15、20、30、60 min。
1.6 色谱条件 参照USP36中利巴韦林片剂溶出度的测定方法,采用高效液相色谱法,按外标法以峰面积计算溶出量。色谱柱:C18柱,如Waters T3 C18色谱柱(4.6 mm×25 mm,5 μm);流动相:4 g/L的磷酸二氢钠溶液(用5%氢氧化钠溶液调节pH至5.0±0.05)-乙腈(98︰2);流速:1 mL/min;检测波长:UV225 nm;进样体积:10 μL。
1.7 液相色谱方法的方法学验证
1.7.1 线性范围考察:称取利巴韦林对照品适量,加水制成400 μg/mL的对照品储备溶液。精密量取对照品储备液适量,加水稀释制成200、100、50、25、12.5、5、2.5 μg/mL的线性考察对照溶液,按上述色谱条件进样测定。
1.7.2 精密度实验:取利巴韦林对照品溶液连续进样6次,计算峰面积RSD 。
1.7.3 回收率实验:精密量取已测定的溶出液(利巴韦林浓度约100 μg/mL)2 mL,分别加入利巴韦林对照品储备溶液0.3、0.5、0.7 mL,再加入溶出介质定容至8 mL,每个浓度配3份。作为供试品溶液进样测定。
2 结果
2.1 与溶出度相关的理化性质的测定
2.1.1 溶解度的测定:利巴韦林在4种溶出介质中的溶解度均大于200 mg/mL,由此可知,利巴韦林易溶解且溶解度非pH依赖。
2.1.2 不同溶出介质中的稳定性:4种溶液的RSD值(n=5)均小于0.5%,可得利巴韦林在4种溶出介质中12 h内均稳定。
2.1.3 考察过滤膜对利巴韦林的吸附作用:3种溶液的峰面积无明显变化,也无下降趋势,可认为过滤膜对利巴韦林无吸附作用。
2.2 液相色谱方法的方法学验证
2.2.1 线性范围考察:以浓度为横坐标,以峰面积为纵坐标,绘制标准曲线,见图1。

图1 利巴韦林含量测定方法的标准曲线Fig.1 The standard curve in assay of Ribavirin
求得回归方程为:Y=14107X+4027,r=1。由此可知,本方法中利巴韦林进样浓度在2.5~200 μg/mL范围内线性良好。
2.2.2 精密度实验:峰面积RSD为0.04%,表明仪器精密度良好。
2.2.3 回收率实验:4种溶出介质得到的回收率结果见表1。
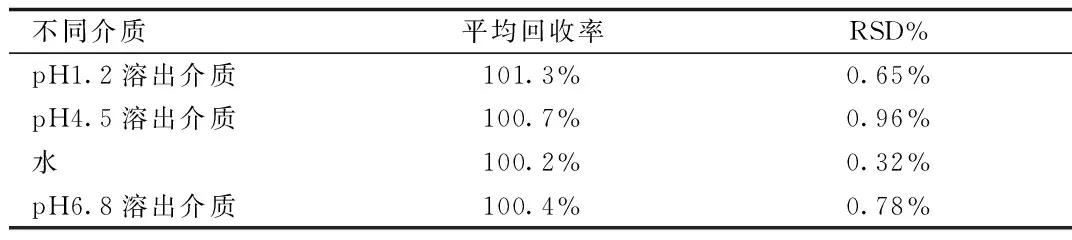
表1 4种溶出介质的回收率测定结果Tab.1 Recovery results of four kinds of dissolution mediums
2.3 溶出曲线测定结果 各企业产品在不同溶出介质中的溶出曲线见图1,15 min时的平均溶出量结果表2。由结果可知,A企业与D企业的胶囊可以在4种溶出介质中15 min时的平均溶出量达到85%以上,而B企业胶囊在pH1.2盐酸溶液中不能达到此标准,C企业胶囊在pH1.2盐酸溶液和水中不能达到此标准。不同溶出介质中,pH4.5及pH6.8缓冲液中各企业溶出行为较一致,而在pH1.2和水的溶出介质中,各企业溶出行为差异较大。
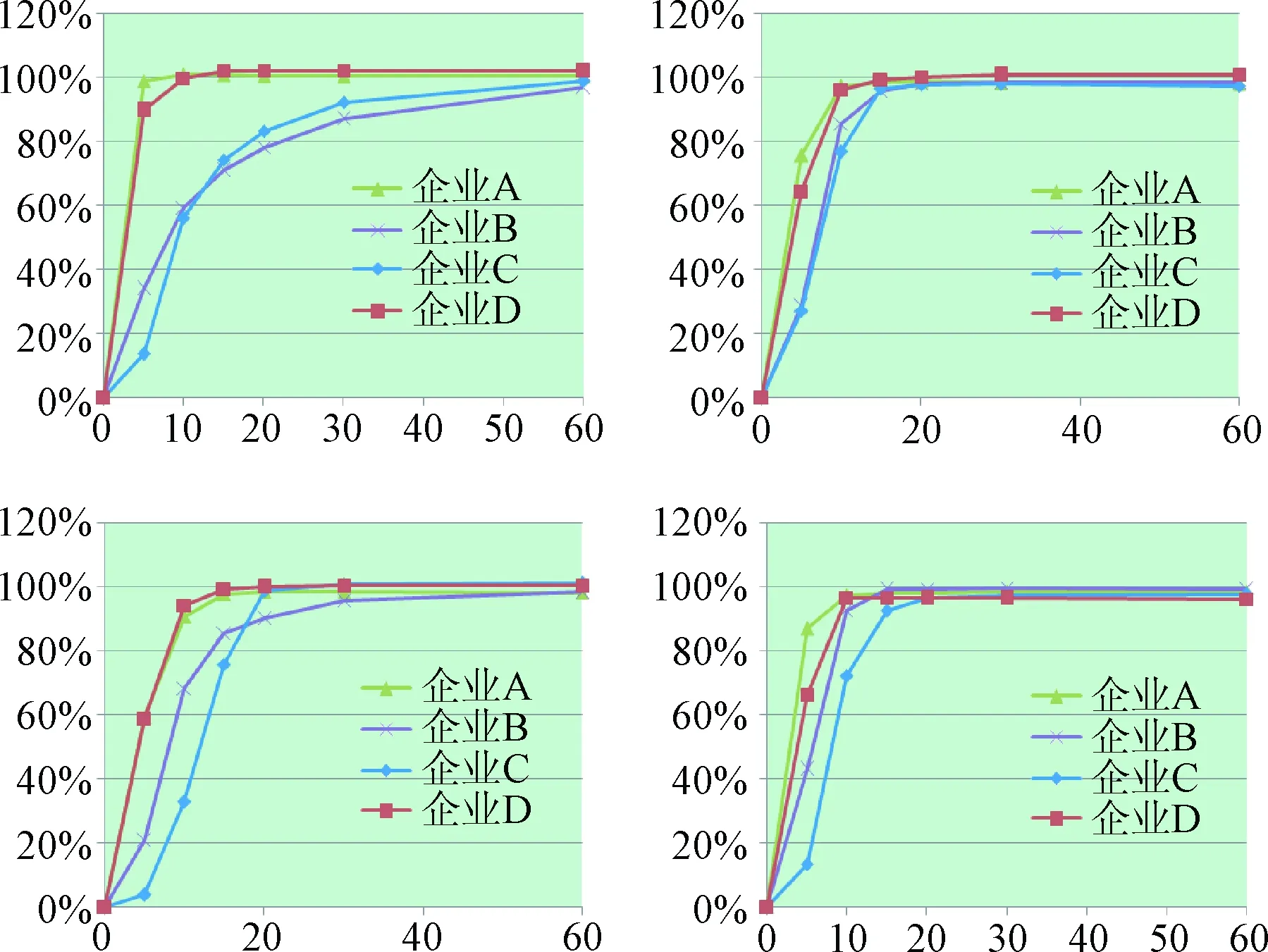
图1 利巴韦林胶囊在不同溶出介质中的溶出曲线A:pH1.2溶出介质;B: pH4.5溶出介质;C:水;D:pH6.8溶出介质Fig.1 Dissolution curves of Ribavirin capsules in different mediumsA:pH1.2 medium;B: pH4.5 medium;C:水;D:pH6.8 medium
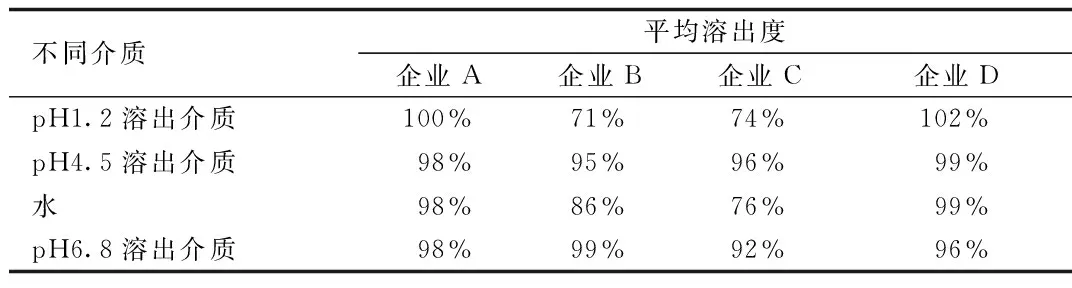
不同介质平均溶出度企业A企业B企业C企业DpH1.2溶出介质100%71%74%102%pH4.5溶出介质98%95%96%99%水98%86%76%99%pH6.8溶出介质98%99%92%96%
3 讨论
常规的胶囊溶出装置为转篮,FDA溶出数据库中推荐的利巴韦林胶囊的溶出条件也为转篮法。所以本实验中首选篮法,实验过程中各企业的胶囊均可以迅速破裂,并且由于工艺中采用了制粒的步骤,胶囊内容物会逐渐从转篮中析出,这样就不会出现由于转篮无法更有效的带动积于杯底的粉末而造成溶出滞后的现象。由实验现象可得篮法适合利巴韦林胶囊。
根据建立溶出曲线测定方法的指导性建议[8-9],一般从低转速开始实验。采用篮法中较低转速50 r/min的实验结果中,如果以15 min平均溶出量大于85%为限度,有3条曲线未达到要求,具体为B企业的pH1.2的溶出介质和C企业pH1.2和水的溶出介质。鉴于FDA溶出数据库中提供的参考方法中转速为100 r/min,所以将这3条溶出曲线在100 r/min的条件下再次测定,实验结果为这3条溶出曲线15 min时的溶出量均比50 r/min下提高了约10%,所以它们在100 r/min的条件下均可达到15 min溶出大于85%的要求或处于达标边缘。如果从50 r/min时溶出的差别并不能代表体内溶出过程的差别的角度,可以选择100 r/min。但本文从建立具有一定区分力的溶出方法的角度选择了50 r/min的转速条件,因为有区分力的方法可以更好的为提高质量服务。
溶出试验初期进行了5、10、15、20、25、30、40、60 min这8个时间点的取样。经过测定利巴韦林胶囊溶出迅速,20 min和30 min溶出量的差值小于10%,而30 min时大部分的样品已达到溶出的饱和状态,所以取消了25 min和40 min的时间点。
溶出试验中发现即使同厂家同批次的各粒胶囊之间溶出行为的差异也比较大,如50 r/min的条件下C厂家15 min时12粒胶囊的平均溶出量为74%,而12粒胶囊的实际溶出量为62%~95%,RSD=16%(n=12)。此外利巴韦林胶囊为速释制剂,在胃中的溶出对吸收影响较大,但部分企业产品在pH1.2的溶出介质中溶出较慢。溶出曲线测定中反映的问题说明国产利巴韦林胶囊的制剂工艺水平还有提升的空间。
多种pH溶出介质中的溶出曲线是评价口服固体制剂内在质量的一种重要手段,也是仿制药质量一致性评价的重要手段。利巴韦林胶囊的原研产品为Merck制药厂生产的Rebetol[10],但该产品从未在国内进口,在原研产品不易获得的情况下,对国内制剂产品的溶出行为的考察就尤为重要。本工作也为利巴韦林胶囊仿制药质量一致性评价工作的进一步开展提供了实验基础。
[1] 王娟,吴涛,詹思延,等.国内外利巴韦林药品信息比较[J].中国药物应用与监测,2004,6(4):48-51.
[2] 余文英.利巴韦林的研究应用及展望[J].亚太传统医药,2010,6(11):175-177.
[3] 刘丽欣,王岳.利巴韦林临床研究进展[J].现代中西医结合杂志,2008,17(35):5542-5543.
[4] 刘利容,吴涛,詹思延,等.利巴韦林的安全性和有效性-Meta分析结果的系统综述[J].药物不良反应杂志,2006,8(3):184-187.
[5] 张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40(12):946-955.
[6] 孙婷,姜建国,宋更申,等.国内外不同厂家马来酸依那普利片在4种溶出介质中溶出曲线的比较[J].中国药房,2014,25(32):3053-3056.
[7] 伏圣青,陈华,南楠,等.艾司唑仑片溶出度检测方法的建立以及溶出曲线评价[J].药物分析杂质,2013,33(5):885-888.
[8] 谢沐风.简介日本“药品品质再评价”工程(溶出度研究系列一)[J].中国药品标准,2005,6(6):42-46.
[9] 谢沐风.改进溶出度评价方法, 提高固体药物制剂水平—论如何提高我国口服固体制剂的内在品质(溶出度研究系列二)[J].中国药品标准,2005,7(1):43-46.
[10] U.S.Department of health and human services.FDA Orange Book[S].2015,35th
(编校:王冬梅)
Establishment of dissolution curves test method of Ribavirin capsules and investigation with domestic ribavirin capsules of dissolution behavior
YANG Hong-miao1, LIN Juan2, MIN Qi3, LIAO Hai-ming1, FAN Hui-hong1Δ
(1.National Institutes for Food and Drug Control, Beijing 100050, China; 2.Xinjiang Uygur Autonomous Region institute For Food and Drug Control, Wulumuqi 830004, China; 3.Jinzhou Institute for Drug control, Jinzhou 121001, China)
ObjectiveTo establish the dissolution curves test method of Ribavirin capsules, and investigate dissolution behavior of domestic Ribavirin capsules.To provide experimental basis for generic drugs quality consistency evaluation.MethodsAccording to the first dissolution method(basket method)stated in appendix Ⅹof Chinese Pharmacopeia(2010 edition),the rotation speed was 50 r/min with dissolution medium volume of 900 mL. The dissolution profiles of Ribavirin capsules in four different mediums(pH 1.2 hydrochloric acid solution,pH 4.5 acetic buffer,pH 6.8 phosphate buffer and water)were determined by HPLC.The determination was performed on C18column with mobile phase consisted of 4 g/L sodium dihydrogen phosphate solution(pH adjusted to 5.0±0.05 using 5% sodium hydroxide solution)-acetonitrile(98:2)at the flow rate of 1.0 mL/min.The detection wavelength was 225 nm,and sample size was 10 μL.ResultsThe linear range of ribavirin was 2.5-200 μg/mL(r=1).RSD of precision and stability tests were lower than 0.5%.The average recoveries were 101.3%, 100.7%, 100.2%, 100.4% in four mediums.Dissolution behavior of capsules can be more consistent and rapid dissolution in pH4.5 and pH6.8 mediums.But they were quite different in pH1.2 and water mediums, and some of their average dissolution at 15 min could not reach 85%.ConclusionThis method is accurate and reliable.There is a difference between domestic Ribavirin capsules dissolution behavior, and the formulation processes have room for improvement.
Ribavirin capsules;dissolution curves;generic drugs quality consistency evaluation
杨洪淼,女,硕士,助理研究员,研究方向:生化药品的质量分析和质量标准的研究,E-mail:yanghongmiao@163.com;范慧红,通讯作者,女,博士,研究员,研究方向:生化药品的质量分析和质量标准的研究,E-mail:shenghuayaoshi@126.com。
R917
A
1005-1678(2015)09-0155-03

