2015年中考化学模拟试题(十)


满分:65分 时间:70分钟
可能用到的相对原子质量:H—1 C—12O—16 Na—23 Cl—35.5
一、选择题(本题包括13个小题。1~11小题,每小题1分;12、13小题,每小题2分,共15分。每小题只有一个最符合题目要求的选项)
1.为了确定某化肥的种类,下列探究过程发生了化学变化的是( )
A.观察其外观,为白色晶体
B.闻其气味,无明显气味
C.测其溶解性,可溶于水
D.加熟石灰研磨,有刺激性气味
2.走进四环时代的沈阳市苏家屯区,正在成为国内外名企瞩目的焦点。投资22亿元的中铝钛镍加工材质项目正式投产后,可形成6000吨钛、3000吨镍、1000吨铬、锆、铜的生产能力。题中提到的钛、镍、铬、锆、铜属于( )
A.金属材料
B.无机非金属材料
C.有机合成材料
D.复合材料
3.下列生活中接触到的物质属于混合物的是( )
A.空气 B.氧气
C.纯碱D.干冰
4.“绿色化学”的核心是从源头上减少对环境的污染,是21世纪化学科学发展的重要方向之一。你认为“绿色化学”是指化学工业生产中( )
A.对废气、废水、废渣进行严格处理
B.少用或不用有害物质以及少排或不排放有害物质
C.不使用任何化学物质
D.在化工厂种草、种树,使其成为花园式工厂
5.燃料电池是一种将化学反应产生的能量直接转换成电能的装置。下列燃料电池比较适合宇宙飞船上使用的是( )
A.CH4\|O2燃料电池
B.C2H5OH\|O2燃料电池
C.H2\|O2燃料电池
D.CO\|O2燃料电池
6.合成材料的使用极大地方便了人们的生活。下列生活用品的主要材质属于有机合成材料的是( )
7.燃烧需要一定条件。铁丝在空气中灼热发红,但不能燃烧,而在纯氧中却能燃烧,这一事实与下列的哪一因素关系最密切( )
A.铁丝的表面积
B.燃烧区的温度
C.氧气的浓度
D.铁的着火点
8.食用下列食品,不会对人体健康造成威胁的是( )
A.霉变的大豆
B.用工业用盐如亚硝酸钠腌制的鱼
C.加入少量小苏打的馒头
D.用硫酸铜浸泡过的粽子叶
9.如下图所示,在甲、乙两个等体积的塑料瓶中,分别盛有等体积的滴有紫色石蕊溶液的水,用图示两种方法收集满二氧化碳后,旋紧瓶盖振荡,则观察到的现象是( )
A.甲瓶没有任何变化,乙瓶紫色石蕊溶液变红
B.甲、乙两瓶紫色石蕊溶液均不变红
C.甲、乙两瓶紫色石蕊溶液均变红,甲瓶变瘪,乙瓶外形不变
D.甲瓶变瘪,乙瓶溶液变红
10.右图是氧元素在周期表中的信息。下列说法正确的是( )
A.氧元素原子序数为8
B.氧原子核内质子数为16
C.氧元素属于金属元素
D.氧元素在地壳中的含量为16%
11.洗发产品中含有的柠檬酸(C6H8O7)能使头发柔顺有弹性,且气味清香。下列关于柠檬酸的说法中,正确的是( )
A.柠檬酸属于氧化物
B.柠檬酸是由6个碳原子、8个氢原子和7个氧原子组成的
C.柠檬酸中氧元素的质量分数最大
D.柠檬酸中碳、氢、氧三种元素的质量比为6∶8∶7
12.为了测定液化气中丙烷(C3H8)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质丙烷氧气水二氧化碳X
反应前质量/g4.412.8000
反应后质量/g007.24.4a
下列判断正确的是( )
A.表中a的值为5.6
B.X可能是该反应的催化剂
C.X可能含有氢元素
D.X只含碳元素
13.下列除杂的方法正确的是( )
A.NaCl中含Na2CO3,加稀盐酸,蒸发
B.CaCO3中含CaO,高温
C.Fe中含Cu,加稀硫酸,过滤
D.CaCO3中含Na2CO3,加水后蒸发
二、填空与简答题(本题包括5个小题。共20分)
14.(4分)建立语言与符号的联系是学习化学的重要特征。从C、H、N、Cl、Fe五种元素中,选择适当元素符号按要求填空。
(1)用适当的符号和数字填空:
2个氢气分子;
氯化亚铁中的阳离子。
(2)写出符合下列要求的物质的化学式:
最简单的有机物;
含氯元素的氮肥。
15.(4分)从微观上认识化学反应可以加深对物质变化的理解。以下是某化学反应的微观示意图:
(1)该反应的化学方程式为。
(2)以上变化的基本反应类型是。
(3)结合上图,从原子、分子的角度分析,在化学反应过程中,可分,而不能再分。
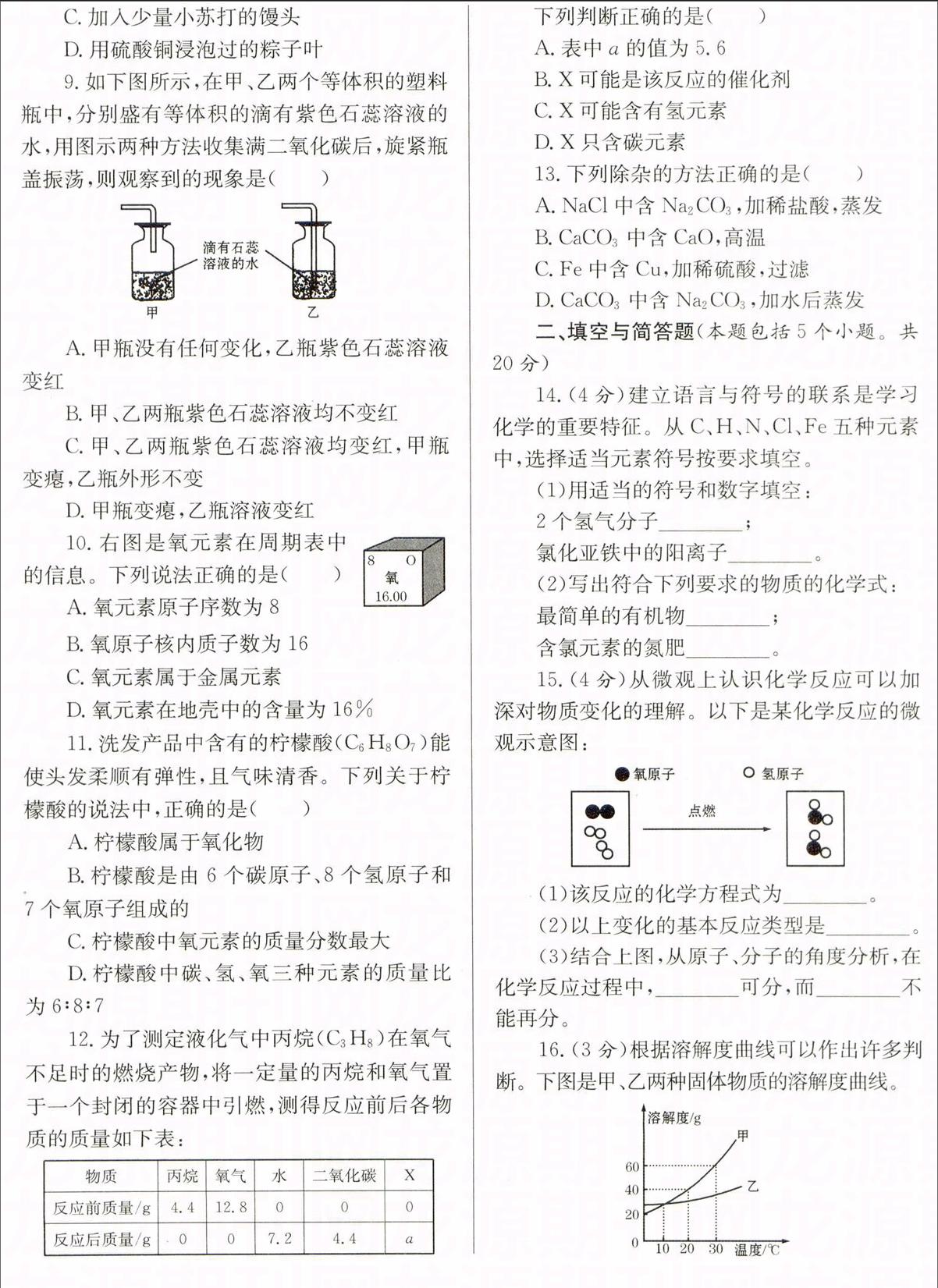
16.(3分)根据溶解度曲线可以作出许多判断。下图是甲、乙两种固体物质的溶解度曲线。
据图回答:
(1)10℃时,甲物质的溶解度(填“>”、“=”或“<”)乙物质的溶解度。
(2)把30℃时等质量的甲、乙两物质的饱和溶液降温到10℃时,析出晶体较多的是。
(3)20℃时,将50g甲物质放入盛有100g水的烧杯中,再将烧杯内物质升温到30℃(不考虑水蒸发),溶液中不变的是(填字母)。
A.溶剂的质量
B.溶液的质量
C.溶质的质量分数
D.以上都不变
17.(5分)每到冬天,市场上便有一种“热宝”出售,它是一个装有化学药品的小袋。使用时,撕去它的保护膜贴在身体上,不久便会产生热量。已知小袋中装有铁粉、碳粉和少量氯化钠。
(1)取小袋内物质加入稀盐酸中,发生反应的化学方程式为。
(2)将袋内物质放在足量O2中燃烧,写出反应的化学方程式:①;②。
(3)将袋内物质加入一定量的CuSO4溶液中,充分反应后过滤,滤液中的溶质一定有(填化学式)。
18.(4分)有一包白色粉末可能由NaCl、NaNO3、MgCl2、CuSO4中的一种或多种物质组成。小明为了探究其成分,设计并完成了如下图所示的实验。
根据以上实验,回答:
(1)操作①是。
(2)原固体粉末中一定没有的成分是。
(3)生成沉淀A的化学方程式是。
(4)根据上述实验(填“能”或“不能”)确定原固体粉末中含有NaCl、NaNO3。
三、实验与探究题(本题包括4个小题。共24分)
19.(4分)规范的实验操作是保证实验安全和实验成功的前提。
请回答:
(1)点燃可燃性气体之前,应先。
(2)使用试管加热液体时,液体体积不得超过试管容积的。
(3)蒸发操作时,待蒸发皿中出现时停止加热。
(4)稀释浓硫酸时,切不可将。
20.(4分)在实验室里,我们常用以下装置制取某些气体。
(1)写出标有字母a的仪器名称:。
(2)用二氧化锰作催化剂加热氯酸钾制氧气,反应的化学方程式为。
(3)实验室用上述反应制取氧气,可选用的发生装置和收集装置是。
(4)如果用块状电石和水在常温下反应制取乙炔气体,应选择的发生装置是。
21.(7分)甲酸(HCOOH)通常是一种无色易挥发的液体,它在浓硫酸作用下易分解,反应方程式为HCOOH=CO↑+H2O。某课外活动小组的同学欲用该反应来制取CO,并还原红棕色的氧化铁粉末。现有下列仪器或装置供选择:
(1)用甲酸滴入浓硫酸的方法制取CO,应选(填序号)装置;如果要除去CO中混有的少量甲酸气体,最好选择上图中的(填序号)进行洗气。
(2)用上述方法制取的CO还原氧化铁,并检验气体产物,则各仪器的接口连接顺序为(填字母)。
(3)在对氧化铁粉末加热前,为安全起见,应进行的一项重要操作是。
(4)从开始加热到实验结束,氧化铁粉末的颜色变化为,反应方程式为。
(5)上述实验的尾气不能直接排放到空气中,请你说出一种处理尾气的方法:。
22.(9分)实验室有一瓶化肥的标签已脱落,只知道它是NH4Cl、(NH4)2SO4、NH4HCO3和尿素\中的一种。请你完成以下探究:
【猜想】
猜想①:该化肥是NH4Cl;
猜想②:该化肥是;
猜想③:该化肥是NH4HCO3;
猜想④:该化肥是尿素。
【实验探究】
(1)取少量样品在研钵中与熟石灰研磨,有刺激性气味的气体放出,证明猜想不成立;写出其中一种化肥发生该反应的化学方程式:。
(2)如图1,另取少量样品于试管中,滴加适量水振荡,再选图2中的溶液滴入试管中,若无气泡放出,则猜想不成立。
(3)在步骤(2)的试管中再滴入图2中的溶液,若,则猜想①成立;若,则猜想②成立,其反应的化学方程式为。
四、计算题(本题包括1个小题。共6分)
23.食醋是常用的调味品,某同学欲探究食醋中醋酸的质量分数,进行了下面的实验:取20g烧碱放入180g水中,制成烧碱溶液。向200g食醋中逐滴滴加该溶液,至恰好完全反应,共用去烧碱溶液40g。
(已知:反应的化学方程式为CH3COOH+NaOH=CH3COONa+H2O)
求:
(1)烧碱溶液中溶质的质量分数。
(2)食醋中醋酸的质量分数。
【拟题人:孟令卓】

