适配体在毒品毒物分析中的应用
孙美琪,曹芳琦,胡小龙,张玉荣,陆鑫蔚,李茂盛,曾立波
(1.中国医药工业研究总院 上海医药工业研究院 创新药物与制药工艺国家重点实验室,上海200437;2.上海市公安局物证鉴定中心上海市现场物证重点实验室,上海200083;3.上海市刑事科学技术研究院,上海200083)
鉴定综述
R e v i e w
适配体在毒品毒物分析中的应用
孙美琪1,2,曹芳琦3,胡小龙2,张玉荣2,陆鑫蔚2,李茂盛2,曾立波2
(1.中国医药工业研究总院 上海医药工业研究院 创新药物与制药工艺国家重点实验室,上海200437;2.上海市公安局物证鉴定中心上海市现场物证重点实验室,上海200083;3.上海市刑事科学技术研究院,上海200083)
适配体是体外合成的能与蛋白质、其他小分子物质、有机离子等等各种配体特异结合单链DNA/RNA,是由SELEX(体外指数富集配体系统进化技术)技术筛选得到,适配体具有对靶标的高特异性和亲和性、合适的化学稳定性、无免疫原性和毒副作用的优点。利用适配体的这些优越性是得适配体可以作为生物识别分子元件应用于传感器及分析试纸中,进而可以快速高效的检测毒物毒品。为了大大提高办案的效率,为维护法治、打击犯罪提供更好的技术支持,通过介绍了一种基于适配体(aptamer)为识别元件的高选择、高灵敏、快速的毒物毒品检验方法。
适配体;SELEX;毒品毒物;检测
1 适配体
早在20世纪60年代,人们就提出核酸除了具有模板功能,还能折叠成复杂的三维形状,表现出生物化学活性。含有约1015个核酸分子的随机序列寡核苷酸库可以通过化学合成产生,且可以用于平行筛选以获得具有特定功能的,如高亲和性的结合配体(适配体)或催化活性的核酸酶(核糖核酸酶、脱氧核糖核酸酶)。Tuerk等[1]在1990年提出了一种新的体外筛选和扩增方法,命名为SELEX(指数级富集的配体系统进化)。他们应用一个组合核酸库筛选RNA寡核苷酸,这些RNA寡核苷酸对非核酸靶标(T4DNA聚合酶gp43)结合非常牢固并具有选择性。同年,Ellington等[2]也用相似的筛选方法从随机序列的RNA库中分离出RNA分子,这些RNA分子能识别并结合小分子有机染料(汽巴克隆蓝、活性蓝4)。他们将这些筛选出的个别的RNA序列命名为aptamer(“适配体”),它源于拉丁文词aptus,意思为“适合”。两年后他们又从一个化学合成的随机序列的DNA库中成功筛选到单链DNA(ssDNA)适配体[3]。
适配体的功能是以其稳定的三维结构为基础,其三维结构取决于其一级序列、核苷酸分子的长度(少于100 nt)与环境条件。典型的结构单元包括茎,内环,凸环,发夹结构,四角环,假结体,三重体,吻合复合物和G-四链体结构。在靶分子存在时,适配体通过自适应的构象变化和三维折叠形成特异性的靶分子结合位点。适配体和靶分子间的作用结合了形状互补,芳香化合物间的堆积作用,适配体的碱基堆积作用,带电基团的静电作用和氢键作用的特点[4-5],这种对靶分子表现出高亲和性结合和高特异性识别的适配体有时被形容为“化学抗体”,实际上它们表现出许多优于抗体的优点:(1)它们可以针对任何靶分子,包括毒性物质,而且适配体分子比抗体小(5~15kDa),可以接近免疫球蛋白很难接近的区域。(2)它们容易并且可重复合成,易于保存,具有化学稳定性。(3)它们易于化学修饰和简单的设计,进而可方便与各种衍生物偶联。因此,适配体成为开发分析方法的理想工具,在治疗和诊断试剂、有效的生物传感材料、有效的色谱、电泳[分离材料中扮演着重要的角色[6-11]。
在治疗应用方面,1990年首次报道了评价适配体作为病理性靶蛋白抑制剂的研究。这个突破性的研究证明由HIV进化来的,一种利用病毒和细胞蛋白到病毒转录的TARRNA反过来能够抑制该病毒的复制[12]。由tRNA启动子表达的TAR适配体序列作为病毒Tat和CD4+T细胞中的细胞周期T1蛋白的诱饵寡核苷酸。表达高水平TAR适配体的细胞被证明它具有对病毒复制和细胞毒性的高度抗性[12-13]。这些结果描述了一种抑制HIV复制的新方法,第一次展示了RNA适配体能用作治疗药物,直接与临床相关蛋白结合并抑制其活性。2004年是这个领域中具有里程碑的一年,美国食品与药品监督管理局(FDA)批准哌加他尼那(Macugen)上市。第一个被批准的具有治疗功能的适配体是人-VEGF(血管内皮生长因子)的适配体。这种适配体的聚乙二醇化的形式叫做哌加他尼,是新近开发的治疗湿性老年性黄斑变性的药物活性成分。抗血管上皮因子的适配体药物(pegaptnib)已被美国食品和药品管理局批准,用于治疗新生血管老年性黄斑变性[14]。
除了治疗市场,适配体也应用在新的分析系统和检测方法的开发(例如,生物分析、医学诊断,也包括环境分析)。比如将适配体引入分析器件,作为一种分子识别工具用在液相色谱、电色谱以及毛细管电泳等分离检测方法中[15-18],可以将两者的优势结合起来,是非常有效的分析手段。适配体的“靶分子广、容易合成、具有核酸的性质”等特点,可以拓宽待测物范围、降低成本、减少非特异性吸附。同时,适配体的高亲和力保证了分离效果和选择性。适配体也可结合纳米等材料用于各种不同的生物分析检测,这种功能化的适配体纳米的使用即可在溶液相中进行也可在固相中进行,作为捕获和信号放大工具的方法[19],可在食品安全分析领域内对生物毒素、重金属离子、农药残留等食品中的危害因子进行高灵敏、高特异性的快速检测。
除此之外,治疗和生物医学用的适配体的发展正在一个广泛的前沿领域推进[20-21],而且适配体的医学应用研究在肿瘤影像和治疗[22-23],流感病毒的检测和抑制以及一般的临床诊断方面更超前[24-26]。可以预计在不久的将来,大量的适配体将会发展成为药物和分析诊断工具。
2 SELEX筛选技术原理
SELEX过程具有体外筛选和酶扩增的迭代循环特点,对于一个给定问题的解决,其模拟达尔文式进化的过程驱使筛选向相对少的,但最优化的结构靠近[27]。整个过程是连续的重复步骤,包括筛选(结合、分离、洗脱),扩增和调节(图1)。整个过程开始于一个随机的单链寡核苷酸库,该库通常含有约1015~ 1016个单链核酸,该核酸序列的5’和3’端都带有一端固定的序列,在PCR过程中行使引物结合位点的功能,中间为随机合成的序列。这种库的中间随机序列区一般包含有20~80 nt,两端的引物位点分别为18~21 nt。对于DNA适配体的筛选,这个库可以直接用于SELEX过程的第一轮筛选。对于RNA适配体的筛选,在开始SELEX筛选之前,必须将DNA库转录为RNA库。在第一轮SELEX筛选中,复杂的RNA或DNA库与靶分子混合孵育,随后通过严格的冲洗步骤,使形成的结合复合物与未结合的和弱结合的寡核苷酸分离。这是关键的步骤之一,对筛选的适配体的结合特性有极大影响。结合靶分子的寡核苷酸被洗脱,并通过PCR或RT-PCR扩增,通过纯化相关的单链DNA或者通过体外转录和纯化合成的RNA,使形成的双链DNA转化为一个新的寡核苷酸库。这个新筛选出的富集的寡核苷酸库在下一轮SELEX循环中再次用于与靶分子的结合反应,通过筛选和扩增的迭代循环,最初的随机寡核苷酸库减少为相对较少的、对靶分子具有最高亲和性和特异性的基元序列。一般来说,适配体筛选需要6~20轮SELEX循环。
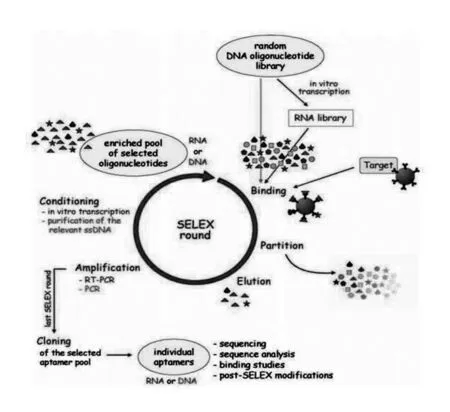
图1 SELEX筛选过程图
3 适配体在毒品毒物分析中的应用
自20世纪80年代世界毒品毒物犯罪活动日益猖獗起,有关于毒品检测问题就迫切需要解决。而国内外陆续报道关于毒品毒物的多种检测方法,多是需要依赖一些价格昂贵的检测仪,这就限制了毒品毒物犯罪案件的现场快速检验。
张强等[28]将体外合成的ssDNA文库固相化于琼脂糖凝胶颗粒表面,液相中甲胺磷与其结合的DNA分子从固相表面分离,进而建立了非固相化SELEX技术。10轮筛选后,经荧光法检测,筛选效率达到62.1%,并最终获得了5条针对甲胺磷的核酸适体。
Handy等[29]首次筛选出一种小分子海洋生物毒素——蛤蚌毒素(STX)的核酸适体。STX经过化学修饰与血蓝蛋白KLH偶联形成STX-Jeffamine-KLH复合物,再将其固定在环氧基化磁珠表面,经过10轮筛选(其中4~10轮用Jeffamine-KLH反筛)获得特异性识别STX的核酸适体。选取其中一条适体APTSTX1用SPR检测,有良好的结合率且无交叉反应。
Anniron[30]在1997年报道了RNA适体检测多巴胺的检出限达到2.8 umol/L。
陆鑫蔚等[31]也利用SELEX技术成功筛选出可以特异性识别甲基苯丙胺的适配体,后期可以进一步做成作为生物分子识别元件应用于试剂盒或生物传感器形式,携带方便,用于刑事案发现场,便于快速检测。
Baker等[32]建立了电化学传感器平台来检测可卡因。将亚甲基蓝连接到适配体的一端,适配体通过另一端固定在电极表面,且适配体作为检测适配体-结合反应的氧化还原探针。靶分子不存在时,认为适配体部分保持展开结构,在氧化还原探针与电极表面间有较大的距离。靶分子存在时,适配体可能折叠成结合位点,探针和电极表面的距离减小,改变了电子传递,增加了可测的亚甲基蓝的还原峰。
Li[33]成功的分离了可卡因和其类似物爱康宁。他们将靶分子本身作为信号探针,发展了一系列基于适配体-CE技术的分析方法。可卡因及其类似物爱康宁在分子结构中都含叔胺基团,因此都能够作为三联吡啶钌的共反应物,在铂电极上产生电化学发光现象。所以两种物质的混合样品经过CE分离,会产生两个ECL峰,如果样品中含有一定量的可卡因适配体,可卡因与适配体复合物的形成,使游离的可卡因的数目减少,复合物和游离的可卡因在毛细管中会被分离,可卡因自身的峰降低。与此同时,爱康宁不与适配体作用,它的峰不会变,所以通过可卡因的峰降低可直接实现对可卡因的选择性识别和定量检测,检测限为2umol/L。
liu[34]基于带有测流技术的试纸样平台对可卡因进行检测,使用先前报道的腺苷和可卡因的适配体开发了这种新的适配体试纸[35],可卡因检测也应用在人血清样品中。这种分析形式大多是用于抗体的受体,但是抗体稳定性差、不能在常温贮藏下长期保持生物活性问题,而适配体在高温或不良环境下非常稳定、经济性强,可用来替代抗体[1,36]。这种试纸经过后期改进做成快速检测试剂盒,可以达到对可卡因的犯罪现场快速检测。适配体对靶标的高特异性和亲和性使得以适配体为识别分子的高选择、高灵敏、快速的毒物毒品检验方法必能为维护法制、打击犯罪提供更好的技术支持。
此外,本课题也初步筛选出能够识别氯胺酮的适配体,并对该适配体的特异性、亲和性进行表征,证明了该适配体不会与美沙酮、美沙芬发生交叉反应,进一步可以将该适配体作为识别分子研制成试剂盒,可以达到现场快速检测的目的,同时,也避免了交叉反应提高了准确性。
4 展望
核酸适配体作为一种人工合成的核酸,具有稳定的二级结构和高特异性、高亲和力、便于化学修饰与功能化等特点,且易于进行大量低成本的可重复性合成。无机离子、有机分子、生物大分子蛋白质、酶、受体等乃至细胞、微生物均可能存在与其相对应的高特异性亲和配体。核酸适配体的筛选过程,不依赖于生物体,并且适配体的筛选过程无需在生理条件下进行,可以筛选出没有免疫原性或低免疫原性,甚至具有毒性的靶物质的核酸适配体。除此之外,这些核酸适配体的末端易于修饰上各种活性基团如:氨基,磷酸基,巯基,荧光标记物,电化学标记物等,用于表面固定修饰或者检测。基于这些优点,适配体在医疗诊断、治疗手段、新药物的开发、药物输送系统、生物影像、分析试剂、毒品毒物检测、食品安全分析等领域扮演着重要的角色。然而,核酸适体技术在毒品毒物分析领域的应用才刚刚起步,有很多可深入开发和研究的内容,总结起来主要有以下两个方面。
首先,针对特异性识别小分子毒品毒物的核酸适配体的筛选。SELEX过程起始于一个随机的含有约1 015~1 016个单链寡核苷酸库,该库中间为随机序列,两端为引物结合为点。这个库是否是真正的随机是整个适配体筛选过程的第一个关键步骤。序列随机性发生一点偏离,就可能导致序列空间的歪曲,反过来就限制了能够和靶分子高特异性结合的适配体的捕获。因此,寡核苷酸库的质量尤其重要。适配体筛选过程中寡核苷酸分离的常用方法是通过过滤或磁珠捕集或亲和柱捕集,必须先将靶分子固定于分离膜、磁珠或亲和柱上,而很多毒品毒物为小分子物质,需要对其构建活性基团才能固定于分离基质上。然而,这种对小分子的改性是否会掩盖活性位点,是否会造成非特异性吸附等问题仍需要更深的研究。
其次,适配体作为生物识别分子引入毒品毒物快速检测方法的开发中。众所周知,在案发现场快速准确检测毒品毒物,能大大提高办案的效率。适配体对于靶分子具有高度的特异性和亲和性,以及超越抗体的优越性使得适配体可以作为生物识别分子元件应用于传感器及分析试纸。但是,核酸适配体分子的优化条件、灵敏度的提高方法仍需探讨。随着研究的深入,适配体作为一种新的识别元素会产生高选择、高灵敏、快速的毒物毒品检验方法,从而为维护法制、打击犯罪提供更好的技术支持,在毒品毒物检测中展现魅力。
[1]Tuerk C.,Gold L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J].Science(New York,NY),1990,249(4968):505-510.
[2]Ellington A.D.,Szostak J.W.In vitro selection of RNA molecules that bind specific ligands[J].Nature,1990,346(6287):818-822.
[3]Ellington A.D.,Szostak J.W.Selection in vitro of singlestranded DNA molecules that fold into specific ligandbinding structures[J].Nature,1992,355(6363):850-852.
[4]Patel D.J.,Suri A.K.,Jiang F.,etal.Structure,recognition and adaptive binding in RNA aptamer complexes[J].Journal ofmolecular biology,1997,272(5):645-664.
[5]Hermann T.,Patel D.J.Adaptive recognition by nucleic acid aptamers[J].Science(New York,NY),2000,287(5454):820-825.
[6]Brody E.N.,Gold L.Aptamers as therapeutic and diagnostic agents[J].Journal of biotechnology,2000,74(1):5-13.
[7]White R.R.,Sullenger B.A.,Rusconi C.P.Developing aptamers into therapeutics[J].The Journal of clinical investigation,2000,106(8):929-934.
[8]Navani N.K.,Li Y.Nucleic acid aptamers and enzymes as sensors[J].Current opinion in chemical biology,2006,10(3):272-281.
[9]Clark S.L.,Remcho V.T.Aptamers as analytical reagents[J]. Electrophoresis,2002,23(9):1335-1340.
[10]Clark S.L.,Remcho V.T.Electrochromatographic retention studies on a flavin-binding RNA aptamer sorbent[J]. Analytical chemistry,2003,75(21):5692-5696.
[11]Mendonsa S.D.,Bowser M.T.In vitro evolution of functional DNA using capillary electrophoresis[J].Journal of the American Chemical Society,2004,126(1):20-21.
[12]Sullenger B.A.,Gallardo H.F.,Ungers G.E.,et al. Overexpression of TAR sequences renders cells resistant tohuman immunodeficiency virus replication[J].Cell,1990,63(3):601-608.
[13]Sullenger B.A.,Gallardo H.F.,Ungers G.E.,etal.Analysis of trans-acting response decoy RNA-mediated inhibition of human immunodeficiency virus type 1 transactivation[J]. Journal of virology,1991,65(12):6811-6816.
[14]Ng R.,Chen E.X.Sorafenib (BAY 43-9006):review of clinical development[J].Current clinical pharmacology,2006,1(3):223-228.
[15]Yang X.,Kong W.,Hu Y.,et al.Aptamer-affinity column clean-up coupled with ultra high performance liquid chromatography and fluorescence detection for the rapid determination of ochratoxin A in ginger powder[J].Journal of separation science,2014,37(7):853-860.
[16]Connor A.C.,Mcgown L.B.Aptamer stationary phase for protein capture in affinity capillary chromatography[J].Journal of chromatography A,2006,1111(2):115-119.
[17]BerezovskiM.,Drabovich A.,Krylova S.M.,et al.Nonequilibrium capillary electrophoresis of equilibrium mixtures:a universal tool for development of aptamers[J].Journal of the American Chemical Society,2005,127(9):3165-3171.
[18]PerrierS.,Zhu Z.,Fiore E.,etal.Capillary gelelectrophoresiscoupled aptamer enzymatic cleavage protection strategy for the simultaneous detection of multiple small analytes[J]. Analytical chemistry,2014,86(9):4233-4240.
[19]Pavlov V.,Xiao Y.,Shlyahovsky B.,et al.Aptamerfunctionalized Au nanoparticles for the amplified optical detection of thrombin[J].Journal of the American Chemical Society,2004,126(38):11768-11769.
[20]Liu Y.,Lin C.,Li H.,et al.Aptamer-directed selfassembly of protein arrays on a DNA nanostructure[J]. Angewandte Chemie(Internationaled in English),2005,44(28):4333-4338.
[21]Wu C.,Han D.,Chen T.,et al.Building a multifunctional aptamer-based DNA nanoassembly for targeted cancer therapy[J].Journal of the American Chemical Society,2013,135(49):18644-18650.
[22]White J.D.,Grounds M.D.Harnessing the therapeutic potential ofmyogenic stem cells[J].Cytotechnology,2003,41(2-3):153-164.
[23]Tokunaga T.,Namiki S.,Yamada K.,et al.Cell surfaceanchored fluorescent aptamer sensor enables imaging of chemical transmitter dynamics[J].Journal of the American Chemical Society,2012,134(23):9561-9564.
[24]Jeon S.H.,Kayhan B.,Ben-Yedidia T.,et al.A DNA aptamer prevents influenza infection by blocking the receptor binding region of the viral hemagglutinin[J].The Journal of biological chemistry,2004,279(46):48410-48419.
[25]Gopinath S.C.,SakamakiY.,KawasakiK.,etal.An efficient RNA aptamer against human influenza B virus hemagglutinin[J]. Journal of biochemistry,2006,139(5):837-846.
[26]Guthrie J.W.,Hamula C.L.,Zhang H.,et al.Assays for cytokines using aptamers[J].Methods(San Diego,Calif),2006,38(4):324-330.
[27]Goringer H.U.,Homann M.,Lorger M.In vitro selection of high-affinity nucleic acid ligands to parasite targetmolecules[J]. International journal for parasitology,2003,33(12):1309-1317.
[28]张强,胡秋莲,张冠,等.甲胺磷的核酸适体筛选[J].食品安全质量检测学报,2013,(2):410-414.
[29]Handy S.M.,Yakes B.J.,Degrasse J.A.,et al.First report of the use of a saxitoxin-protein conjugate to develop a DNA aptamer to a smallmolecule toxin[J].Toxicon:official journal of the International Society on Toxinology,2013,(61):30-37. [30]Mannironi C.,Di Nardo A.,Fruscoloni P.,et al.In vitro selection of dopamine RNA ligands[J].Biochemistry,1997,36(32):9726-9734.
[31]陆鑫蔚,胡小龙,张玉荣,等.SELEX技术筛选甲基苯丙胺适配子 [J].中国司法鉴定,2014,(1):21-24.
[32]Baker B.R.,Lai R.Y.,Wood M.S.,et al.An electronic,aptamer-based small-molecule sensor for the rapid,labelfree detection of cocaine in adulterated samples and biological fluids[J].Journal of the American Chemical Society,2006,128(10):3138-3139.
[33]Li T.,Li B.,Dong S.Adaptive recognition of small molecules by nucleic acid aptamers through a label-free approach[J].Chemistry(Weinheim an derBergstrasse,Germany),2007,13(23):6718-6723.
[34]Liu J.,Lu Y.Fast colorimetric sensing of adenosine and cocaine based on a general sensor design involving aptamers and nanoparticles[J].Angewandte Chemie(International ed in English),2005,45(1):90-94.
[35]Huizenga D.E.,Szostak J.W.A DNA aptamer that binds adenosine and ATP[J].Biochemistry,1995,34(2):656-665.
[36]Mcgown L.B.,Joseph M.J.,Pitner J.B.,et al.The nucleic acid ligand.A new tool for molecular recognition[J]. Analytical chemistry,1995,67(21):663a-668a.
(本文编辑:卓先义)
App lication of Aptam ers in Forensic Toxicology
SUNMei-qi1,2,CAO Fang-qi3,HU Xiao-long2,ZHANG Yu-rong2,LU Xin-wei2,LIMao-sheng2,ZENG Li-bo2
(1.State Key Laboratory of New Drug and Pharmaceutical Technology,Shanghai Institute of Pharmaceutical Industry, Shanghai200437,China;2.Shanghai Key Laboratory of Criminal Scene Evidence,Institute of Forensic Science, Shanghai Public Security Bureau,Shanghai200083,China;3.Institute of Criminal Science and Technology, Shanghai Public Security Bureau,Shanghai200083,China)
Aptamers are synthetic single stranded RNA or DNA molecules capable of specifically binding to other target molecules.Aptamers are commonly performed by the SELEX (systematic evolution of ligands by exponential enrichment) process.They are of high specificity and affinity to targets,chemical stable,non-immunogenic and have no side effects.With these advantages,aptamers can be applied in sensors and strips as recognition entities to achieve the rapid detection of drugs and toxicants.A highly sensitive,specific and rapid method based on aptamers for the detection of drugs and toxicants is introduced in this paper.
aptamer;SELEX;drug and toxicant;detection
DF795.1
A
10.3969/j.issn.1671-2072.2015.02.014
1671-2072-(2015)02-0075-05
2014-07-16
上海市科委项目(12231202800)
孙美琪(1987—),女,硕士研究生,主要从事毒物分析与分子免疫学研究,Email:mqsun1216@163.com。
曾立波(1954—),男,研究员,主任法医师,一级法医官,硕士研究生导师,主要从事分子免疫学研究和法医毒物、毒品分析研究。E-mail:merry.magin@163.com。

