大豆蛋白结构表征方法的研究进展*
曲玲玲,郭庆启,石彦国,张 娜**
(1.哈尔滨商业大学/黑龙江省普通高校食品科学与工程实验室,哈尔滨 150076;2.东北林业大学林学院,哈尔滨 150040)
大豆蛋白是优质的植物蛋白资源之一,其营养价值高,且大豆蛋白的消化吸收率在84%~98%之间,可以直接作为人体蛋白质的主要来源,更为重要的是大豆蛋白还具有与食品的嗜好性、加工性等相关的各种功能特性[1-2]。其良好的能性质在改进食品结构、发展新食品方面有着重要意义。广泛应用于婴幼儿食品、烘焙食品、肉制品、乳制品等行业之中,其重要性日趋明显[3]。大豆蛋白因为它的蛋白含量高,又可以改变食品的组织结构和功能性,增加食品的营养成分及物理性能,所以在许多食品中可替代昂贵的分离蛋白和乳蛋白。
大豆蛋白对食品的质构、风味和加工性状产生重大影响,这主要是因为蛋白具有不同的功能性质。了解大豆蛋白的功能特性,有助于在食品加工业中正确使用大豆蛋白资源,也利于食品营养成分的保持和利用,本文系统地介绍了大豆蛋白的结构对功能性质影响与结构表征的方法,满足人类对大豆蛋白营养价值的需求。
1 蛋白质结构对功能特性的影响
大豆蛋白质的功能特性主要指溶解性、乳化活性、吸油性、粘度和凝胶性,这些功能特性对食品加工十分重要。大豆蛋白具有复杂的初级结构和空间结构,大豆蛋白的结构特征决定大豆蛋白的功能特性。因此,凡是能够改变蛋白结构的因素,必将影响其功能特性[4]。
近年来,国内外有许多学者通过改变蛋白质的结构来提高物质本身的功能性质。布冠好等[5]人对大豆蛋白-乳糖复合物的结构和功能特性进行了研究。通过三硝基苯磺酸(TNBS)法、SDSPAGE电泳、紫外光扫描等方法研究蛋白结构的变化。对不同时间下糖基化产物的功能特性结果表明,大豆蛋白的溶解性在36 h时改善效果最好,与纯大豆分离蛋白相比,溶解性增加了大约30%;糖基化复合物的乳化性提高,乳化活性及乳化稳定性分别在24、36 h达到最大。华欲飞[6]等研究了FSPC的乳化性能,结果表明:FSPC的乳化活性及乳化稳定性与大豆分离蛋白相似,对固体脂肪的乳化能力超过分离蛋白,添加在乳化型碎肉制品中可使产品得率及质构超过添加分离蛋白的肉制品。Jeng-YuneLi[7]等对大豆浓缩蛋白和玉米淀粉的合成物进行了热分析、流变分析和凝胶特性的分析。在二者形成的合成物中,大豆浓缩蛋白减少了玉米淀粉的水分活度并增加了其吸热温度。张梅[8]等研究了功能性大豆浓缩蛋白性能及其应用,证实功能性大豆浓缩蛋白的NSI值明显提高,大豆蛋白功能特性有不同程度提高和改。研究还表明:经物理方法改性的FSPC,有较好凝胶性、乳化性、持油和持水性。而经酶法改性的FSPC有较好溶解性和乳化性。
2 蛋白质结构表征方法
吸附于表面的蛋白质存在各种不同取向,采用各种先进仪器对与蛋白质相互作用的表面进行表征可大大帮助人们更为深入地了解蛋白质和表面之间的相互作用,以及获得界面蛋白质有序度方面的信息[9]。
2.1 热分析法
热分析技术是研究物质的物理化学性质时依据温度变化而进行测量的一种动态分析技术。热分析技术的种类很多,有热重法(TG),差热分析法(DTA),差示扫描量热法(DSC)等[10]。广泛应用于大豆蛋白研究的方法是差示扫描量热法(DSC)。
近年来,DSC在大豆蛋白功能性质研究中主要要涉及大豆蛋白11S和7S成分热属性及pH、离子强度、钙离子、乙醇、2-巯基乙醇对大豆蛋白理化及功能性质的影响,也涉及有关大豆蛋白水结合性能及其分散相流变性质研究,Peturecclli等[11]人通过DSC法研究大豆分离蛋白热稳定性中pH诱导改性。实验表明未经热处理的大豆分离蛋白,pH增加导致疏水性增加。将pH 10~11和温度约65℃时的热处理相结合导致疏水基团更多暴露,该条件下是最适合获得具有较高乳化能力的大豆分离蛋白。Lakemond等[12]人对研究大豆球蛋白的比率影响热变性的影响因素研究中。通过用DSC和CD(圆二色性)的结合研究表明,在pH 7.6时,大豆球蛋白主要以11S形式存在,在热变性过程中,连接酸性和碱性亚基的二硫键断裂。DSC研究发现酸性亚基进一步裸露可能与较高的吸热转变温度和放热转变的出现有关。大豆球蛋白的变性/聚集(DSC研究)和二级结构的改变(远紫外-CD研究)是同时发生的。
综上,大豆蛋白的DSC法在研究食品蛋白质稳定性和变性动力学方面具有其不可替代的优势,在食品生产过程中调节大豆蛋白的功能属性以利于其合理利用是非常重要的。此外,运用热分析法对于食品蛋白质新资源的开发具有重要的意义,相信这些研究成果将有助于拓宽大豆蛋白在食品生产中的应用。
2.2 力学性能表征
质构和流变性是大豆蛋白力学性能表征的重要方法。质构是蛋白的一种有关脆、酥、硬、滑、粘等机械性感观性质,可从表观上表征大豆蛋白的状态,也可以从中了解蛋白质及其组分的作用力。
Elena等[13]用质构分析仪(TPA)测定了大豆蛋白的质构特性,结果表明,对于11S蛋白,经高温再高压处理的凝胶硬度比先高压再高温处理的凝胶硬度更高,蛋白质分子中的化学键在预处理过程中被破坏,再形成的化学键对凝胶硬度有不同的影响。Puppo等[14]研究了大豆蛋白分散液和大豆蛋白乳化液的流变学行为,考察了热致大豆蛋白凝胶的流变学参数,结果显示大豆蛋白凝胶比其他酱类具有更高的弹性模量和粘稠度,且大豆蛋白这种结构是由分子间的疏水作用所稳定。
2.3 电泳法
十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)是大豆蛋白分析中比较常用的方法,可测定蛋白质亚基分子量,研究不同分子量组分的情况。Yi JB[15]等人在研究由微生物转谷氨酰胺酶(MTGase)共价交联大豆分离蛋白,对交联产物进行体外胃蛋白酶和胰蛋白酶的消化,通过SDSPAGE电泳进行分析(见图1,泳道1)。
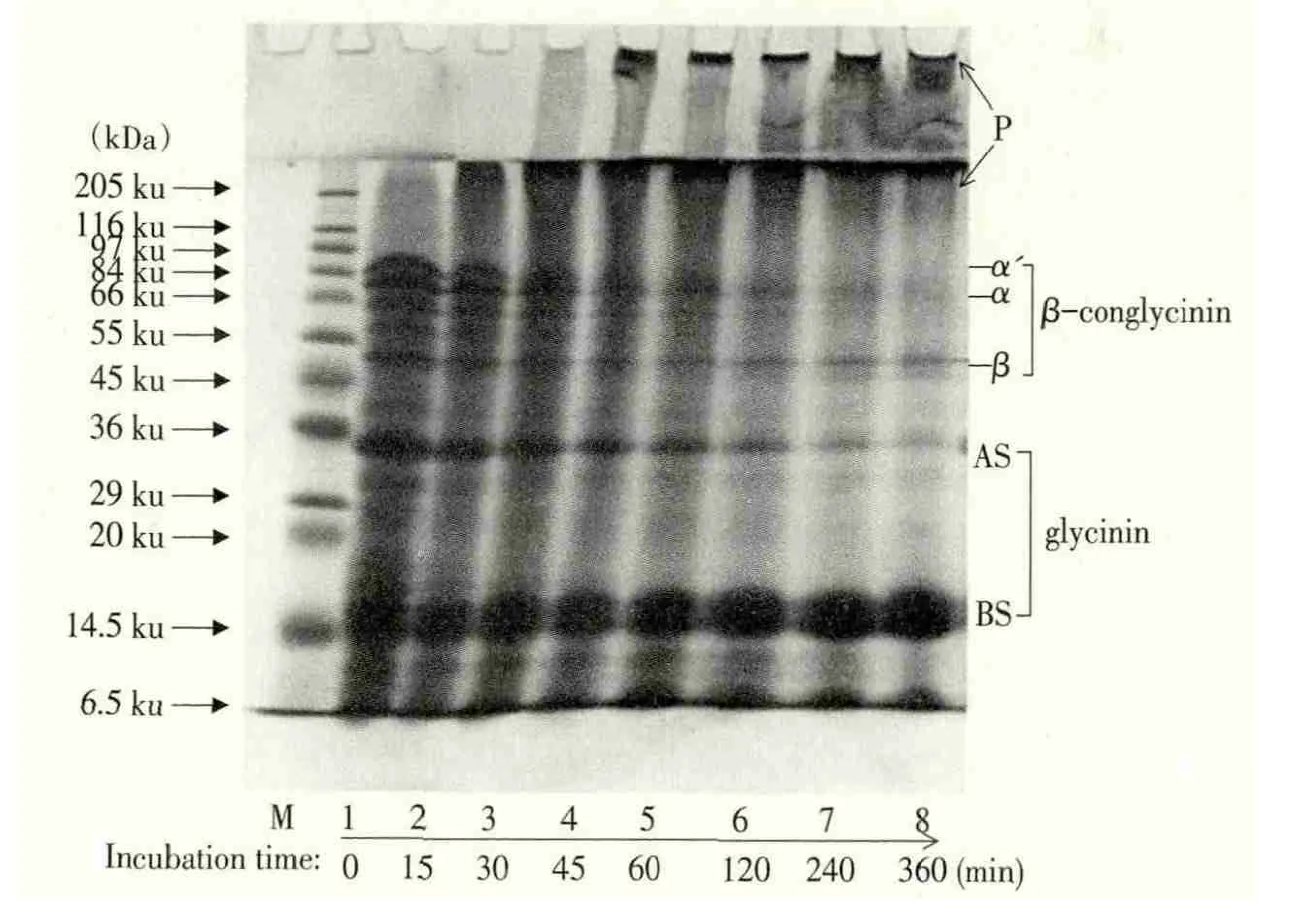
图1 在37℃的不同时间下,大豆分离蛋白(SPI)的SDS-PAGE凝胶电泳图
由图1可以看出,SPI主要被分成大豆球蛋白和β-伴大豆球蛋白两部分。当培养与MTGase催化(20 U/g),在37℃,增加反应时间从0~360min,大部分大豆蛋白质成分的β-球蛋白和酸性亚基(AS)持续下降,并且相应地,新的高分子生物聚合物逐渐增加,而大豆球蛋白的基本亚基(BS)的在整个期间几乎没有影响(见图1,泳道2~8)。
Tang等[16]通过电泳还发现大豆球蛋白组分比β-伴大豆球蛋白组分更容易形成高分子量的生物聚合物,而且球蛋白的酸性亚基比β-伴大豆球蛋白的各组分更容易被MTGase聚合或交联。SDSPAGE的定量研究中多采用光度扫描或凝胶成像系统进行。
2.4 波谱法
通过各种波谱观察大豆蛋白分子结构构象的变化,以深入地了解大豆蛋白结构的变化,如红外光谱、核磁共振和圆二色光谱等[17]。
2.4.1 傅里叶变换红外光谱(ATR-FTIR) ATRFTIR是一种分析蛋白质表面吸附取向与构象的技术。ATR的应用极大地简化了一些特殊样品的测试,使微区成分的分析变得方便而快捷,检测灵敏度可达10-9数量级,测量显微区直径达数微米[18]。
从红外谱图上酰胺键特征吸收峰的变化,可推蛋白分子的改性程度和交联情况。黄友如等[19]人应用FTIR研究了不同亚油酸浓度下脂肪氧合酶催化诱导产生的大豆蛋白聚集体的构象变化。结果表明,在红外光谱图中,具有两个较为明显的特征,一是1 610 cm-1或1 615 cm-1附近谱峰分量的出现,二是酰胺I′各谱峰分量向低波数方向位移。当大豆蛋白与脂肪氧合酶催化的亚油酸反应时,通过氢键形成的分子间β-折叠结构在蛋白质-蛋白质相互作用和聚集体形成中发挥着重要的作用,并揭示了聚集蛋白质的构象变化与大豆蛋白的聚集程度密切相关。
2.4.2 拉曼光谱(SERS) 拉曼光谱是一种能够提供蛋白质二级和三级结构信息的非破坏性的直接分析技术,相对傅里叶红外转换光谱和圆二色谱,拉曼光谱可以提供蛋白质更为广泛的结构信息[20]。最早在1972年,Strekas和Spiro的工作揭开了拉曼光谱研究血红蛋白结构的新篇章。
近年来,有关利用拉曼光谱分析大豆蛋白构型的研究国内外均有报道[18]。李迎秋[21]等人通过运用激光拉曼光谱研究了脉冲电场对大豆分离蛋白结构和功能性质的影响。结果表明:大豆分离蛋白的二级结构主要是β-折叠和无规则卷曲。通过酰胺I带和酰胺III带拉曼特征峰的变化,说明脉冲处理使蛋白的β-折叠和无规则卷曲结构增加,脉冲电场对巯基和二硫键有一定的影响。酪氨酸特征振动频率的变化说明脉冲电场破坏了维持蛋白三级结构的氢键,使埋藏在疏水环境中的酪氨酸残基暴露到分子的表面,更强的脉冲条件使暴露到蛋白表面的酪氨酸疏水基团进一步相互作用,形成疏水性强的基团埋藏在分子内部,从而导致蛋白功能性质的改变。Wong[22]等人分析了酰胺化大豆分离蛋白和脱酰胺化的大豆分离蛋白的Ra⁃man光谱,研究其蛋白质分子微观结构变化规律,发现表示C-O伸缩振动的1 780 cm-1波段强度与1 003 cm-1波段强度的比值随着大豆分离蛋白脱酰胺作用程度的增加而增大。ZHAO[23]利用拉曼光谱分析添加乙酰基的大豆分离蛋白的酯化作用效果和结构变化规律,发现1 737 cm-1附近峰相对吸收强度与O-酯化作用程度成正比关系。
2.4.3 圆二色光谱(CD) 由于光学活性分子对左、右圆偏振光的吸收不同,使得左、右圆偏振光透过后变成椭圆偏振光,这种现象就是圆二色性(circular dichroism,CD)[24]。圆二色光谱既可用于大生物分子聚合物的空间构型、构象的静态研究,也可用于当环境发生变化时,这些聚合物空间构象的动态变化过程。但是,CD技术不能直接提供蛋白质分子和表面结合点的具体信息。Zhao J等[25]人对大豆蛋白水解物的结构特点进行研究中,运用CD技术计算出的α-螺旋、β-折叠、β-转角、无规则卷曲的含量的变化,但结果与ATRFTIR的结果一致。
2.4.4 核磁共振 核磁共振(简称NMR)是基于原子核磁性的一种波谱技术,是一种鉴定有机化合物结构和研究化学动力学等的现代仪器分析方法[26]。NMR技术是能够在原子分辨率下测定溶液中生物大分子三维结构的唯一方法[27]。
利用核磁共振法能够测定溶液中大豆蛋白改性中构象的变化,还可研究蛋白分子的构象动力学。Kakalis等[28]人运用13C-NMR光谱研究提供有关7S大豆蛋白分子结构和大豆蛋白加工如蛋白胶凝、蛋白改性和组织化新的而详细的信息。田少君[29]等人对大豆分离蛋白的磷酸化改性进行研究,通过核磁共振分析发现磷酸化反应主要发生在大豆蛋白的赖氨酸和丝氨酸等含-NH2或-OH的残基上。
2.4.5 X射线光电子能谱 X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)技术也被称作用于化学分析的电子能谱(electron spectroscopy for chemicalanalysis,ESCA)。XPS不仅能够给出材料表面的化学组成及含量,而且可以分析出化学价态、化学键等信息[30]。角分辨XPS可以在极薄的表层内对化学信息进行表征[31],利用成像XPS技术,可以提供分析区域内的元素及其化学状态分布的信息图像,并可由图得谱。自德国物理学家伦琴1895年发现X射线以来,与其有关的分析技术不断问世,X射线光电子能谱分析法就是其中的一种。
2.5 微观结构分析法
运用电子扫描显微镜、原子力显微镜等可直接观察蛋白质的微观表面形貌。
2.5.1 原子力显微镜(AFM) AFM(atomic force microscopy,AFM)能提供可靠的生物介质表面单分子水平尺度形貌信息,并以其高分辨率,操作简单,制样容易等特点而备受关注,若对小范围的样品表面的图像进行分析,还可以获得物质的晶形结构、分子的结构、聚集状态、表面积及体积等方面的信息。
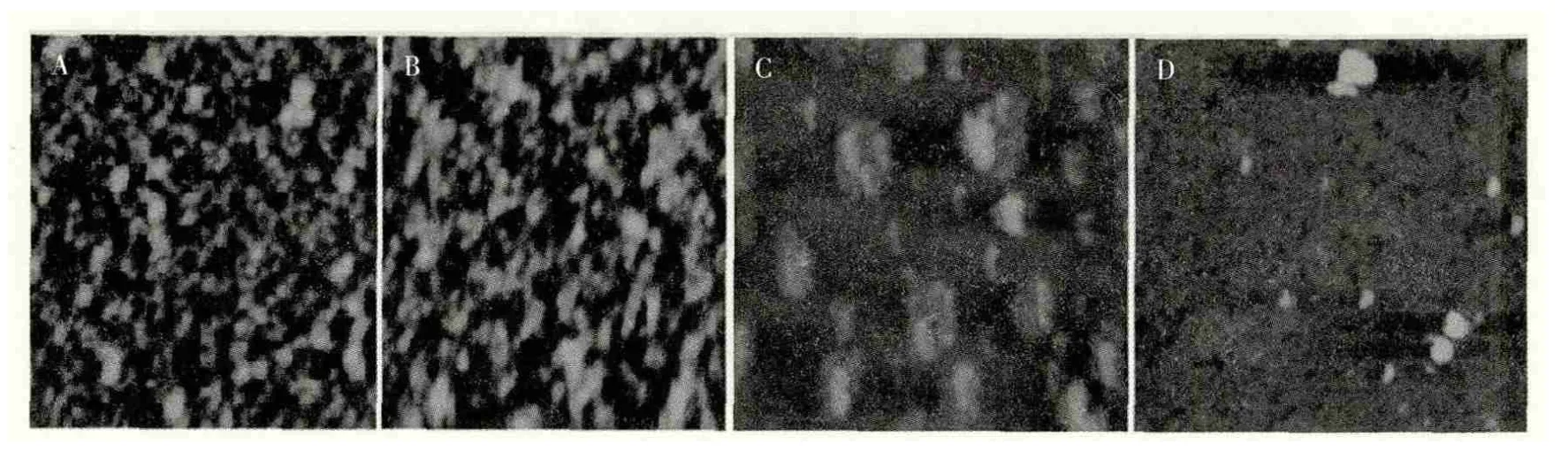
图2 β-球蛋白及其亚基热诱导聚集的AFM图像
AFM允许动态地研究蛋白质在生命活动不同时刻的状态,在蛋白质组装动力学研究中具有优势。AFM与蛋白质单分子水平上研究蛋白质识别也得到一定的发展。AFM将蛋白质研究带到了一个新的微观层面,它已在蛋白质成像、吸附、组装、蛋白质之间相互作用、蛋白质与其他生物分子之间相互作用以及其他一些与蛋白质有关的研究中得到了广泛关注[32]。王昌盛[33]运用AFM所观察到的不同离子强度下的7S球蛋白80℃加热不同时间后的原子力图。结果表明,随着7S球蛋白浓度的增大,使得“组装单元”充足,使得7S球蛋白更容易发生自组装纤维化反应。
Yuan等[34]人运用AFM研究大豆β球蛋白亚基的改进提取方法见图2所示。
如图2所示,不同样品形成的聚集体显示出不同的形态模式。在样品制备过程中,不溶性沉淀物通过离心去除,同时对聚集体进行观察,得到几种不同的形态模式。图a中β-伴大豆球蛋白的情况下更有序,并形成滞留聚集亚基。图b中情况是相似的,β-伴大豆球蛋白较前者的聚集体情况更无序,成蠕虫状。图c形成的聚集体的形态呈芽状,虽然由于质量不均匀使其制备过程中样品分散,但还可以看得到。而在图d的情况下,亚基没有观察到有序的聚集。
2.5.2 扫描电子显微镜 扫描电子显微镜(Scanning electron microscope,SEM)可以观察蛋白质微小颗粒的表面形貌,还可以与能谱仪配合进行颗粒粒径及数量的测量与统计,测试准确度高,因而在大豆蛋白的分析领域具有不可替代的作用[35-36]。
段春红等[37]人对大豆7S球蛋白碱性蛋白酶酶解产物的进行结构表征,通过对粉体的SEM进行观察和分析。图3为7S球蛋白及不同水解度的7S球蛋白碱性蛋白酶酶解产物的扫描电镜图。
从图3可以看出,同未水解7S球蛋白相比较,酶解后样品在相同的观察条件下,其粉体结构发生了明显改变。未水解的7S球蛋白表面部分有轻微坑洼现象,随着水解程度的增加,7S球蛋白酶解产物的表面结构更为疏松。实验结果说明酶解改变了7S球蛋白的表面结构。
2.5.3 扫描隧道显微镜 扫描隧道显微镜(Scanning Tunneling Microscopy,STM)与其他种类的显微镜相比,它的分辨本领却可以达到10-10m。以量子力学为基础的扫描隧道显微镜,可以在大气、液体、真空状态下工作,可以在4.2~1 000 K之间的温度下工作;并且对样品也无特殊要求,可以测量单晶、多晶、非晶等样品表面;特别是扫描隧道显微镜可以与其他实验设备结合,应用更加有效、灵活。因此,扫描隧道显微镜在物理学、化学、生物学、纳米材料等领域中都得到了深入而广泛的应用,并取得了一系列重要的研究成果[38]。
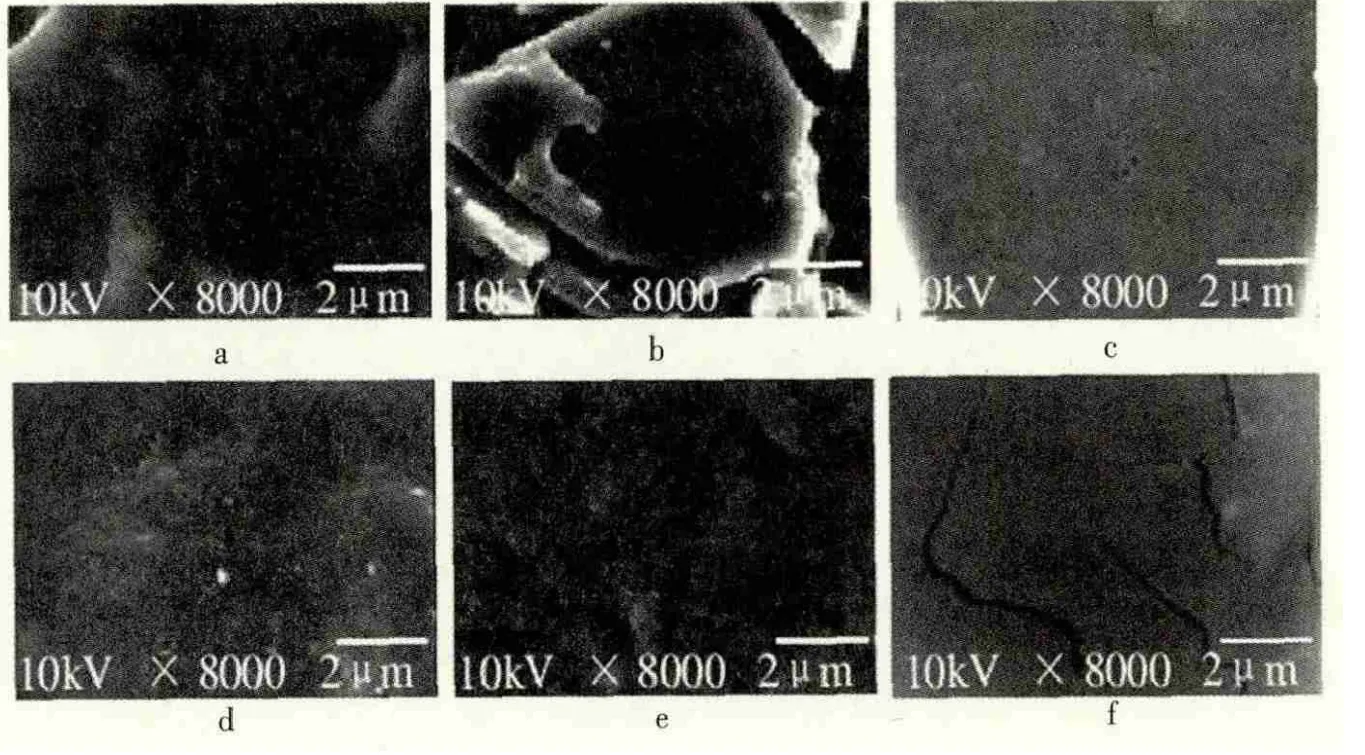
图3 不同水解度7S球蛋白扫描电镜图谱
3 小结和展望
大豆蛋白制品的功能特性及用途直接与产品加工工艺有关,不同工艺加工的产品有不同的功能特性。所以要致力于开发多品种、多功能、系列化的大豆蛋白产品,以充分体现功能性大豆蛋白的高营养、高附加值。要加大基础研究的力度,研究大豆蛋白提高各种功能特性的机理。剖析各种理化及生物因素对蛋白结构和功能变化的影响,只有真正掌握这些变化规律,才能开发出更多更好的大豆蛋白产品,以应用于更广阔的市场领域。
近年来,对食品蛋白质的功能性质的研究很多[39],但是对于蛋白质结构和功能性质联系的了解比较少,人们对蛋白质表征方面的研究已经取得了一定进展。由于计算机性能的快速发展,使蛋白质的结构研究进展迅速。理论计算不仅提供了蛋白质空间结构、电子结构的信息如:能级、表面电荷分布、分子轨道相互作用等,而且还提供了蛋白质与周围环境(如水、离子和某些小分子)的相互作用。但是也还存在很多问题,还需要科学工作者更细致深入的分析和研究。
[1]Tian Shaojun,Chen Jie,Small DM.Enhancementof solu⁃bility and emulsifying properties of soy protein isolates by glucose conjugation[J].Journal of Food Processing and Preservation,2011,35(01):80-95.
[2]张佩.大豆蛋白改性的研究进展及其在食品中的应用[J].山东食品发酵,2008(8):76.
[3]Zhong F,Wang Z,Xu S,etal.Functional propertiesof Pro⁃toypie Enzyme Modified Soy Protein Isolate[J].Food Chemistry,2007,100(3):1371-1375.
[4]Hirotsuka M,Taniguchi H,Narita H,et al.Functionality and digestibility of a highly phosphorylated soybean pro⁃tein[J].Agricultural and Biological Chemistry,1984,48(1):93-100.
[5]布冠好,朱婷伟,陈复生,等.大豆蛋白-乳糖复合物的结构及功能特性研究[J].中国粮油学报,2014,29(07):40-44.
[6]华欲飞,顾玉兴.功能性大豆浓缩蛋白的性能及应用研究[J].中国油脂,1997,22(01):22-24.
[7]Li JY,Yeh A I,Fan K L.Gelation characteristics and morphology of corn starch/soy protein concentrate compos⁃ites during heating[J].Journal of Food Engineering,2007,78(4):1240-1247.
[8]张梅,周瑞宝,马智刚.功能性大豆浓缩蛋白性能测定及其应用研究[J].粮食与油脂,2004(4):21-23.
[9]章爱娟,谢韵,周健.蛋白质界面取向的实验控制与表征[J].化学进展,2009,21(7/8):1408-1417.
[10]Zhu Q Y,Zhang A,David T,et al.Stability of green tea catechins[J].J Agric Food Chem,1997,45(12):4624-4628.
[11]Petruccelli S,et al.PH-Induced modifieations in the thermal stability of soybean Protein isolates[J].Agrie Food Chem,1996,44:3005-3009.
[12]Lakemond C.M.M,et al.Heat denaturation of soy gly⁃einin:influence of PH and ionic strength on molecular strueture[J].Agric Food Chem,2000,48(6):1991-1995.
[13]Elena M,Leward D A.Effects of combined high-pressure and heat treatment on the textural properties of soy gels[J].Food Chem,2003,80(03):367.
[14]Puppo M C,Sorgentini D A,Anon M C.Rheological properties of emulsions containing modified soy protein isolates[J].JAm Oil Chem Soc,2003,80(06):605.
[15]Yi J B,Kim Y T,Bae H J,et al.Influence of trans⁃glutaminase-induced cross-linking on properties of fish gelatin films[J].Journal of Food Science,2006,71(9):E376-E383.
[16]Tang Chuanhe,Wu Hui,Chen Zhong,et al.Formation and properties of glycinin-rich andβ-conglycinin-rich soy protein isolategels induced by microbial transgluta⁃minase[J].Food ResInt,2006,39(01):87-97.
[17]杨谷毅,王飞镝,严霞波,等.蛋白质凝胶的结构表征和应用研究进展[J].材料导报,2008,22(4):104-107.
[18]黄红英,尹齐和.傅里叶变换衰减全反射红外光谱法(ATR-FTIR)的原理与应用进展[J].中山大学研究生学刊(自然科学:医学版),2011,32(01):20-31.
[19]黄友如,华欲飞,张根华,等.重水环境下的氧化大豆蛋白傅里叶变换红外(FT-IR)分析[J].中国粮油学报,2010,25(05):19-23+29.
[20]Yuen SN,Choi SM,Phillips D L,etal.Raman and FT⁃IR spectroscopic study of carboxymethylated non-starch polysaccharides[J].Food Chemistry,2009,114(3):1091-1098.
[21]李迎秋,田文利.脉冲电场处理后大豆分离蛋白的拉曼光谱分析[C]//Proceedings of 2010 First International Conference on Cellular,Molecular Biology,Biophysics and Bioengineering(Volume 6).2010.
[22]Wong HW,ChoiSM,Phillips D L,etal.Raman spectro⁃scopic study of deamidated food proteins[J].Food Chemis⁃try,2009,113(2):363-370.
[23]ZHAO Y,Ma CY,Yuen SN,etal.Study of succinylated food proteins by Raman spectroscopy[J].Journal of Agri⁃culturaland Food Chemistry,2004,52(7):1815-1823.
[24]丁晓岚,高红旗.圆二色光谱技术应用和实验方法[J].实验技术与管理,2008.25(10):48-52.
[25]Zhao J,Xiong Y L,McNear D H.Changes in structural characteristics of antioxidative soy protein hydrolysates resulting from scavenging of hydroxyl radicals[J].Journal of food science,2013,78(2):152-159.
[26]周凝,刘宝林,王欣.核磁共振技术在食品分析检测中的应用[J].食品工业科技,2011,32(01):325-329.
[27]施蕴渝,吴季辉.核磁共振波谱研究蛋白质三维结构及功能[J].中国科学技术大学学报,2008,38(8):941-949.
[28]KakalisLT,Baianu1C.High-resolution carbon-13 nue⁃learmagnetie resonance study of the soybean 7S storage Protein fraetion ins olution[J].JAgric Food Chem,1990,38(12):2126-2132.
[29]田少君,李小阳,曾艳菊,等.大豆分离蛋白的磷酸化改性[J].中国粮油学报,2003,18(2):46-49.
[30]Renault O,Garnier A,Morin N,et al.High-resolution XPSSpectromicroscopy Study ofMicro-patterned Goldtin Surfaces[J].Applied Surface Science,2012,258(24):10077-10083.
[31]Kazansky LP,Selyaninov IA,Kuznetsov Y I.Angle Re⁃solved XPS of Monomolecular Layer of 5-chlorobenzo⁃trizole on Oxidized Metallic Surface[J].Applied Surface Science,2012,259(15):385-392.
[32]吕正检,陈国平,王建华.原子力显微镜与蛋白质研究[J].生物医学工程学杂志,2010,27(03):692-695.
[33]王昌盛.大豆球蛋白自组装纤维的形成及静电屏蔽调控研究[D].华南理工大学,2011.
[34]Yuan D B,Min W,Yang X Q,et al.An improved isola⁃tionmethod of soy β-conglycinin subunitsand their char⁃acterization[J].Journal of the American Oil Chemists'So⁃ciety,2010,87(9):997-1004.
[35]于翠柳,陈野,李秀明,郭立华,张宁.大豆蛋白凝胶显微结构研究[J].食品研究与开发,2012,33(09):56-60.
[36]Su J F,Yuan X Y,Huang Z,et al.Properties stability and biodegradation behaviors of soy protein isolate/poly(vinyl alcohol)blend films[J].Polymer Degradation and Stability,2010,95(7):1226-1237.
[37]段春红,姚晓琳,朱新荣,等.大豆7S球蛋白碱性蛋白酶酶解产物的结构表征[J].食品科学,2009,30(17):181-184.
[38]齐磊,曹剑英.扫描隧道显微镜简介[J].2013,29(2):67-68.
[39]赵琼,王祥河,赵健,等.功能性大豆浓缩蛋白生产现状及前景展望[J].食品研究与开发,2009,30(4):174-177.

