过表达IbOr基因甘薯增强抗旱性的生理机制
陈晓丽,李红兵,王林林,李孟洁,李雨霖,郭尚洙,邓西平*
(1 西北农林科技大学 生命科学学院,陕西杨陵712100;2 中国科学院水利部水土保持研究所 黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西杨陵712100;3 韩国生命工学研究院,韩国大田)
正常条件下,植物细胞中产生的活性氧与其清除系统保持平衡,而当环境胁迫长期作用于植株,产生的活性氧超出了活性氧清除系统的能力时,就会引起活性氧累积产生氧化伤害,从而使细胞功能失常,机体出现各种自由基综合症。植物体在长期进化过程中也相应地形成了酶促和非酶促两大类保护系统,酶促保护系统包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和谷胱甘肽硫转移酶等,非酶促系统主要包括一些抗氧化剂如抗坏血酸(Vc)、类胡萝卜素(Car)、花青素(Anthocyanins)和谷胱甘肽(GSH)等,它们的协调作用赋予植物体以清除活性氧的能力,减轻或避免活性氧对细胞造成伤害,从而表现出对氧化胁迫的抗性。
甘薯富含次生代谢产物,尤其是抗氧化化合物包括花青素、类胡萝卜素和维生素C[1]。橙色薯肉甘薯品种富含类胡萝卜素。类胡萝卜素在高等植物中参与光合作用,一方面阻止激发态叶绿素分子的激发能从反应中心向外传递;另一方面,它也保护叶绿素分子免遭光氧化损伤。另外,类胡萝卜素作为ABA 合成的前体,也是人类饮食中维生素A 的主要来源[2]。橙色基因(orange,Or)的发现提供了改良作物类胡萝卜素含量的新手段,Or基因是在菜头呈橘黄色的花椰菜中发现的天然半显性突变,能使原本不积累类胡萝卜素的组织如菜头、茎髓、叶子基部等大量积累类胡萝卜素[3-4]。Or基因编码一个定位于质体富含半胱氨酸的Dna J类似蛋白。正如花椰菜的Or蛋白质—热休克蛋白(HSP),作为分子伴侣可调控质粒。例如,番茄HSP21可保护光合体系Ⅱ免受氧化胁迫,促进叶绿体转换成有色体,进而导致类胡萝卜素积累[5]。从橙肉甘薯分离的橙色基因(IbOr)通过提高类胡萝卜素生物合成基因的表达水平来增加类胡萝卜素的积累[6]。转Or基因的土豆块茎和拟南芥花序都表现出类胡萝卜素含量升高的现象,说明Or基因在改良作物的类胡萝卜素含量方面具有广泛的应用前景[7]。
甘薯是中国主要的农作物之一,已有许多文献指出水分胁迫下甘薯的旱害与氧化胁迫有关[8-10]。干旱胁迫能诱导过量活性氧的产生[11],导致植物体内活性氧积累,从而对植物的细胞结构和生理代谢产生严重的危害,进而使植物遭受生理损害。本实验通过室内水培实验检验PEG-6000模拟的干旱胁迫下,过表达IbOr基因甘薯是否通过提高自己的抗氧化能力来增强其对干旱胁迫的抗性。
1 材料和方法
1.1 实验材料
供试材料紫肉甘薯SZM 及过表达IbOr基因的2个转基因株系(Or207,Or210)由韩国生命工学研究院提供,其中转基因株系由包含花椰菜花叶病毒35S启动子的pGWB11植物表达载体构建得到pGWB11-IbOr,进而转化SZM 获得。从盆栽植株中剪取五叶一心苗移入1/2Hoagland溶液中,散射光照强度为200μmol·m-2·s-1,室温为20~30℃,室内水培15~20d。
1.2 水分胁迫处理
参照张明生等[9]的实验结果,将水培15~20d的培养苗转入含15%聚乙二醇(PEG-6000)的1/2 Hoagland培养液中进行轻度水分胁迫处理,溶液水势(ψWw)约为-0.44 MPa,分别于胁迫3、6、24、48和72h 后取样测定各项指标。对照材料用不含PEG-6000的1/2Hoagland溶液培养。
1.3 测定指标及方法
1.3.1 叶绿素含量 叶绿素含量的测定采用丙酮提取方法。称取甘薯叶片鲜样约0.2g,置于研钵中用液氮迅速研磨成粉状,用5 mL 80%丙酮分3次(2、2和1mL)冲洗研钵使粉末充分浸泡于丙酮中,避光4℃放置2h,每0.5h振荡1次。2h后将丙酮提取液于4 000×g离心20min,取上清液,稀释4倍后分别测定470、663、646nm 3 个波长下的吸光值OD470、OD663和OD646,据此计算叶绿素a(Ca)、叶绿素b(Cb)、叶绿素(CT)和类胡萝卜素(Cx.c)的含量,公式如下:

1.3.2 光合指标 净光合速率、蒸腾速率、气孔导度和胞间CO2浓度的测定使用美国Li-COR 公司生产的Li-6400气体交换光合测定系统,采用开放式气路,测定条件为(28±2)℃,空气CO2浓度(500±10)μmol·m-2·s-1,光照强度(500±1)μmol·m-2·s-1。
1.3.4 丙二醛含量 丙二醛(MDA)含量测定按照赵世杰等[14]的方法。
1.3.5 抗氧化酶活性 SOD 和POD 活性的测定参照高俊风[15]编写的实验指导书。
以上各生化指标均用倒3、倒4 叶混合样进行测定,每个处理重复3次,光合作用参数每个处理测定3个不同的叶片。实验结果取3 次测定的平均值,表示为平均值±标准差。
1.4 数据统计分析
差异显著性分析采用SPSS 16.0软件完成。
2 结果与分析
2.1 水分胁迫对甘薯幼苗光合色素含量的影响
在受到干旱胁迫时,植物叶绿体受损,叶绿素含量降低,从而影响到光合作用效率。如图1所示,转基因甘薯(Or207和Or210)和非转基因甘薯(SZM)幼苗叶片叶绿素a含量在15%PEG-6000处理下均开始下降,并在胁迫24h后二者无显著差异;随胁迫时间增加,非转基因甘薯和转基因甘薯株系Or210叶绿素a含量持续降低,而另一株系Or207反而略有增加,但仍始终低于胁迫前(CK)水平;在干旱胁迫48和72h后,转基因甘薯叶绿素a含量显著高于非转基因甘薯,Or207 株系又显著高于Or210株系(图1,A)。同时,在水分胁迫条件下,转基因和非转基因甘薯幼苗叶片叶绿素b含量随胁迫时间的变化趋势与叶绿素a的表现大致相同(图1,B)。另外,在正常供水条件下,2个转基因甘薯株系类胡萝卜素含量显著高于非转基因甘薯。水分胁迫24h后,转基因株系类胡萝卜素含量下降,非转基因甘薯类胡萝卜素含量略有上升,二者含量几乎相等;随胁迫时间增加,转基因和非转基因甘薯类胡萝卜素含量都有所下降,然而转基因株系的类胡萝卜素含量仍显著高于非转基因甘薯,Or207株系又显著高于Or210株系(图1,C)。以上结果说明在水分胁迫条件下,转基因甘薯幼苗光合色素含量显著高于非转基因甘薯,从而提高其光合作用效率。
2.2 水分胁迫对甘薯幼苗叶片净光合速率及有关参数的影响
图2显示,各类甘薯幼苗叶片净光合速率(Pn)在水分胁迫24h后均明显下降,但进一步延长胁迫时间,转基因甘薯Pn小幅降低,非转基因甘薯Pn反而稍有增加,但仍低于转基因甘薯Pn(图2,A);各类甘薯幼苗叶片气孔导度(Gs)在水分胁迫后同样大幅下降,然后趋于稳定,在胁迫24和48h后,转基因甘薯Gs仍高于非转基因甘薯(图2,B);同时,转基因甘薯叶片蒸腾速率(Tr)在无水分胁迫时显著高于非转基因甘薯,在水分胁迫条件下,各类甘薯Tr均明显大幅度降低,但转基因株系蒸腾速率仍显著高于非转基因植株(图2,D)。另外,与以上指标变化类似,各类甘薯株系幼苗胞间CO2浓度(Ci)在受到水分胁迫后也均明显降低,但转基因株系Ci显著低于非转基因甘薯(图2,C)。以上结果说明在水分胁迫条件下,各类甘薯幼苗的光合作用均受到抑制,但转基因甘薯的抑制程度低于非转基因甘薯。
2.3 水分胁迫对甘薯叶片和MDA 含量的影响
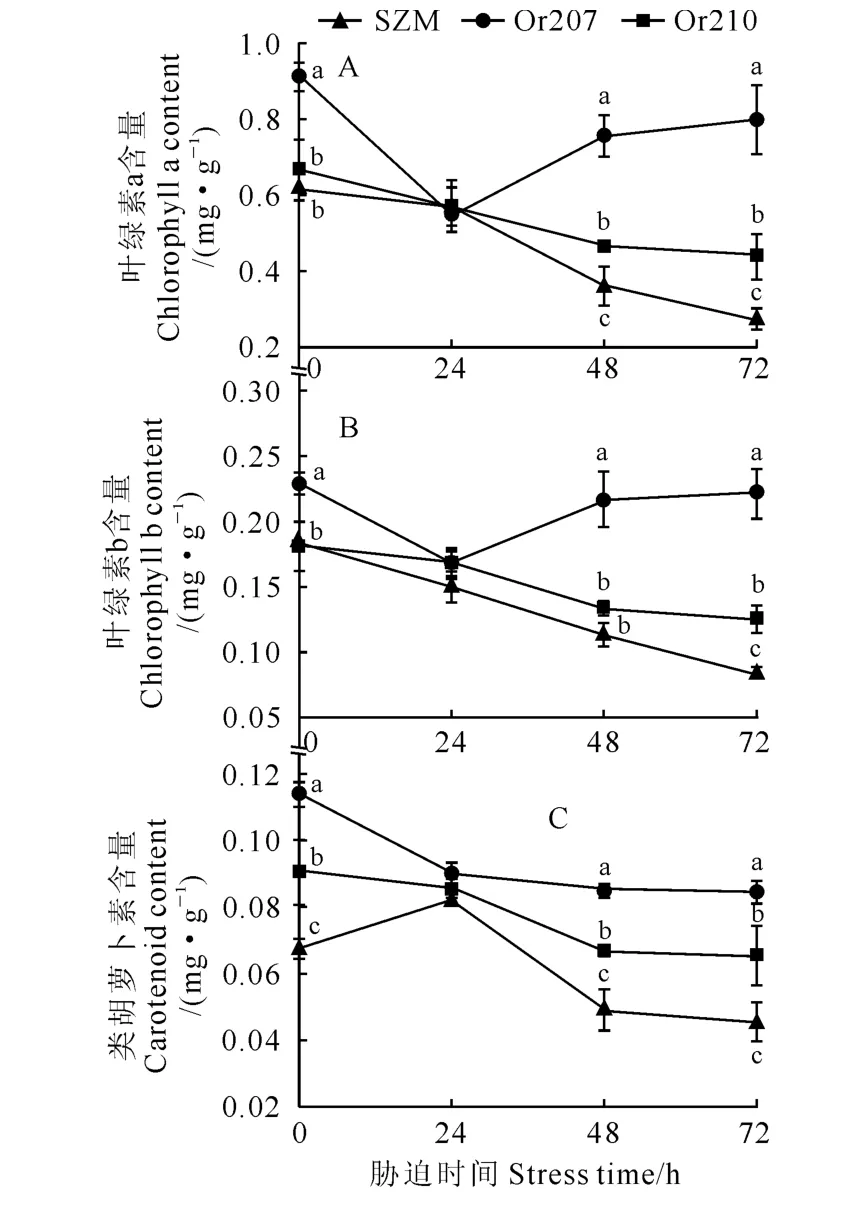
图1 水分胁迫下甘薯幼苗叶片光合色素含量的变化Fig.1 The photosynthetic pigment contents in leaves of sweet potato seedling under water deficit
O2接受一个电子后形成,是活性氧自由基的一种,是所有氧自由基的前身,其大量积累会对细胞产生氧化伤害,使生物体生物膜的结构及功能受到损伤,引起核酸和蛋白质变性等,从而对细胞及组织产生多种生物学效应。由图3,A 可见,转基因和非转基因甘薯幼苗叶片含量均随水分胁迫时间的增加而不断提高,但胁迫后不同时间转基因甘薯含量均低于非转基因甘薯,尤其是胁迫24 h后,转基因甘薯含量显著低于非转基因甘薯,表明转基因株系积累了较少的活性氧自由基前身。
同时,丙二醛(MDA)是脂质过氧化的最终产物,其含量反映植物细胞受环境胁迫等伤害的程度。由图3,B 可知,各类甘薯幼苗叶片中MDA 含量在水分胁迫后均随胁迫时间的延长而不断增加,表明植株受伤害的程度不断加深;然而,相比于非转基因植株,转基因植株在正常供水和水分胁迫后均保持了较低的MDA含量,如胁迫4 8h后,非转基因甘薯株系MDA 含量约为转基因甘薯株系的1.5倍。这说明转基因甘薯对水分胁迫的适应性较强,受活性氧攻击的损伤较轻。
2.4 水分胁迫对甘薯幼苗叶片SOD 和POD 活性的影响

图2 水分胁迫下甘薯幼苗叶片光合参数的变化Fig.2 The photosynthetic parameters in leaves of sweet potato seedling under water deficit condition

图3 水分胁迫下甘薯幼苗叶片和MDA 含量的变化Fig.3 The superoxide anion and malondialdehyde content in leaves of sweet potato seedling under water deficit condition
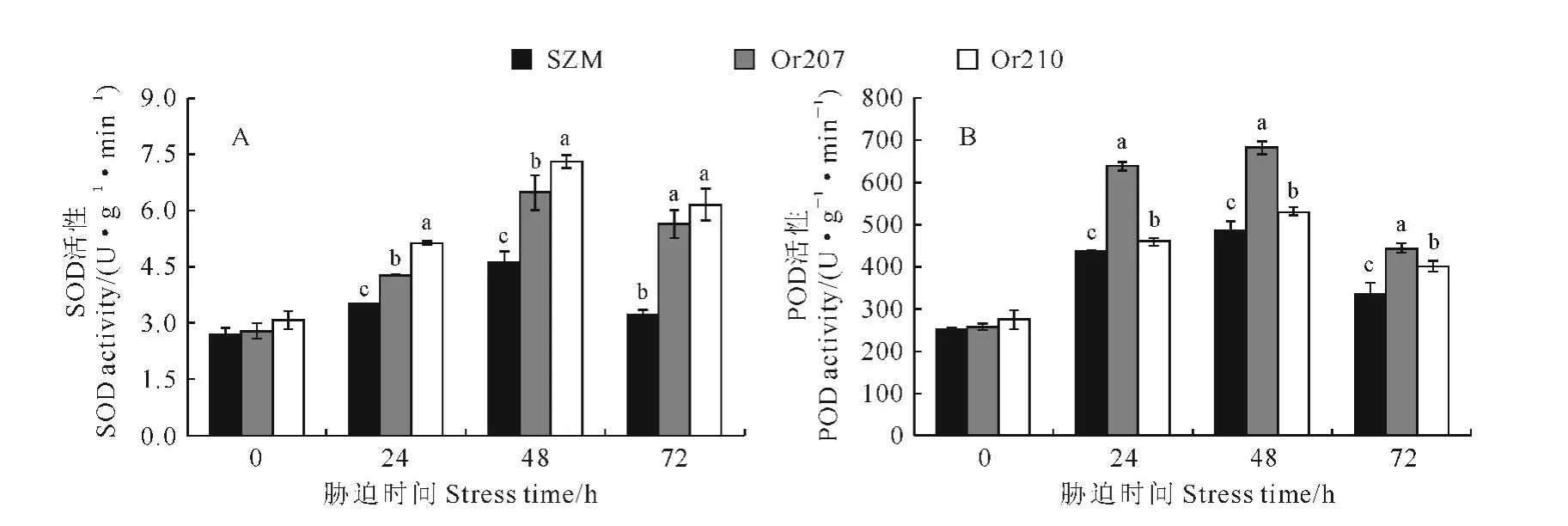
图4 水分胁迫下甘薯幼苗叶片SOD 和POD 活性的变化Fig.4 The SOD and POD activities in leaves of sweet potato seedling under water deficit condition
抗氧化酶系统极易受到环境胁迫的影响,同时也是反映植物对环境胁迫耐受程度的重要指标。其中,超氧化物歧化酶(SOD)是抵御活性氧伤害的第一道防线,它可以将歧化为H2O2。而过氧化物酶(POD)可在逆境或衰老初期表达,清除H2O2。POD 广泛存在于植物体内不同组织中,它作为活性较高的适应性酶,能够反映植物生长发育的特点、体内代谢状况以及对外界环境的适应性。图4,A 表明,在正常水分条件下,转基因甘薯幼苗叶片SOD活性稍高于非转基因甘薯,但差异不明显;PEG 模拟干旱胁迫24h后,转基因和非转基因甘薯幼苗叶片SOD 活性均升高,胁迫48h 后,甘薯幼苗叶片SOD 活性达到最高,但转基因甘薯株系SOD 活性显著高于非转基因甘薯;随着胁迫时间的延长,SOD活性均有所降低,但转基因甘薯株系幼苗SOD 活性降低幅度较小,仍显著高于非转基因甘薯。同时,在正常水分条件下,转基因甘薯与非转基因甘薯幼苗叶片POD 活性无显著差别,但在水分胁迫24h后,转基因甘薯幼苗POD 活性显著高于非转基因甘薯,特别是转基因甘薯株系Or207在胁迫后POD 活性约为胁迫前的2.5倍;与SOD 活性变化趋势相似,胁迫48h后,甘薯幼苗POD 活性达到最大;胁迫72 h后,POD 活性均有所降低,但仍高于胁迫前水平(图4,B)。这说明水分胁迫可以诱导甘薯幼苗叶片SOD 和POD 活性提高,相比于非转基因植株,转基因株系幼苗酶活性的增强更明显,从而使得转基因甘薯幼苗具有更强的抗氧化能力。
3 讨 论
作物叶绿素含量的高低是反映其光合能力的重要指标之一,叶绿素的含量往往直接影响着光合作用的速率和光合产物的形成,最终影响作物产量和品质的提高[16-17]。通常情况下,水分胁迫会对植物的叶绿体造成一定的损伤,降低叶片中叶绿素的含量,从而降低植物的光合速率,导致光合功能迅速衰退。本实验结果显示:转基因甘薯叶片中叶绿素和类胡萝卜素含量在水分胁迫后明显下降,但转基因株系的含量显著高于非转基因甘薯,表明水分胁迫对转基因株系光合能力的损伤要小于非转基因甘薯。可见,过表达IbOr基因增强了甘薯对水分胁迫的耐受能力,其可能通过保持较高的叶绿素和类胡萝卜素水平,延缓叶片光合功能来实现。同时,在水分胁迫条件下,甘薯叶片Pn、Gs、Ci和Tr也都明显下降,但转基因株系的Pn、Gs和Tr都高于非转基因甘薯,表明在水分胁迫条件下转基因甘薯由于具有较高的叶绿素和类胡萝卜素含量及气孔导度,因而保持了高于非转基因甘薯的光合和蒸腾能力,反映了在干旱条件下由于转基因甘薯具有生理代谢上的优势,因此对干旱表现出了较强的耐性。在水分胁迫后,非转基因甘薯保持了较高的胞间CO2浓度(Ci),这可能由于非转基因甘薯叶绿素和类胡萝卜素含量显著降低,光合能力严重受损,胞间CO2无法及时消耗,因而累积造成。
在水分胁迫条件下,植物细胞内活性氧大量积累,诱发膜脂过氧化反应,产生MDA,细胞膜的结构和功能遭到破坏,对细胞造成不可逆的伤害,甚至引起细胞死亡[21]。本实验发现,非转基因甘薯叶片中MDA 含量在胁迫后各时间点都显著高于转基因植株,说明其受到的伤害大,而转基因植株受到的氧化伤害相对较小。这是由于转基因植株具有较低水平的含量,加之转基因株系由于具有较高的SOD 和POD 活性,保持了较低水平的活性氧,从而受到的氧化伤害要小一些。另外,类胡萝卜素派生物ABA 可以作为植物非生物胁迫信号,通过类胡萝卜素抗氧化活性和ABA 增加的协调作用,参与多种胁迫反应,提高转基因甘薯的抗氧化能力[20]。因此,转基因甘薯增强了对水分胁迫的耐受能力主要是通过抗氧化能力的提高来实现的。
[1]YOSHINAGA M,YAMAKAWA O,NAKATANI M.Genotypic diversity of anthocyanins content and composition in purple-fleshed sweet potato[J].BreedingSci.,1999,49(1):43-47.
[2]TANAKA Y,SASAKI N,OHMIYA A.Biosynthesis of plant pigments:anthocyanins,betalains and carotenoids[J].ThePlantJournal,2008,54(4):733-749.
[3]CRISP P,WALKEY D G A,BELLMAN E,etal.A mutation affecting curd colour in cauliflower(BrassicaoleraceaL.var.BotrytisD C)[J].Euphytica,1975,24(1):173-176.
[4]LU S,VAN ECK J,ZHOU X,etal.The cauliflowerOrgene encodes a DnaJ cysteine-rich domain-containing protein that mediates highlevels of beta-carotene accumulation[J].PlantCell,2006,18(12):3 594-3 605.
[5]NETA-SHARIR I,ISAACSON T,LURIE S,etal.Dual role for tomato heat shock protein 21:protecting photosystem Ⅱfrom oxidative stress and promoting color changes during fruit maturation[J].PlantCell,2005,17(6):1 829-1 838.
[6]KIM S H,AHN Y O,AHN M J,etal.Cloning and characterization of an Orange gene that increases carotenoid accumulation and salt stress tolerance in transgenic sweet potato cultures[J].PlantPhysiologyandBiochemistry,2013,70(9):445-454.
[7]LOPEZ A B,VAN ECK J,CONLIN BJ,etal.Effect of the cauliflower Or transgene on carotenoid accumulation and chromoplast formation in transgenic potato tubers[J].JournalofExperimentalBotany,2008,59(2):213-223.
[8]HE B(何 冰),XU H Y(许鸿源),etal.Effects of drought stress on the permeability of plasma membrane and anti-oxidation enzymes of the leaves of sweet potato[J].JournalofGuangxiAgriculturalUniversity(广西农业大学学报),1997,16(4):287-290(in Chinese).
[9]ZHANG M SH(张明生),TAN F(谈 峰),ZHANG Q T(张启堂).Physiological indices of rapid identification for sweet potato drought resistance and selection of PEG concentration[J].JournalofSouthwestChinaNormalUniversity(Nat.Sci.Edi.)(西南师范大学学报·自然科学版),1999,24(1):74-80(in Chinese).
[10]LI W Q(李文卿),PAN Y G(潘延国),KE Y Q(柯玉琴),etal.Effects of soil water stress on metabolism of active oxygen in leaves of sweet potato seeding[J].FujianJournalofAgriculturalSciences(福建农业学报),2000,15(4):45-50(in Chinese).
[11]JIANG M,ZHANG J.Water stress-induced abscisic acid accumulation triggers the increased generation of reactive oxygen species and upregulates the activities of antioxidant enzymes in maize leaves[J].JournalofExperimentalBotany,2002,53(379):2 401-2 410.
[12]WANG A G(王爱国),LUO G H(罗广华).Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants[J].PlantPhysiologyCommunications(植物生理学通讯),1990,26(6):55-57(in Chinese).
[13]ZHANG R X(张荣铣),XU X M(许晓明),DAI X B(戴新宾),etal.Decline of photosynthetic function and its relation with active oxygen in a rice mutant with low chlorophyll b content[J].JournalofPlantPhysiologyandMolecularBiology(植物生理与分子生物学学报),2003,29(2):104-108(in Chinese).
[14]ZHAO SH J(赵世杰),XU CH CH(许长成),ZOU Q(邹 琦),etal.Improvements of method for measurement of malondialdehyde in plant tissues[J].PlantPhysiologyCommunications(植物生理学通讯),1994,30(3):207-210(in Chinese).
[15]高俊风.植物生理实验指导[M].西安:世界图书出版公司,2000:137-202.
[16]胡恒觉,黄高宝.新型多熟种植研究[M].兰州:甘肃科学技术出版社,1999:49-210.
[17]YOU J H(由继红),LU J M(陆静梅),YANG W J(杨文杰).Effects of Ca2+on photosynthesis and related physiological indexes of wheat seedlings under low temperature stress[J].ActaAgronomicaSinica(作物学报),2002,28(5):693-696(in Chinese).
[18]JIANG M Y(蒋明义),JING J H(荆家海),WANG SH T(王韶唐).Water stress and membrane-lipid peroxidation in plants[J].Journal ofNorthwestA&FUniversity(Nat.Sci.Edi.)(西北农业大学学报·自然科学版),1991,19(2):88-93(in Chinese).
[19]ZENG SH H(曾淑华),ZHAO ZH X(赵正雄),QIN P(覃 鹏),etal.Effects of water logging on some physiological and biochemical indexes of transgenic tobacco(NicotianatobacumL.)lines with superoxide dismutase or peroxidase gene[J].PlantPhysiologyCommunications(植物生理学通讯),2005,41(5):603-606(in Chinese).
[20]KIM S H,AHN Y O,AHN M J,etal.Down-regulation ofβ-carotene hydroxylase increasesβ-carotene and total carotenoids enhancing salt stress tolerance in transgenic cultured cells of sweet potato[J].Phytochemistry,2012,74(2):69-78.
[21]WANG W B,KIM Y H,LEE H S,etal.Analysis of antioxidant enzyme activity during germination of alfalfa under salt an drought stresses[J].PlantPhysiologyandBiochemistry,2009,47(7):570-577.

