巴西橡胶树HbMKK 4基因的克隆及表达分析
吴绍华,张世鑫,2,杨署光,田维敏*
(1 中国热带农业科学院橡胶研究所,农业部橡胶树生物学与遗传资源利用重点实验室,省部共建国家重点实验室培育基地-海南省热带作物栽培生理学重点实验室,海南儋州571737;2 海南大学 园艺园林学院,海口570228)
橡胶作为世界四大工业原材料之一,是一种重要的战略物资。目前,99%以上的天然橡胶来源于巴西橡胶树(Heveabrasiliensis)。巴西橡胶树原产于高温、高湿、静风的巴西亚马逊河流域,是典型的热带雨林树种。中国种植橡胶树的区域主要位于N 18°~24°的热带北缘地区(主要是海南、云南和广东)。橡胶树是一种异花授粉高度杂合的多年生木本经济作物,传统的杂交育种周期长,从人工授粉苗开始到选出一个供生产上大规模推广种植的品种一般需要30年时间。为了缩短育种年限,提高选种效率,减少土地、人力、物力的消耗,发展对杂交后代的早期筛选技术及从分子水平上改良橡胶树品质是行之有效的方法。由于对橡胶树产量调控分子机理缺乏足够的了解,在分子标记辅助育种及转基因改良橡胶树品质上难以取得突破,限制了橡胶树产量育种的进程。因此,天然橡胶生物合成调控分子机理的研究就显得迫切而重要。早在2000年,郝秉中等[1]研究证明茉莉酸类物质(jasmonates,JA)是调节巴西橡胶树乳管分化的关键信号分子。外施JA可显著上调橡胶生物合成关键酶的基因表达,并能提高胶乳的干胶含量[2]。据此,推测天然橡胶的生物合成可能受茉莉酸信号途径的调节。但到目前为止,对于JA 如何调控天然橡胶生物合成的机理了解的较少。促分裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)级联途径是真核生物中保守的信号途径,由促分裂原活化蛋白激酶(MAPK)、促分裂原活化蛋白激酶的激酶(MAPK kinase,MAPKK/MKK)、促分裂原活化蛋白激酶的激酶之激酶(MAPK kinase kinase,MAPKKK)3个组分组成[3],由MAPKKK-MAPKK-MAPK 依次磷酸化传递信号[4-5]。有研究表明,MAPK 级联途径与JA 信号途径具有交互作用,在植物发育及防御应答中起着重要的作用[6-11]。因此,本研究从巴西橡胶树乳管细胞中克隆了MAPK 级联途径组分中的MKK 家族成员HbMKK4 的全长cDNA,并分析了其在橡胶树不同组织中的表达特性及其在割胶及茉莉酸甲酯和乙烯利处理下的表达特点,以期了解其在橡胶生物合成中的功能,为进一步研究MAPK 级联途径如何通过JA 信号途径调控橡胶的生物合成打下良好的基础。
1 材料和方法
1.1 材料与处理
实验材料为种植于中国热带农业科学院实验场的‘热研7-33-97(CATAS 7-33-97)’橡胶树实生苗、一年生萌条和割龄为3年的开割树。‘热研7-33-97’实生苗用于分析基因表达的组织特异性,选生长状态相近的根、树皮、胶乳、叶片,液氮冻存用于RNA 提取。割胶处理采用割龄为3年的开割树,选树围一致,割线离地高度一致的‘热研7-33-97’开割树进行割胶处理、割线为1/2树围螺旋割线,第一刀采集的胶乳作为对照,然后分别在第一刀割胶处理后的0.5h、2h、6h、12h、14h、1d、2d和3d割第二刀,采集的胶乳作为处理样品,每时间点采集5棵树,5棵树的cDNA 等量混合用于基因表达分析。乙烯利(ethephon,ET)及茉莉酸甲酯(methyl jasmonate,MeJA)处理采用的是1年生萌条,选大小及生理状态相近、叶篷稳定的‘热研7-33-97’的萌条为材料,用0.07% MeJA 涂抹第三伸长单位的节间树皮,作为处理组,对照为用于溶解0.07% MeJA的水剂;另外,用含0.5% ET 的溶液涂抹第三伸长单位节间树皮,作为乙烯利处理组,对照为用于溶解0.5%ET 的水剂。分别于处理后的1h、2h、4h、8 h、1d、2d、3d和5d用刀片割开树皮,每时间点处理9根萌条,将混合胶乳采集于RNA 提取液中。
1.2 方 法
1.2.1 总RNA 提取与cDNA 合成 橡胶树的根、树皮、叶片、胶乳RNA 的提取均参照天根公司RNAprep Pure多糖多酚植物总RNA 提取试剂盒的操作说明进行,柱上消化RNA 样品中残留的微量DNA。cDNA 第一链合成参照Ferments公司反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit)的说明书进行。
1.2.2HbMKK4基因的RACE 扩增和全长cDNA扩增 从巴西橡胶树胶乳转录组数据库中得到一段MKK 的Unigene序列,根据该序列设计RACE 引物,采 用Clontech 公司的试剂盒SMARTerTMRACE cDNA Amplification Kit进行序列的RACE扩增。其中5′-RACE 引物为5-GSP1(5′-TAAGTTCCGTTTCCTGGTCTTGTTTC-3′)和5-GSP2(5′-ATGACTCCGATGCGATAAGATTTGA-3′);3′-RACE引物为3-GSP1(5′-CTTGGGGGTGAGCATATTGGAGTTCT-3′)和3-GSP2(5′-ATCAAGGAATAGTGGAGGCCAAAGAG-3′)。以RACE 测序片段与Unigene序列拼接的序列设计全长cDNA的扩增引物FL-CDNA-F(5′-CGCTTTTCTCTCACCTGCAAAG-3′)和FL-CDNA-R(5′-TGTTGAAACCAGGAGCATGAAC-3′)。全长cDNA 扩增体系:Takara PrimeSTAR Max Premix(2×)25 μL,FL-CDNA-F(10μmol·L-1)2.5μL,FL-CDNA-R(10μmol·L-1)2.5μL,cDNA 模板1μL,灭菌水补足50μL。扩增程序为:95℃预变性3min;94℃变性30s,60℃退火30s,72℃延伸2min,共30个循环;72℃延伸10min。0.8%琼脂糖凝胶电泳分离PCR 扩增产物,天根胶回收试剂盒纯化目的条带,克隆到全式金公司的pEASY-Blunt Simple Cloning Vector载体上,送Invitrogen公司测序。
1.2.3 生物信息学分析 利用NCBI网站ORF Finder 软件(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)进行开放阅读框(ORF)预测,同时翻译成蛋白序列。DNAMAN 软件对基因的编码氨基酸进行比对分析。用ProtParam 软件(http://au.expasy.org/tools/protparam.html/)在线分析该蛋白的分子量与等电点。SOPMA 在线软件预测蛋白的二级结构。NetPhos 2.0Server在线预测氨基酸的磷酸化位点。从NCBI数据库下载不同植物的MKK 蛋白序列,利用软件MEGA 4.0采用Neighbor-Joining(NJ)模型,并进行1 000次Bootstrap统计学检验构建包括HbMKK4 蛋白序列在内的植物MKK 蛋白系统进化树。
1.2.4 实时荧光定量PCR 分析 采用Bio-Rad公司的CFX 实时荧光定量PCR 系统进行基因的相对定量表达分析。取1μg RNA,逆转录合成cDNA第一链,稀释10倍后作为实时定量PCR 分析的模板。HbMKK4荧光定量引物为MKK4-F(5′-TGTTGCTGTTGTTATTGTTGGTG-3′)和 MKK4-R(5′-ACCCCATTCCCCATTTCTTTCT-3′)。内 参基因引物为Actin-F(5′-GATTCCGTTGCCCAGAAGTC-3′)和Actin-R(5′-CACCACTCAGCACAATGTTACC-3′)。20μL荧光定量反应体系中,包含1μL cDNA 模板,10μL Takara 2×SYBR Premix ExTaqⅡ(Tli RNaseH Plus)和每条引物10μmol·L-1各0.6μL(引物终浓度为0.3μmol·L-1)。PCR 反应程序 为:95℃预变性30s;95℃变 性10 s,60℃退火20s,72℃延伸20s,共40个循环。利用CFX manager 3.0软件自动进行基线和Cq值分析。以HbActin作为内参基因,采用2-△△Cq算法分析相对表达量。
采用t测验对处理与对照样品的相对定量结果进行统计分析。
2 结果与分析
2.1 HbMKK 4基因全长cDNA 的克隆及生物信息学分析
本研究通过5′-RACE 扩增,获得了305bp 非编码区序列(untranslated region,UTR),通过3′-RACE获得长336bp 序列(图1),将两端序列与Unigene序列进行拼接,并设计全长cDNA 引物,对拼接序列进行RT-PCR 和测序验证。结果显示HbMKK4基因(GenBank 登录号KP262501)全长cDNA 序列1 580bp,其中5′-UTR 长305bp,3′-UTR 长216bp,ORF编码框1 059bp,编码352个氨基酸(图2)。
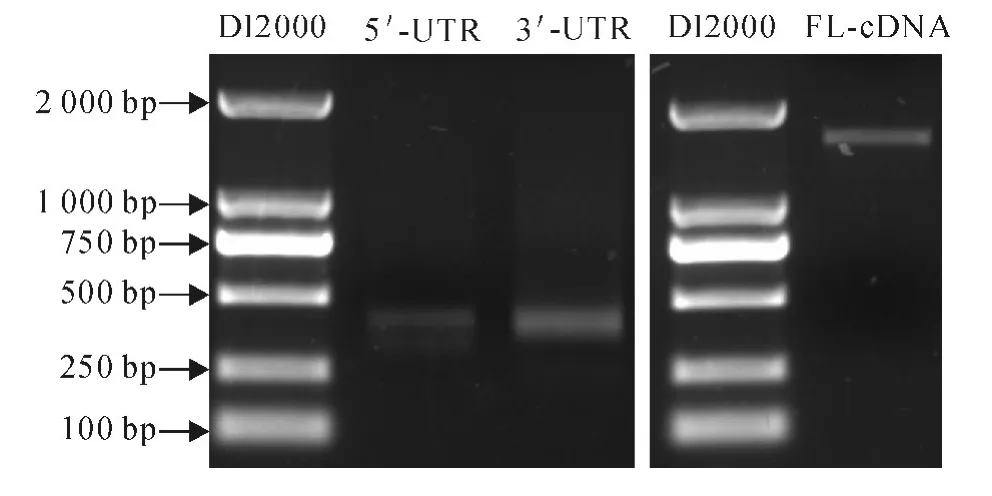
图1 HbMKK 4基因RACE及全长cDNA(FL-cDNA)电泳结果Fig.1 The agarose gel electrophoresis of HbMKK 4 RACE and full-length cDNA(FL-cDNA)

图2 橡胶树HbMKK 4基因序列和推导氨基酸序列Fig.2 Nucleotide and deduced amino acid sequences of HbMKK 4

图3 HbMKK4推导的氨基酸序列与其他植物MKK 蛋白序列比对Fig.3 The deduced amino acid sequences of HbMKK4compared with other plant MKKs
保守结构域分析表明,该基因编码的蛋白含有S_TKc结构域(Serine/Thresnine protein kinases,catalytic domine),具有激酶活性位点、ATP结合位点和底物结合位点,属于PKC超家族。在线软件磷酸化位点预测结果显示,该蛋白共有14个磷酸化位点,其中9个丝氨酸(Ser-S)位点,4个苏氨酸(Thr-T)位点,1 个酪氨酸(Tyr-Y)位点(图3)。Prot-Param 软件预测结果显示,该基因编码蛋白分子式为C1700H2718N508O509S13,分子量为38.83kD,理论等电点为9.36,不稳定系数为50.94,属于不稳定类蛋白。在线软件预测结果显示,该氨基酸序列由30.11%α-螺旋、13.64%延伸链、4.26%β-转角和51.99%无规则卷曲组成。另外,该蛋白无导肽、无跨膜结构域、属于亲水性蛋白。
2.2 HbMKK 4 推导的氨基酸序列比对及进化树构建
根据橡胶树HbMKK4 推导氨基酸序列,与NCBI数据库中部分MKK 蛋白氨基酸序列进行比对。结果显示,该基因编码氨基酸序列与其他物种MKK 氨基酸序列具有较高相似性,其中与麻疯树(Jatrophacurcas)假定蛋白JCGZ_19828(KDP-27705.1)、毛果杨(Populustrichocarpa)PtMKK4(XP_006379405.1)和蓖麻(Ricinuscommunis)Rc-MKK(XP_002523019.1)的相似性分别为82.83%、73.63%和72.47%(图3)。聚类结果显示,橡胶树HbMKK4氨基酸序列与麻疯树假定蛋白JCGZ_19828(KDP27705.1)聚为一类,亲缘关系最近(图4)。
2.3 HbMKK 4基因表达分析
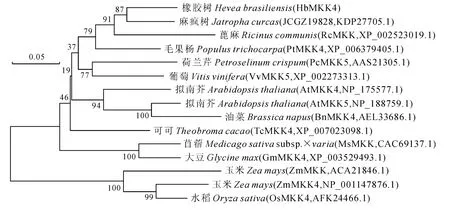
图4 HbMKK4与其它物种MKK 蛋白的进化分析Fig.4 Phylogenetic relationships between HbMKK4and other plant MKKs
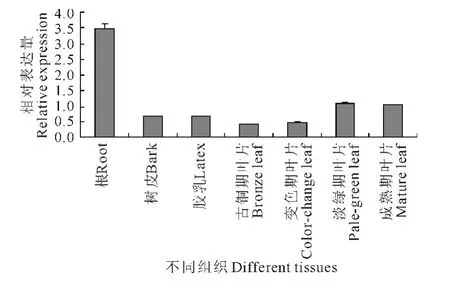
图5 HbMKK 4基因的组织特异性表达分析Fig.5 Transcription pattern analysis of HbMKK 4 in different tissues from Hevea brasiliensis
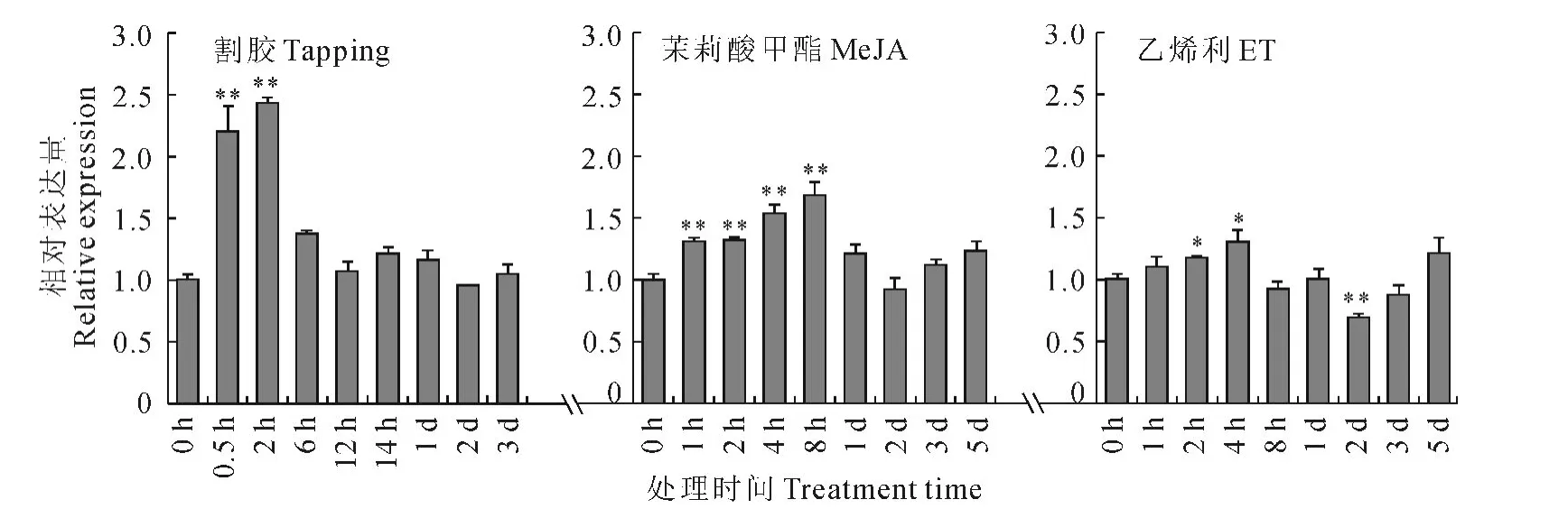
图6 不同处理对胶乳HbMKK4基因表达的影响Fig.6 Expression patterns of HbMKK4under the different treatment
采用实时荧光定量PCR 技术,以HbActin基因为内参,检测了HbMKK4基因表达的组织特异性(图5),及其在割胶、茉莉酸甲酯(MeJA)、乙烯利(ET)处理下胶乳中的表达模式(图6)。结果显示,HbMKK4在橡胶树的根、树皮、胶乳及叶片中均有表达,其中在根中的表达最高,树皮及胶乳中的表达相近,淡绿期及成熟期叶片相对古铜期及变色期表达有所上升(图5)。
割胶显著上调胶乳中HbMKK4 基因的表达,基因相对表达量在割胶后2h达到最高,是对照的2倍多,达极显著水平,在割胶处理6h~3d,基因相对表达量逐渐下调至对照水平。茉莉酸甲酯显著上调HbMKK4基因的表达,MeJA 处理1h后,基因相对表达量显著上调,在8h后达到最高,表达量是对照1.5倍多,1d后,表达量逐渐下调至对照水平。另外,ET 处理也能上调HbMKK4基因的表达,但是上调的幅度比割胶、MeJA 处理要小。ET 处理4 h后,基因相对表达量达到最高,仅是对照的1.3倍。而且,ET 处理2d后,基因表达显著下调,相对表达量是对照的0.7倍(图6)。
3 讨 论
植物MAPK 级联途径在植物的逆境胁迫及发育中起着重要的调控作用。研究发现,植物的MKK4主要参与植物的防卫反应及渗透胁迫。如拟 南 芥 中 MEKK1-MKK4/MKK5-MPK3/MPK6级联途径通过磷酸化激活转录因子WRKY22、WRKY29 和FRK1(flg22-induced receptor kinase 1)的活性,参与拟南芥对细菌和真菌病原物的先天免 疫[12]。最近证实EDR1 通过负调控MKK4/MKK5-MPK3/MPK6级联途径参与植物的先天免疫[13]。另外,拟南芥MKK4通过调控MPK3活性参与渗透胁迫响应[14]。
橡胶树树干树皮中的乳管是橡胶树合成和储存天然橡胶的场所,也是橡胶树的一种防卫结构,其内含物胶乳是一种重要的防御应答诱导的次生代谢产物[1],含有大量的防卫相关蛋白[15-17]。JA 是调节植物次生代谢的关键信号分子,植物防卫反应可以诱导体内JA 的积累,JA 通过调控次生代谢生物合成相关基因的表达,促进次生代谢产物的合成[18-20]。郝秉中等[1]发现外施JA 及其前体亚麻酸能够诱导橡胶树的次生乳管分化,同时发现机械损伤可以诱导乳管分化,其效应可被外施JA 生物合成的抑制剂阻断,表明机械伤害引起内源JA 的合成和积累,进而诱导乳管分化[21]。外施JA 也可显著上调橡胶生物合成关键酶的基因表达,并能提高胶乳的干胶含量[2]。因此,推测天然橡胶的生物合成可能受JA信号途径的调节。
蛋白激酶或蛋白磷酸化抑制剂的药理学研究证实蛋白的磷酸化及去磷酸化在JA 信号途径中起着重要的作用[22]。而且,MAPK 级联途径与JA 信号途径具有交互作用,在植物发育及防御应答中起着重要的作用[6-11]。Takahashi 等[8]揭 示 MKK3-MPK6组分在拟南芥茉莉酸信号中起着关键的作用。研究发现,受JA 诱导的MPK6活性在突变体mkk3-1植株中被抑制,而在35S-MKK3 植株中被增强,表明受JA 诱导的MPK6活性依赖于MKK3。同时,MAPK 级联途径也参与乙烯的应答。拟南芥中MKK4/5-MPK3/6 通过调控乙烯合成限速酶ACS2/6参与乙烯的合成[23-24]。Yoo等[25]研究证实MKK9-MPK3/6也参与乙烯的应答反应。
本研究从乳管细胞中克隆了HbMKK4基因的全长cDNA,并分析了其在割胶、MeJA、ET 处理下的基因表达模式,发现HbMKK4基因的表达受割胶、MeJA、ET 诱导。目前,割胶是天然橡胶生产的重要环节之一,而且能够促进乳管分化[26],也促进天然橡胶生物合成[27]。乙烯利是一种人工合成的乙烯释放剂,被广泛应用于橡胶树的刺激采胶,大幅度提高了天然橡胶的产量。研究证实,乙烯利刺激增产主要是通过延长乳管的排胶时间和提高乳管细胞的基础代谢来实现的[28-29]。因 此,HbMKK4 基因可能通过茉莉酸信号途径在橡胶树乳管防卫及橡胶的生物合成中起着重要的作用,但是具体作用机制还有待于进一步的鉴定。
[1]HAO B ZH,WU J L.Laticifer differentiation inHeveabrasiliensis:Induction by exogenous jasmonic acid and linolenic acid[J].Ann.Bot.,2000,85:37-43.
[2]赵 悦.巴西橡胶树乳管细胞茉莉酸信号途径对橡胶生物合成调节的研究[D].海口:海南大学,2011.
[3]MAPK GROUP.Mitogen-activated protein kinase cascades in plants:a new nomenclature[J].TrendsPlantSci.,2002,7(7):301-308.
[4]CHANG L,KARIN M.Mammalian MAP kinase signalling cascades[J].Nature,2001,410(6 824):37-40.
[5]GUSTIN M C,ALBERTYN J,ALEXANDER M,etal.MAP kinase pathways in the yeastSaccharomycescerevisiae[J].Microbiol.Mol.Biol.Rev.,1998,62(4):1 264-1 300.
[6]MELDAU S,ULLMAN-ZEUNERT L,GOVIND G,etal.MAPK-dependent JA and SA signalling inNicotianaattenuataaffects plant growth and fitness during competition with conspecifics[J].BMCPlantBiol.,2012,12:213.
[7]SETHI V,RAGHURAM B,SINHA A K,etal.A mitogen-activated protein kinase cascade module,MKK3-MPK6and MYC2,is involved in blue light-mediated seedling development inArabidopsis[J].PlantCell,2014,26(8):3 343-3 357.
[8]TAKAHASHI F,YOSHIDA R,ICHIMURA K,etal.The mitogen-activated protein kinase cascade MKK3-MPK6is an important part of the jasmonate signal transduction pathway inArabidopsis[J].PlantCell,2007,19(3):805-818.
[9]HETTENHAUSEN C,BALDWIN I T,WU J.NicotianaattenuataMPK4suppresses a novel jasmonic acid(JA)signaling-independent defense pathway against the specialist insect Manduca sexta,but is not required for the resistance to the generalistSpodopteralittoralis[J].NewPhytol.,2013,199(3):787-799.
[10]GOMI K,OGAWA D,KATOU S,etal.A mitogen-activated protein kinase NtMPK4activated by SIPKK is required for jasmonic acid signaling and involved in ozone tolerance via stomatal movement in tobacco[J].PlantCellPhysiol.,2005,46(12):1 902-1 914.
[11]SEO S,SANO H,OHASHI Y.Jasmonate-based wound signal transduction requires activation of WIPK,a tobacco mitogen-activated protein kinase[J].PlantCell,1999,11(2):289-298.
[12]ASAI T,TENA G,PLOTNIKOVA J,etal.MAP kinase signalling cascade inArabidopsisinnate immunity[J].Nature,2002,415(6 875):977-983.
[13]ZHAO C,NIE H,SHEN Q,etal.EDR1physically interacts with MKK4/MKK5and negatively regulates a MAP kinase cascade to modulate plant innate immunity[J].PLoSGenet,2014,10(5):e1004389.
[14]KIMA S H,WOO D H,KIMA J,etal.ArabidopsisMKK4mediates osmotic-stress response via its regulation of MPK3activity[J].BiochemicalandBiophysicalResearchCommunications,2011,412(1):150-154.
[15]GIDROL X,CHRESTIN H,TAN H L,etal.Hevein,a lectin-like protein fromHeveabrasiliensis(rubber tree)is involved in the coagulation of latex[J].J.Biol.Chem.,1994,269(12):9 278-9 283.
[16]KO J H,CHOW K S,HAN K H.Transcriptome analysis reveals novel features of the molecular events occurring in the laticifers ofHeveabrasiliensis(para rubber tree)[J].PlantMol.Biol.,2003,53(4):479-492.
[17]SUBROTO T,VAN KONINGSVELD G A,SCHREUDER H A,etal.Chitinase and beta-1,3-glucanase in the lutoid-body fraction ofHevealatex[J].Phytochemistry,1996,43(1):29-37.
[18]DEVOTO A,ELLIS C,MAGUSIN A,etal.Expression profiling reveals COI1to be a key regulator of genes involved in wound-and methyl jasmonate-induced secondary metabolism,defence,and hormone interactions[J].PlantMol.Biol.,2005,58(4):497-513.
[19]MENKE F L,CHAMPION A,KIJNE J W,etal.A novel jasmonate-and elicitor-responsive element in the periwinkle secondary metabolite biosynthetic gene Str interacts with a jasmonate-and elicitor-inducible AP2-domain transcription factor,ORCA2[J].EMBOJ.,1999,18(16):4 455-4 463.
[20]VAN DER FITS L,MEMELINK J.ORCA3,ajasmonate-responsive transcriptional regulator of plant primary and secondary metabolism[J].Science,2000,289(5 477):295-297.
[21]WU J L,HAO B ZH,TAN H Y.Wound–induced laticifer differentiation inHeveabrasiliensisshoots mediated by jasmonic acid[J].JournalofRubberResearch,2002,5(1):53-63.
[22]LEON J,ROJO E,SANCHEZ-SERRANO J J.Wound signalling in plants[J].J.Exp.Bot.,2001,52(354):1-9.
[23]JOO S,LIU Y,LUETH A,etal.MAPK phosphorylation-induced stabilization of ACS6protein is mediated by the non-catalytic C-terminal domain,which also contains the cis-determinant for rapid degradation by the 26Sproteasome pathway[J].PlantJ.,2008,54(1):129-140.
[24]LIU Y,ZHANG S.Phosphorylation of 1-aminocyclopropane-1-carboxylic acid synthase by MPK6,a stress-responsive mitogen-activated protein kinase,induces ethylene biosynthesis inArabidopsis[J].PlantCell,2004,16(12):3 386-3 399.
[25]YOO S D,CHO Y H,TENA G,etal.Dual control of nuclear EIN3by bifurcate MAPK cascades in C2H4signalling[J].Nature,2008,451(7 180):789-795.
[26]HAO B ZH(郝秉中),WU J L(吴继林).Effects of wound(tapping)on laticifer differentiation inHeveabrasiliensis[J].ActaBotanica Sinica(植物学报),1982,24(4):388-391(in Chinese).
[27]HAO B ZH,WU J L.Biology of laticifers inHeveaand latex production[J].ChineseJournalofTropical(热带作物学报),2004,25(4):1-7(in Chinese).
[28]TANG C R,HUANG D B,YANG J H,etal.The sucrose transporter HbSUT3plays an active role in sucrose loading to laticifer and rubber productivity in exploited trees ofHeveabrasiliensis(para rubber tree)[J].PlantCellEnviron,2010,33(10):1 708-1 720.
[29]TUNGNGOEN K,KONGSAWADWORAKUL P,VIBOONJUN U,etal.Involvement of HbPIP2;1and HbTIP1;1aquaporins in ethylene stimulation of latex yield through regulation of water exchanges between inner liber and latex cells inHeveabrasiliensis[J].Plant Physiol.,2009,151(2):843-856.

