盐胁迫对鸡爪槭幼苗生长及其叶绿素荧光参数的影响
唐 玲,李倩中,荣立苹,李淑顺
(江苏省农业科学院 园艺研究所/江苏省高效园艺作物遗传改良重点实验室,南京210014)
中国盐碱地面广量大,各类盐碱地面积总计9 913.3万公顷[1],包括许多城市土地也有不同程度的盐碱化[2],致使很多城市绿化树种在盐胁迫条件下生长。而前人大量研究表明,盐胁迫能直接影响树木的生长发育,尤其在光合作用方面,表现为叶片气孔导度减弱,叶绿素含量降低,光合效率下降,导致树木生长发育不同程度受害,如柳枝稷叶片净光合速率在盐胁迫下显著下降[3],桑树幼苗在高盐胁迫下最大荧光、最大光化学效率、潜在光化学效率和PSⅡ有效光化学量子效率显著降低[4],杨树在盐胁迫下叶绿体结构受到破坏而引起叶绿体色素含量下降、光合能力减弱[5-6];但也有研究发现一些苗木叶片在盐胁迫下能维持或提升净光合速率,表现出较好的耐盐性[7]。
鸡爪槭作为重要的城市观赏与绿化树种,其需求量巨大,且较为适合盐碱地种植[2],在土地盐碱化城市生态绿化过程中起着不可或缺的作用。但迄今为止,鸡爪槭对盐胁迫的生理响应机制仍然不明确,且研究报道甚少,不利于鸡爪槭种植水平的提高和品种改良。因此,本研究设置不同的土壤盐浓度,分析鸡爪槭叶色和叶绿素荧光参数对盐胁迫的响应,以明确盐胁迫对鸡爪槭叶片光合特性的影响机制,为鸡爪槭的栽培管理水平提升和品种改良提供科学依据。
1 材料和方法
1.1 供试材料
试验地设在江苏省农业科学院园艺研究所智能温室内。试材为生长健壮、长势一致、生长良好的一年生鸡爪槭幼苗,苗高30cm 左右。鸡爪槭幼苗采自江苏省农业科学院园艺研究所槭树资源圃。
1.2 试验处理
试验于2011年7月~9月间进行,温室内平均温度为28 ℃,平均相对湿度为73%,光照强度为0~800μmol·m-2·s-1。7月中旬将鸡爪槭幼苗移栽到30cm×25cm×15cm 的塑料花盆中,每盆1株,栽培基质为珍珠岩,每周浇灌1 次Hoagland完全营养液(每盆1L),缓苗15d,之后再进行试验处理。依据预试验的筛选结果,试验共设置4个盐分梯度,土壤NaCl含量分别为0.042%(对照)、0.2%、0.4%、0.6%,每处理3 次重复,每重复10盆,随机排列。根据试验观察,盐处理60d之后不同处理植株生长表现出明显差异,具体为:叶片出现不同程度卷曲或脱落,植株生长速度、生长量出现差异。NaCl处理后每隔5d浇灌1 次营养液。试验期间,盆底放置塑料托盘,浇灌后将渗出的溶液回浇到盆内,基质上层用细沙覆盖保湿,防止水分和盐分流失,其他按常规管理。
1.3 测定指标及方法
1.3.1 叶片色素含量及含水量 2011年9月21日(盐胁迫处理后60d),选取枝条中部成熟叶片沿中脉两侧打孔取叶圆片按朱广廉等的方法测定叶绿素含量[8];叶片花色素苷(Ant)含量测定参照马志本等的方法(以μmol·g-1表示)[9];同期取新鲜叶片于天平上称其鲜质量W1,放入烘箱内105 ℃杀青0.5h,转入80 ℃烘干,称其干质量W2,然后计算叶片含水量。叶片含水量(%)=[(W1-W2)/W1]×100%。
1.3.2 盐害指数 NaCl处理后每5d观察1次受害表现,第60 天计算盐害指数(SI)和盐害率(P)[10]。盐害分级标准为[11]:0 级,无盐害症状;1级,轻度盐害,有少部分叶尖、叶缘或者叶脉变黄;2级,中度盐害,有大约1/2 的叶尖、叶缘焦枯;3 级,重度盐害,大部分叶尖、叶缘焦枯或落叶;4级,极重度盐害,枝枯、叶落、最终死亡。
盐害指数(SI)=∑(盐害级值×相应盐害级株数)/(总株数×盐害最高级值)×100%;
盐害率(P)=(出现盐害症状株数/调查总株数)×100%。
1.3.3 叶绿素荧光参数 盐胁迫处理后第60天采用Li-6400R 便携式荧光-光合作用测量系统的6400-40荧光叶室进行叶绿素荧光参数测定,叶片暗适应20 min后在Default fluorometer模式下测定并计算暗适应下鸡爪槭中上部功能叶片的荧光参数。荧光参数测定时间选在晴天光强稳定的中午前后进行,每处理测5片叶作为重复,取平均值并进行标准误分析。初始荧光Fo、最大荧光Fm、稳态荧光Fs、光下最大荧光Fm′,光下最小荧光Fo′等参数可由仪器直接测出。并由此计算出其他各相关指标:可变荧光(Fv)=Fm-Fo;PSⅡ潜在活性(Fv/Fo);PSⅡ潜在量子效率(Fv/Fm)=(Fm-Fo)/Fm;光化学猝灭系数(qP)=(F′-Fs)/(Fm′-Fo)[12];非光化学猝灭系数(NPQ)=Fm/Fm′-1;PSⅡ实际光化学 效 率(ФPSⅡ)=qP(Fv′/Fm′)=(Fm′-Fs)/Fm′[13];光 合 电 子 传 递 速 率(ETR)=(Fm′-Fs)/Fm′×PFD×0.5×0.84;光化学量子产量(Yield)=(Fm′-F)/Fm′。
1.4 数据处理
采用Excel软件进行数据分析,用SPSS 11.5软件进行差异显著性分析,并用SigmaPlot12.0软件作图。
2 结果与分析
2.1 盐胁迫条件下鸡爪槭的盐害指数和盐害率
各盐浓度处理均不同程度影响着鸡爪槭叶片含水量,且随着盐浓度的增大呈逐渐下降趋势(表1),在0.2%、0.4%和0.6%盐浓度下,鸡爪槭叶片含水量分别比对照低5.25%、6.7%和23.52%,但仅0.6%盐浓度下达到显著水平,且也与0.2%和0.4%盐浓度之间的差异显著。
同时,通过对鸡爪槭的盐害症状(表1)分析发现,在0.2%盐浓度下,有1/5的鸡爪槭叶片叶尖和叶缘呈失水萎蔫状,表现出轻度盐害症状;在0.4%盐浓度下,约有1/2的鸡爪槭叶片叶尖和叶缘失水萎蔫并有焦枯,表现出中度盐害症状;在0.6%盐浓度下,鸡爪槭植株出现了重度盐害,叶片大部分失水萎蔫并有焦枯,焦枯面积约达1/2以上。另外,各盐处理的鸡爪槭盐害指数和盐害率均随盐浓度的增大呈上升趋势,且不同盐浓度处理间差异均达到显著水平。可见,随着盐胁迫浓度的增加,鸡爪槭叶片含水量逐渐下降,盐害指数和盐害率依次显著增加,分别出现轻度、中度和重度盐害症状。
2.2 盐胁迫对鸡爪槭叶片色素含量的影响
由表2可以看出,随着盐胁迫浓度的增加,鸡爪槭幼苗叶片中叶绿素a(Chl a)、叶绿素b(Chl b)、总叶绿素(Chl)均逐渐降低,叶绿素a/b(Chl a/Chl b)则逐渐增加。其中,在0.2%、0.4%和0.6%NaCl处理 下,Chl a 含 量 较 对 照 分 别 下 降 了0.5%、36.3%和65.8%,Chl b 含 量 分 别 下 降 了4.6%、50.0%和78.5%,Chl 含 量 分 别 下 降 了1.5%、39.6%和68.8%,Chl a/Chl b分别增加了0.02%、27.2%和59.5%,且在后2个浓度下均达到显著水平。同时,鸡爪槭幼苗叶片中含量随着盐浓度的提高而逐渐大幅度增加,0.2%、0.4%和0.6%NaCl处理 较 对 照 分 别 显 著 提 高48.7%、280.3% 和382.7%,且后2者NaCl处理的花色素苷含量差异并不显著。由此可见,各浓度盐胁迫致使鸡爪槭幼苗叶片叶绿素含量不同程度降低,而使其Chl a/Chl b和花色素苷含量不同程度增加,且盐浓度越高升降幅度越大;同等盐浓度胁迫下,花色素苷含量的变化幅度最大,随后依次是Chl b含量、Chl a含量和Chl a/Chl b的值,即盐胁迫明显促进了鸡爪槭叶片花色素苷的合成,却破坏了Chl b和Chl a的合成,且Chl b受破坏的程度更大。
2.3 盐胁迫对鸡爪槭叶片叶绿素荧光参数的影响
2.3.1 PSⅡ潜在活性和最大光化学量子效率Fv/Fo表示反应中心PSⅡ的潜在活性,可变荧光与最大荧光的比值(Fv/Fm)表示PSⅡ的最大光能转化效率[14]。鸡爪槭叶片中PSⅡ的潜在活性(Fv/Fo)和最大光化学量子效率(Fv/Fm)均随着盐浓度的增大呈逐渐下降趋势(图1)。在0.2%、0.4%和0.6%盐浓度下,鸡爪槭叶片PSⅡ的潜在活性分别比对照显著下降了17.3%、30.2%和32.7%,而0.4%和0.6%盐浓度之间的差异却不显著。鸡爪槭叶片最大光化学量子效率在0.2%盐浓度处理下仅比对照下降了4.9%,未达到显著水平,而在0.4%和0.6%盐浓度下却分别比对照显著下降了9.9%和10.7%,而2个盐浓度之间则差异不显著。可见,鸡爪槭叶片中PSⅡ潜在活性在轻度盐胁迫下就受到显著抑制,而其最大光量子效率只在中度和重度盐胁迫下才显著下降,即PSⅡ潜在活性对盐胁迫更敏感。
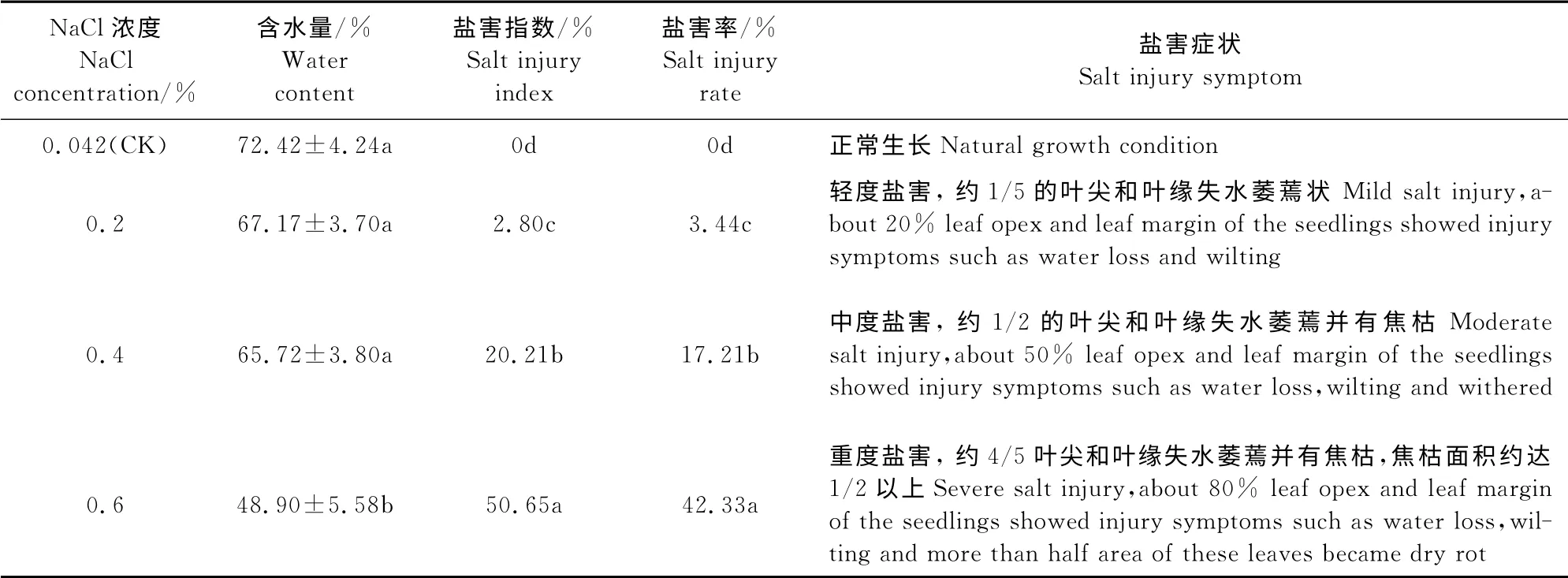
表1 不同NaCl浓度处理后鸡爪槭叶片的含水量、盐害指数及盐害率Table1 Water content,salt injury indexes and salt injury rates of A.palmatum with NaCl treatments

表2 盐胁迫对鸡爪槭叶片色素含量的影响Table2 Effects of salt stress on pigment content in leaves of A.palmatum
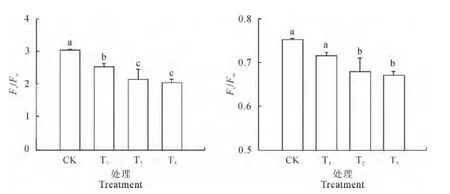
图1 不同NaCl浓度下鸡爪槭幼苗叶片的Fv/Fo 和Fv/FmFig.1 The Fv/Foand Fv/Fmin leaves of A.palmatumunder salt stress
2.3.2 实际光量子产量和表观光合电子传递速率 从图2看出,鸡爪槭叶片中实际光量子产量(Yield)和表观光合电子传递速率(ETR)均随着盐浓度的增大而逐渐降低,且都与对照差异达到显著水平。在0.2%、0.4%和0.6%盐浓度下,鸡爪槭叶片的Yield值分别比对照显著降低了37.9%、64.6%和77.2%,ETR值则分别比对照显著降低了37.9%、64.5%和77.1%,而0.4%和0.6%盐浓度之间的差异均不显著。以上结果表明,不同浓度NaCl胁迫均显著抑制了鸡爪槭叶片实际光合量子产量和表观光合电子传递效率。
2.3.3 荧光猝灭动力学 光化学淬灭系数(qP)反映的是PSⅡ天线色素吸收的光能用于光化学电子传递的份额,非光化学淬灭系数(NPQ)反映的是PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的部分[15]。从表3可以看出,鸡爪槭叶片的实际光化学效率(ΦPSⅡ)和光化学猝灭系数(qP)均随盐浓度的增加而逐渐下降,且0.4%和0.6%NaCl处理与对照差异均达到显著水平。
与以上2个参数表现不同,鸡爪槭叶片的非光化学猝灭(NPQ)随盐胁迫浓度的增加先升高后降低,并在0.2%NaCl处理下达到最高值,并比对照显著增加了33.3%;而当NaCl浓度为0.4%时,NPQ有所降低,但仍显著高于对照;而当NaCl浓度为0.6%时,NPQ已比对照显著降低。以上结果表明,浓度高于0.4%NaCl胁迫可使鸡爪槭PSⅡ的光化学效率显著减低,并显著减少用于光化学途径的能量分配比例,且不能有效启动非辐射热能量耗散机制将过量的光能以热的形式散发掉,从而对光合机构造成伤害。
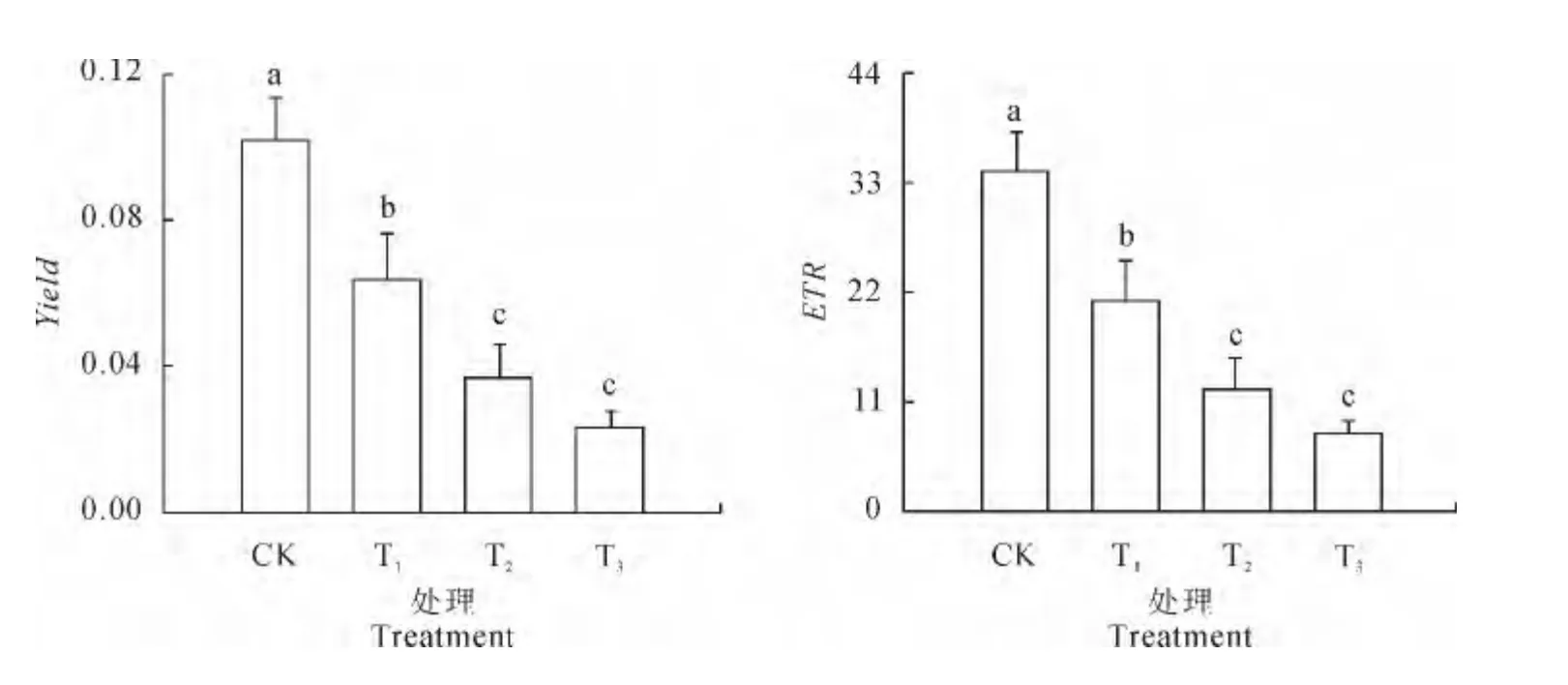
图2 不同NaCl浓度对鸡爪槭叶片Yield 和ETR 的影响Fig.2 Effects of salt stress on Yieldand ETRin leaves of A.palmatum
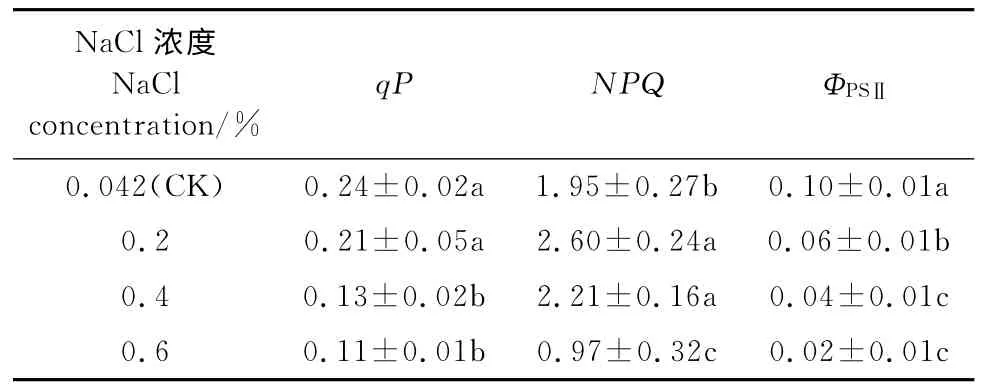
表3 不同NaCl浓度胁迫下鸡爪槭叶片qP、NPQ 和ΦPSⅡ的变化Table3 The qP,NPQandΦPSⅡin leaves of A.palmatumunder NaCl stress
3 讨 论
不同树种幼苗叶片光合作用对盐胁迫响应不同,柳树[3]、桑树[4]、杨树[5]对盐胁迫较为敏感,其叶片光合作用效率在盐胁迫下显著下降,而核桃、槭树等在高盐胁迫下光合作用效率才显著下降[7],国槐在一定盐浓度胁迫下光合作用效率则还有所增强[7]。不同槭属植物对盐胁迫耐性也不一致,鸡爪槭表现出较好的耐盐性[2]。而光合作用强弱可作为反映植物耐逆与否的重要生理指标,且与叶绿素含量和叶绿素荧光诱导动力学曲线及参数的变化密切相关。已有的研究证实,葡萄幼苗叶片Fv/Fm、Fv/Fo、Yield、ETR和qP在盐胁迫下同时下降,导致光合作用效率显著下降[16];桑树幼苗叶片Fv/Fm和ΦPSⅡ随盐浓度增加逐渐下降且在高盐浓度下达到显著水平[4]。本研究发现,鸡爪槭幼苗叶片叶绿素a和b及叶绿素总含量均随盐浓度的增加而显著下降,叶绿素荧光参数Fv/Fo也显著下降,表明此时鸡爪槭叶片PSⅡ光化学反应中心活性已受到明显影响,潜在活性下降;同时,叶片Fv/Fm、Yield、ETR、ΦPSⅡ和qP也随着盐浓度的增大呈显著下降趋势,且高盐胁迫下降尤为显著,这表明盐胁迫下鸡爪槭叶片捕获的光能用于光化学反应比例降低,而转化为热能消耗的比例升高,将导致光合作用可利用能量下降;但同期NPQ在低盐胁迫时则较对照显著提高,高盐胁迫下显著下降,又表明低盐胁迫下幼苗叶片可能通过增加PSⅡ反应中心非辐射热能量耗散来保护光合机构不受损害,而高盐胁迫下PSⅡ反应中心光合机构受到严重损害。本研究同时发现,盐胁迫下鸡爪槭叶片花色素苷含量显著提高,而花色素苷可以吸收光能并耗散叶片过剩光能进而保护光合机构[17-18],表明在盐胁迫下鸡爪槭能通过提高叶片花色素苷含量来缓解光合机构受损程度。
此外,盐胁迫造成植物叶片光合作用受阻,与叶片含水量密切相关[19-20]。本研究发现,鸡爪槭叶片含水量在中低盐分胁迫条件下没有显著下降,盐害表现较轻;而高盐胁迫条件下显著下降,盐害表现较重。表明较高的叶片含水量有利于维持鸡爪槭幼苗叶片正常代谢活动,这也与叶绿素荧光参数变化趋势相吻合。
综上所述,在盐胁迫条件下,鸡爪槭叶片含水量和叶绿素含量显著下降,PSⅡ的实际光化学转化效率降低,进而影响叶片光合作用;而同期叶片花色素苷含量显著提高,有助于缓解盐胁迫对叶片光合机构的伤害。但在低盐条件下,鸡爪槭叶片含水量和叶绿素含量以及叶绿素荧光动力学参数没有显著下降,且可能通过PSⅡ反应中心非辐射热能量耗散增加来保护光合机构不受损害。在盐胁迫下,鸡爪槭叶片细胞形态也可能发生相应的变化,若能在进行叶绿素荧光特性探讨的基础上,进一步进行叶绿体超微结构变化特征的分析,可更为深入地阐释鸡爪槭对盐胁迫响应的生理机制,这也将作为本研究后续的工作和方向。
[1] 刘小京,刘孟雨.盐生植物利用与区域农业可持续发展[C].北京:气象出版社,2002:1-9.
[2] LI Q ZH(李倩中),SU J L(苏家乐),LIU X H (刘晓宏),etal.Salinity tolerance difference of fourAcerplant[J].JiangsuAgricultural Sciences(江苏农业科学),2009,37(6):227-228(in Chinese).
[3] ZHAO CH Q(赵春桥),LI J W(李继伟),FAN X F(范希峰),etal.Effects of different salt stresses on biomass,quality and photosynthetic physiology in switchgrass[J].ActaEcologicaSinica(生态学报).2015,35(19):1-9(in Chinese).
[4] KE Y ZH(柯裕州),ZHOU J X(周金星),LU N(卢 楠),etal.Effects of salinity on photosynthetic physiology and chlorophyll fluorescence characteristics of Mulberry(Morusalba)seedling[J].ForestRsearch(林业科学研究).2009,22(2):200-206(in Chinese).
[5] WANG X W(王秀伟),JIA G M(贾桂梅),MAO Z J(毛子军),etal.Effect of NaCl tolerance on photosynthetic physiology and growth of seedlings of three poplar clones[J].BulletinofBotanicalResearch(植物研究)2015,35(1):27-33(in Chinese).
[6] JIANG CH Q(姜超强),LI J(李 杰),LIU ZH P(刘兆普),etal.Photosynthetic characteristics and chloroplast ultrastructure of transgenic poplar under NaCl stress[J].ActaBotanicaBoreali-OccidentaliaSinica(西北植物学报),2010,30(2):301-308(in Chinese).
[7] ZHANG CH H(张川红),SHEN Y B(沈应柏),YIN W L(尹伟伦).Effect of salt stress on photosynthesic and growth of four tree species seedlings[J].ScientiaSilvaeSinicae(林业科学),2002,38(2):27-31(in Chinese).
[8] 朱广廉,钟海文,张爱琴.植物生理学实验[M].北京:北京大学出版社,1990:51-54.
[9] MA ZH B(马志本),CHENG Y E(程玉娥).The chemical method of anthocyanins content in the surface of apple fruit[J].ChinaFruits(中国果树),1984,4:49-51(in Chinese).
[10] LI H Y(李会云),GUO X W(郭修武).Influence of NaCl on activities of protective enzymes and MDA content in grape root stock leaves[J].JournalofFruitScience(果树学报),2008,25(2):240-243(in Chinese).
[11] DU ZH J(杜中军),ZHAI H(翟 衡),LUO X SH(罗新书),etal.Salt tolerance identification on apple root stocks[J].JournalofFruit Science(果树学报),2002,19(1):4-7(in Chinese).
[12] VAN KOOTEN O,SNELJ F H.The use of chlorophyll fluorescence nomenclature in plant stress physiology[J].PhotosynthesisResearch,1990,25(3):147-150.
[13] GENTY B,BRIANTAIS J M,BAKER N R.The relationship between the quenching of photosynthetic electron transport and quenching of chlorophyll fluorescence[J].BiochimicaetBiophysicaActa,1989,990(1):87-92.
[14] ZHANG SH R(张守仁).A discussion on chlorophyll fluorescence kinetics parameters and their significance[J].ChineseBulletinofBotany(植物学通报),1999,16(4):444-448(in Chinese).
[15] CHEN J M(陈建明),YU X P(俞晓平),CHENG J A(程家安).The application of chlorophyll fluorescence kinetics in the study of physiological responses of plants to environmental stresses[J].ActaAgriculturaeZhejiangensis(浙江农业学报),2006,18(1):51-55(in Chinese).
[16] XING Q ZH(邢庆振),YU S L(郁松林),NIU Y P(牛雅萍),etal.Effects of salt stress on photosynthetic physiology and chlorophyll fluorescence characteristics of grape(Red Globe)seedlings[J].AgriculturalResearchintheAridAreas(干旱地区农业研究),2011,29(3):96-100(in Chinese).
[17] PFUNDEL EE,BEN GHOZLEN N,MEYER S,etal.Investigating UV screening in leaves by two different types of portable UV fluorimeters revealsinvivoscreening by anthocyanins and carotenoids[J].PhotosynthesisResearch,2007,93(3):205-221.
[18] PIETRINI F,IANNELLI MA,MASSACCI A.Anthocyanin accumulation in the illuminated surface of maize leaves enhances protection from photoinhibitory risks at low temperature,without further limitation to photosynthesis[J].Plant,Cell& Environment,2002,25(10):1 251-1 259.
[19] SUN J B(孙景波),SUN G Y(孙广玉),LIU X D(刘晓东),etal.Effects of salt stress on mulberry seedlings growth,leaf water status,and ion distribution in various organs[J].ChineseJouralofAppliedEcology(应用生态学报),2009,20(3):543-548(in Chinese).
[20] WANG D Q(王东清),LI G Q(李国旗),WANG L(王 磊).Daily dynamics of photosynthesis and water physiological characteristics ofApocynumvenetumandA.cannabinumunder drought stress[J].BotanicaBoreali-OccidentaliaSinica(西 北 植 物 学 报),2012,32(6):1 198-1 205(in Chinese).

