植物维生素B6从头合成与代谢转换研究进展
黄龙全,张剑韵
维生素B6(VB6)是一组可相互转换的吡啶衍生物的总称,包括吡哆醇(pyridoxine,PN)、吡哆胺(pyridoxamine,PM)、吡哆醛(pyridoxal,PL)、磷酸吡哆醇(pyridoxine 5′-phosphate,PNP)、磷酸吡哆胺(pyridoxamine 5′-phosphate,PMP)和磷酸吡哆醛(pyridoxal 5′-phosphate,PLP)。其 中,PLP 是140多种细胞酶的辅酶,在生物体内发挥广泛、重要的作用。植物和微生物是自然界VB6的制造者,动物从食物中获得VB6。在植物体内,PLP作为胱硫醚合成酶[1]、氨基环丙烷羧化物合成酶[2]、丝氨酸棕榈酰转移酶[3]、苏氨酸合成酶[4]、胱硫醚裂合酶[5]等的辅酶有详细研究;PLP 也是乙烯、叶绿素和生长素 合 成 所 必 需 的[6-7];PLP 还 涉 及 亚 油 酸 和 淀 粉 的合成[8]。近年来发现VB6也是抗氧化剂,可有效淬灭单线态氧和超氧阴离子自由基[9-10];它作为细胞信号传导的调节分子,对细胞膜上的离子通道具有调节作用[11];它发挥抗逆作用,保护植物免受低温、紫外线、氧化、渗透压等环境胁迫的影响[12-13]。无论是阐明VB6参与调控植物生长发育和环境反应的机理,通过遗传改良提高食源性植物的VB6含量,还是利用VB6的特殊生理功能提高植物的逆境适应能力,都依赖于对VB6代谢的研究。植物VB6代谢包括VB6的从头合成和合成后的代谢转换。本文综述了植物VB6从头合成与代谢转换的研究进展。
1 植物VB6 的从头合成
1.1 自然界存在两种VB6 从头合成途径
至今发现两种VB6从头合成途径(de novo synthetic pathway),两者的底物、产物和作用酶均不相同。首先发现的DXP依赖途径(DXP dependent pathway)在大肠杆菌有详细研究,利用1-脱氧-D-木酮糖-5-磷酸(DXP)和4-磷酸羟基-苏氨酸首先合成PNP,再经PNP氧化酶的作用,转变为PLP后用于细胞代谢过程[14]。
另外一条途径DXP 非依赖途径(DXP independent pathway)于1999年发现。该途径以谷氨酰胺、3-磷酸甘油醛(或磷酸二羟丙酮)和5-磷酸核糖(或5-磷酸核酮糖)为底物直接合成PLP[15-17](图1)。Ehrenshaft等[15]在研究尾孢菌(C.nicotianae)对自身毒素的抗性中发现了涉及VB6代谢的新基因,最初指定为单线态氧抗性基因SOR1,后来鉴定为PDX1。2001年又从尾孢菌鉴定出涉及VB6合成的第2 个基因PDX2[16]。目前已经明确PDX1和PDX2构成PLP合酶复合体(PLP synthase complex),PDX2发挥谷氨酰胺酶的作用,催化从谷氨酰胺产生氨;PDX1发挥闭环蛋白的作用,催化5-磷酸核糖、3-磷酸甘油醛和氨的缩合,完成PLP 的合成[17]。DXP非依赖途径的产物直接用于细胞代谢,生物效率高于DXP依赖途径,是自然界VB6的主要合成途径。DXP 非依赖途径通过谷氨酰胺将VB6和氨基酸代谢联系起来,通过丙糖和戊糖磷酸代谢池又将VB6与细胞能量途径联系起来。
1.2 植物通过DXP非依赖途径从头合成VB6
VB6合成途径作用酶及其编码基因的鉴定是极为重要的一歩。学术界很长时间认为植物通过DXP依赖途径合成VB6,但始终没有找到实验依据。作为植物逆境应答中VB6作用研究的一部分,2005年Denslow 等[18]从烟草鉴定出PDX1 和PDX2同源序列。使用兼并引物的基因扩增获得2个PDX1序列,彼此相差15个碱基,编码相同氨基酸序列,可能是2 个等位基因或者2 个拷贝。PDX2为单拷贝基因,表达也远低于PDX1。多个研究小组从拟南芥也鉴定出PDX1和PDX2同源序列,并开展了更为深入的研究[13,19-23]。目前已经明确植物通过DXP非依赖途径从头合成VB6。
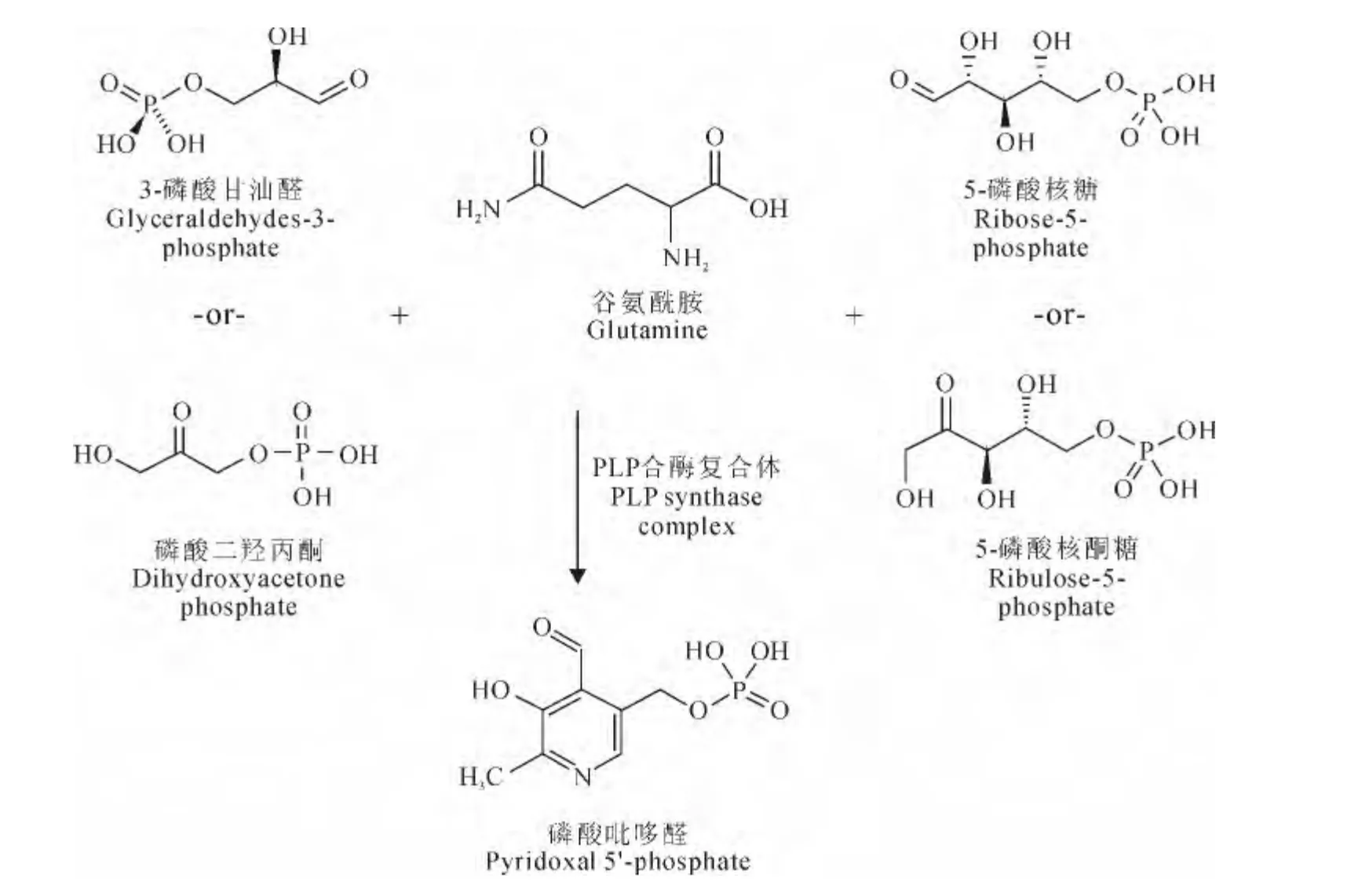
图1 DXP非依赖性维生素B6 合成途径Fig.1 DXP independent vitamin B6synthetic pathway
拟南芥PDX2也是单拷贝基因,位于5号染色体上(At5g60540),基因长度为2 180bp,含有7个外显子,转录长度为768bp,编码255个氨基酸、理论分子量为27 303Da的蛋白。存在3个PDX1同系物,分别命名为AtPDX1.1、AtPDX1.2和AtPDX1.3。PDX1.1(At2g38230)、PDX1.2(At3g16050)和PDX1.3(At5g01410)分别位于2号、3号和5号染色体上。PDX1.1和PDX1.3具有89%的相似性,而与PDX1.2的相似性为60%。拟南芥还存在一个小的不完全拷贝(PDX1.4),其与PDX1.1基因上游序列33%相同,在细胞代谢中可能没有作用。PDX1同系物都没有基因内含子,提示其原核起源。PDX1.1、PDX1.2和PDX1.3的转录长度分别为1 053、1 380和1 297bp。PDX2对拟南芥的生长发育至关重要,突变体胚胎致死[19,23]。因为难以获得PDX2的纯合突变体,所以大量的研究集中 在PDX1同系物上[13,19-22]。其 中PDX1.3 的 转录丰度最高,突变体表型和VB6水平的变化最大,研究也最为详细。
PDX1.1基因沉默植物出现萎黄和根系生长不良,而PDX1.1和PDX1.3基因都沉默植物叶片萎黄畸形,多数死亡,幸存植物的花朵小、未能结籽,提 示PDX1.1 和PDX1.3可能存在功能重叠[21]。Titiz等[20]对PDX1.1 和PDX1.3 基因进行了TDNA 插入突变。pdx1.3突变体的表型与Wagner等的结果非常相似,但pdx1.1突变体的VB6水平没有下降,也不呈现萎黄表型。Titiz等也进行了PDX1.1和PDX1.3双突变,恶化的表型和致命的双突变也预示两基因至少部分功能重叠。但是,2个基因的时空表达存在差异[13,20-21],提示两者也可能具有相对独立的功能,在拟南芥基因组中都有存在的意义。拟南芥PDX1.2的作用还不清楚,基因插入突变体的表型与野生型没有差异[21]。但拟南芥遭遇紫外线和氧化胁迫时PDX1.2转录上调[22],提示PDX1.2可能在胁迫条件下发挥作用。
1.3 植物VB6 的从头合成涉及逆境应答
烟草感染假单胞杆菌后PDX1和PDX2的基因表达下调,而水杨酸和茉莉酮酸甲酯处理可致基因短暂上调[18]。Chen等[13]在分离干旱和盐胁迫响应蛋白互作伴侣的酵母双杂交实验中,首先分离出PDX1.3。植物的根、茎、叶、花和长角果都能检测出PDX1.3的转录,基因的最强表达出现在脉管组织和保卫细胞。pdx1.3突变体的叶绿体和根的生长异常,幼苗的根对盐和甘露醇敏感,提示PDX1.3蛋白涉及对渗透和离子胁迫的生物应答。pdx1.3突变体根部缺乏色氨酸依赖性生长素的合成,这可能是出现短根表型的原因[24]。2006年,Wagner等[21]获得了PDX1.3基因EMS 突变体rsr4-1,突变体的蔗糖响应下降,呈现根生长退化、矮小和退绿叶。突变体的表型可以采用向生长媒体中添加PL 的方法加以恢复,添加PN、PM 或者PLP可部分恢复。
Denslow 等[22]报道了非生物胁迫下拟南芥PLP合酶基因的应答调节。正常状态下,拟南芥PDX1.1和PDX1.3高水平表达,PDX1.2不表达或低水平表达,PDX2中间水平表达。在植物遭遇强光、低温、干旱、紫外线、百草枯和臭氧时,PDX1和PDX2基因都上调。作者进一步分析多种胁迫因子对烟草VB6存在形态的影响,发现PLP 水平不同程度地应答上升,并引起PL 和PN 的相应变化,随后回归对照水平[25]。
2007年Herrero 等[26]在烟草中表达尾孢菌PLP合成酶基因,尝试提高烟草的VB6含量。结果仅有一个株系VB6水平的增加达到显著水平,比野生型和转化对照系高出约17%。然而,转化系烟草内源PDX1和PDX2 基因的表达下降,提示植物VB6的从头合成受到严格调控。2011年,Raschke等[27]在拟南芥过量表达PDX 蛋白,获得了VB6含量显著增加的植株。他们还发现仅能提高PDX1的蛋白表达量,高VB6含量植株的生长期延长,细胞体积增大,对氧化胁迫的抵抗性也增强。
1.4 VB6 从头合成途径的细胞定位
PDX1和PDX2 复合体的细胞定位还存在争议。Tambasco-Studart等报道所有PDX1和PDX2蛋白都定位于细胞溶质[19]。然而,Chen 等[13]把PDX1.3定位于细胞器和膜系统。Denslow 等[21]也报道能够从质膜和细胞核观察到PDX2 蛋白。从SUBA 拟南芥亚细胞定位数据库汇总的亚细胞定位信息看,PDX1和PDX2定位于细胞溶质和细胞器。基于预测程序,PDX1.1、PDX1.3 和PDX2定位于细胞溶质、线粒体和质体,PDX1.2定位于细胞溶质和线粒体。
2 植物VB6 从头合成后的代谢转换
除了VB6的从头合成,细菌和真核生物细胞中还普遍存在一条相似的PLP补救途径,补救途径涉及一系列酶的作用,通过VB6各型的代谢转换使得细胞能够直接利用外源PN、PM 或PL来合成细胞代谢所需要的PLP。补救途径在微生物和哺乳动物有详细研究。虽然PLP是占优势的辅酶型,其他形式的VB6在细胞中通过补救途径也保持动态平衡。
2.1 植物PL激酶
PL激酶(PL kinase,EC 2.7.1.35)在金属阳离子的存在下,利用ATP催化PL、PN 和PM 的5′位醇基磷酸化,生成相应的磷酸酯型。从大肠杆菌发现两种PL 激酶,pdxk 基因编码普通PL 激酶,而pdxy 基因编码的特殊PL 激酶仅以PL 为底物,且活性很低[28-29]。目前,真核生物中仅发现pdxk 基因,而多数原核生物同时具有pdxk和pdxy。
2002、2004和2008年,分别从拟南芥[30]、小麦[31]和油菜[32]克隆出PL 激酶基因。从拟南芥鉴定出的At5g37850与大肠杆菌pdxk 同源,与哺乳动物PL 激酶氨基酸序列的相似性大于40%。At5g37850也称SOS4,其突变体对盐高度敏感。拟南芥SOS4基因在叶、茎、根和花均等表达,根尖高度表达,种子吸水60h后可检测出PL 激酶基因的表达。小麦基因组至少有2个PL 激酶拷贝,在根、芽、穗和花药均有转录。油菜也有2 个PL 激酶拷贝,基因的转录受发育和环境的调节。目前还缺乏采用实验的方法对PL 激酶进行细胞定位,预测结果表示存在于质体和线粒体。
拟南芥SOS4基因突变的研究证明PL 激酶是一个新的盐耐受性决定因子,其突变体sos4 萎黄,与野生型相比植株重量减轻,根部对蔗糖和盐高度敏感,存在NaCl时根的生长严重受损;突变体出乎预料地出现了VB6积累,其中PLP 的增加量最为显著,其次是PN 和PM[33]。PLP 的增加可能是因为从头合成途径基因的上调,因为sos4 突变体PDX 基因的转录量比野生型的高。除了对盐和蔗糖敏感,sos4突变体耐旱而不耐寒。最近发现叶绿体依靠PL激酶维持磷酸酯型VB6水平[34]。
2.2 植物PNP氧化酶
补救途径的另一个重要酶是FMN 依赖性PNP氧化酶(PNP oxidase,EC 1.4.3.5),氧化底物PNP和PMP上的4′位醇基或氨基为醛基,生成PLP。2007年克隆出拟南芥At5g49970基因,编码蛋白由3个部分构成,N 端为叶绿体转运肽,中部为未知功能的Yjef_N 区域,C 端为PNP氧化酶(PDX3)[35]。Sang等[35]在大肠杆菌中表达该基因,通过酶活性分析证明了其功能。拟南芥PNP氧化酶在不同组织中的表达存在差异,受光、热、ABA 和乙烯处理的上调,受干旱和NaCl的下调。生物信息学预测PNP 氧化酶定位于叶绿体,也获得了GFT-AtPPOX 融合实验的支持。Gonzalez等[33]采用对大肠杆菌pdxh 突变体的互补实验,也验证了拟南芥At5g49970的PNP氧化酶功能。他们还对该基因进行了插入突变,2个独立插入突变系氧化酶的活力均下降。pdx3 突变体的VB6总水平下降,而VB6各型与野生型相比较没有显著差异。生长在标准室内环境中的pdx3 突变体比野生型对照矮小。高光照条件下,pdx3 突变体对增强的光照反应迟钝,植株重量无变化,而野生型在强光照条件下生长量增加。突变体对低温、盐与蔗糖引起的渗透压响应与野生型无区别。pdx3 突变体的SOS4以及从头合成途径基因,特别是PDX1.1基因的表达增强。虽然从头合成途径基因的表达增加,但pdx3突变体与野生型或者sos4突变体相比较,PDX1的酶活力下降。2011年Sang等[36]又报道PNP 氧化酶在细胞溶质和叶绿体中将PNP 和PMP 氧化为PLP。
2.3 植物PL还原酶
PL还原酶(PL reductase,EC 1.1.1.65)也称为PN 脱氢酶,利用NADPH 将PL 还原成PN,反应在体外是可逆的,但在体内逆反应几乎不可能发生。2004年,Morita等[37]发现裂殖酵母PL 还原酶基因突变体能够在缺乏VB6的合成培养基上生长,认为该酶对酵母生存而言是非必要的,仅涉及PL转变为PN 后的细胞排出。
2011年,采用序列同源比对的方法从拟南芥鉴定出PL 还原酶(PLR1),在酵母PL 还原酶缺失突变体中表达AtPLR1 编码区域,验证了该酶催化NADPH 依赖性PL 的 还 原 反 应[38]。采 用T-DNA插入突变的研究发现,plr1突变体VB6从头合成途径基因的表达水平变化不大,而补救途径作用酶PDX3和SOS4 基因的表达发生显著变化。并且,pdx3和sos4突变体AtPLR1 基因的表达也上调。高效液相色谱的分析结果显示,2 个plr1 突变体VB6总水平下降,其中PL、PLP、PM 和PMP 水平显著下降,而PN 和PNP 没有显著变化。突变体PL水平下降和PN 水平没有变化是很意外的,提示AtPLR1基因的表达产物可能不是唯一的PL 还原反应的作用酶。突变体的根系生长正常,但植株明显小于野生型;对低温和高光照的抵抗性与野生型没有差异,但明显受NaCl和甘露醇的抑制,提示PL还原酶也可能涉及植物对渗透胁迫的抵抗性。
植物的叶际是一个复杂的生态系统,具有丰富的微生物多样性。这些微生物改变植物体表微环境和参与物质循环。VB6是水溶性维生素,其跨膜转移已有广泛的研究,很早就明确只有非磷酸酯型VB6能够穿越细胞膜。植物即可以从环境中吸收VB6,过量VB6也向环境释放[39]。我们发现叶际微生物在烟草叶面可以将来源于叶组织的PL 还原为PN,提示植物PL 的还原可能还存在叶际微生物的作用[40]。
2.4 烟草VB6 的代谢转换与调控
作为重要经济作物和模式植物,烟草VB6从头合成途径最早被阐明。我们以组培烟草为材料构建无菌实验模型,解析了植物体内VB6的代谢转换,获得了代谢转换的重要调控信息。采用底物(PL、PM 和PN)饲喂和应答分析的研究发现,烟草叶片组织中PLP保持稳定、PL 水平受到控制,PL 还原为PN 以及PM 与PL的相互转化是VB6代谢转换的重要内容[39]。在建立以HPLC 检测为基础的VB6代谢酶活性检测方法的基础上,从烟草叶片组织鉴定出PL激酶、PNP氧化酶、PL还原酶,以及酶促PM-PL转换和PLP 水解脱磷酸反应,在体外最适反应条件下,叶片组织粗提液中这些酶的催化活力分别为0.15、0.10、0.08、0.64和23.08nmol·min-1·mg-1,在代谢酶活力水平上探讨了植物体内VB6的代谢转换[41]。我们的研究结果提示PLP→PL→PN 是植物(烟草)体内VB6从头合成后代谢转换的主体流向,PL 激酶和PNP氧化酶构成的PLP补救合成以及酶促PM 和PL 的相互转换是VB6主体代谢的补充(图2)。
2.5 烟草PLP磷酸酶的初步鉴定
PLP的水解在动物和微生物有详细研究,受特异和非特异性磷酸酶的作用。碱性磷酸酶涉及维持细胞外PLP浓度的稳定,而酸性磷酸酶涉及细胞内PLP浓度的稳定。1992年从人红细胞纯化出特异性PLP磷酸酶[42],2003年从人脑克隆出PLP 磷酸酶基因[43],从老鼠组织cDNA中也克隆出PLP 磷酸酶基因。我们以PLP为底物,从烟草纯化出水解PLP、PMP和PNP的磷酸酶。该酶为二聚体结构、分子量约为50kD,是一个新的非特异性酸性磷酸酶[44]。植物体内是否存在特异性PLP 磷酸酶还有待进一步的研究。
2.6 烟草PL和PM 相互转换作用酶的初步鉴定
很早就发现某些生物体内存在PL 和PM 的相互转换。从大肠杆菌和兔肝纯化出PM-草酰乙酸转氨酶,该酶可逆性地催化PM 和草酰乙酸、PL 和天冬氨酸之间的转氨反应,但是最终被认为是一个未知转氨酶的脱辅基形式[45]。因为该文作者发现从猪心纯化出的谷氨酸-草酰乙酸转氨酶在脱去辅酶PLP或者PMP后,也能够催化PM 和酮酸之间的转氨反应。PM-丙酮酸转氨酶(PM-pyruvate aminotransferase,EC 2.6.1.30)和PMP-α-酮戊二酸转氨酶(PMP-α-ketoglutarateaminotranferase,EC2.6.1.54)是目前已经明确和仅有的PLP非依赖性转氨酶,特异性地以VB6为底物而非辅酶,参与VB6代谢转换[46-47]。我们在发现烟草体内存在PM 和PL相互转换的基础上,进一步纯化出其作用酶。结果表示烟草体内存在PM-丙酮酸转氨酶,对PM 和PL的相互转换发挥主导作用,同时也明确烟草的谷氨酸-草酰乙酸转氨酶在脱去辅酶后,能够催化PM 和草酰乙酸或者α-酮戊二酸之间的转氨反应[48]。

图2 烟草体内维生素B6 代谢转换示意图[39]Fig.2 Postulated interconversions of different vitamin B6forms in tobacco plants[39]Thick arrow shows the predominant VB6 metabolic flux
3 展 望
植物合成的VB6对植物自身的生长发育和逆境适应,以及人和动物营养具有重要意义。植物VB6从头合成途径已经明确,研究积累也较丰富,而代谢转换尚未明了,还有许多不明之处。PN 葡糖苷(PN glucoside)是植物体内特有的VB6衍生物[49],可能受UDP-葡萄糖依赖性葡糖基转移酶(UDP-glucose-dependentglucosyltransferase)的 作用由PN 生成。植物体内水解PLP、PMP 和PNP的磷酸酶、PM-丙酮酸转氨酶以及催化生成PN 葡糖苷的葡糖基转移酶,都还需要在基因水平上加以明确。虽然从拟南芥鉴定出PL 还原酶基因,但T-DNA插入突变的研究结果显示该基因的表达产物不是唯一的作用酶[37]。植物体内PL 的还原和PN 的形成还需要更加深入的研究。
同时,从植物检出4-吡哆酸(4-pyridoxic acid)[50],尽管其起源和去向还是未解之谜,但提出了VB6的异化问题。因为4-吡哆酸在哺乳动物是排泄型VB6,在微生物是VB6降解途径的一个中间产物。至今从细菌发现两种VB6降解途径,PM-丙酮酸转氨酶是降解途径Ⅰ的重要作用酶[51]。从烟草分离出PM-丙酮酸转氨酶,暗示植物体内可能存在VB6降解途径Ⅰ。对植物VB6降解的研究具有重要意义,是VB6代谢平衡机制的重要内容,还将为今后通过基因工程技术提高食源性植物的VB6含量提供靶标基因。
另外,植物的质体、线粒体和过氧化物酶体等都存在重要的PLP依赖酶,这些酶的活力受制于细胞器内PLP 的平衡供给。PLP 不能通过质膜,并且PLP的4′位醛基非常活泼,极易与伯胺和仲胺形成醛亚胺结构。PLP与非VB6蛋白的非特异性结合将导致生理功能的紊乱。因此,植物VB6从头合成与代谢转换的调控机制也是亟待研究的重要科学问题。
[1] RAVANEL S,DROUX M,DOUCE R.Methionine biosynthesis in higher plants.I.Purification and characterization of cystathionine gamma-synthase from spinach chloroplasts[J].Arch.Biochem.Biophys.,1995,316:572-584.
[2] ZHOU H,WANG HW,ZHU K,et al.The multiple roles of conserved arginine 286of 1-aminocyclopropane-1-carboxylate synthase.Coenzyme binding,substrate binding,and beyond[J].Plant Physiol.,1999,121:913-919.
[3] TAMUR K,NISHIURA H,MORI J,et al.Cloning and characterization of a cDNA encoding serine palmitoyl transferase in Arabidopsis thaliana[J].Biochem.Soc.Trans.,2000,28:745-747.
[4] THOMAZEAU K,CURIEN G,DUMAS R,et al.Crystal structure of threonine synthase from Arabidopsis thaliana[J].Protein Sci.,2001,10:638-648.
[5] BREITINGER U,CLAUSEN T,EHLERT S,et al.The three dimensional structure of cystathionine beta-lyase from Arabidopsis and its substrate specificity[J].Plant Physiol.,2001,126:631-642.
[6] TAO Y,FERRER JL,LJUNG K,et al.Rapid synthesis of auxin via a new tryptophan-dependent pathway is required for shade avoidance in plants[J].Cell,2008,133:164-176.
[7] VAVILIN DV,VERMAAS WF.Regulation of the tetrapyrrole biosynthetic pathway leading to heme and chlorophyll in plants and cyanobacteria[J].Physiol.Plant,2002,115:9-24.
[8] MOONEY S,HELLMANN H.Vitamin B6:killing two birds with one stone?[J].Phytochem.,2010,71:495-501.
[9] PREISS J,BALL K,HUTNEY J,et al.Regulatory mechanisms involved in the biosynthesis of starch[J].Pure Appl.Chem.,1991,63:535-544.
[10] BILSKI P,LI MY,EHRENSHAFT M,et al.Vitamin B6(pyridoxine)and its derivatives are efficient singlet oxygen quenchers and potential fungal antioxidants[J].Photochem Photobiol.,2000,71:129-134.
[11] PALMIERI L,AGRIMI G,RUNSWICK MJ,et al.Identification in Saccharomyces cerevisiae of two isoforms of a novel mitochondrial transporter for 2-oxoadipate and 2-oxoglutarate[J].J.Biol.Chem.,2001,276:1 916-1 922.
[12] SHI H,XIONG L,STEVENSON B,et al.The Arabidopsis salt overly sensitive 4mutants uncover a critical role for vitamin B6in plant salt tolerance[J].Plant Cell,2002,14:575-588.
[13] CHEN H,XIONG L.Pyridoxine is required for postembryonic root development and tolerance to osmotic and oxidative stresses[J].Plant J.,2005,44:396-408.
[14] MITTENHUBER G.Phylogenetic analyses and comparative genomics of vitamin B6(pyridoxine)and pyridoxal phosphate biosynthesis pathways[J].J.Mol.Microb.Biotech.,2001,3:1-20.
[15] EHRENSHAFT M,BILSKI P,LI MY,et al.A highly conserved sequence is a novel gene involved in de novo vitamin B6biosynthesis[J].Proc.Natl.Acad.Sci.USA,1999,96:9 374-9 378.
[16] EHRESHAFT M,DAUB ME.Isolation of PDX2,a second novel gene in thepyridoxine biosynthesis pathway of eukaryotes,archaebacteria,and a subsetof eubacteria[J].J.Bacteriol.,2001,183:3 383-3 390.
[17] FITZPATRICK TB,MOCCAND C,ROUX C.Vitamin B6biosynthesis:charting the mechanistic landscape[J].Chem.Biochem.,2010,11:1 185-1 193.
[18] DENSLOW S,WALLS A,DAUB M.Regulation of biosynthetic genes andantioxidant properties of vitamin B6vitamers during plant defense responses[J].Physiol.Molec.Plant Pathol.,2005,66:244-255.
[19] TAMBASCO-Studart M,TITIZ O,RASCHLE T,et al.Vitamin B6biosynthesis in higher plants[J].Proc.Natl.Acad.Sci.USA,2005,102:13 687-13 692.
[20] TITIZ O,TAMBASCO-Studart M,WARZYCH E,et al.PDX1is essential for vitamin B6biosynthesis,development and stress tolerance in Arabidopsis[J].Plant J.,2006,48:933-946.
[21] WAGNER S,BERNHARDT A,LEUENDORF JE,et al.Analysis of the Arabidopsisrsr4-1/pdx1-3mutant reveals the critical functionof the PDX1protein family in metabolism,development,and vitamin B6biosynthesis[J].Plant Cell,2006,18:1 722-1 735.
[22] DENSLOW SA,RUESCHHOFF EE,DAUB ME.Regulation of the Arabidopsisthalianavitamin B6biosynthesis genes by abiotic stress[J].Plant PhysiolBiochem.,2007,45:152-161.
[23] TANBASCO-Studart M,TEWS I,AMRHEIN N,et al.Functionalanalysis of PDX2fromArabidopsis,aglutaminase involved in vitamin B6biosynthesis[J].Plant Physiol.,2007,144:915-925.
[24] CHEN H,XIONG L.The short-rooted vitamin B6-deficient mutant pdx1hasimpaired local auxin biosynthesis[J].Planta,2009,229:1 303-1 310.
[25] HUANG SH,ZHANG JY,WANG LH,et al.Effect of abiotic stress on the abundance of different vitamin B6vitamers in tobacco plants[J].Plant Physiol.Biochem.,2013,66:63-67.
[26] HERRERO S,DAUB M.Genetic manipulation of vitamin B6biosynthesis intobacco and fungi uncovers limitations to up-regulation of the pathway[J].Plant Sci.,2007,172:609-620.
[27] RASCHKE M,BOYCHEVA S,CREVECOEUR M,et al.Enhanced levelsof vitamin B6increase aerial organ size and positively affect stresstolerance in Arabidopsis[J].Plant J.,2011,66:414-432.
[28] YANG Y,ZHAO G,WINKIER ME.Identification of the pdxK gene that encodespyridoxine(vitamin B6)kinase in Escherichia coli K-12[J].FEMS Microbiol.Lett.,1996,141:89-95.
[29] YANG Y,TSUI HC,MAN TK,et al.Identification and function of the pdxYgene,which encodes a novel pyridoxal kinase involved in the salvage pathway of pyridoxal 5′-phosphate biosynthesis in Escherichia coli K-12[J].J.Bacteriol.,1998,180:1 814-1 821.
[30] LUM HK,KWOK F,LO S.Cloning and characterization of Arabidopsis thaliana pyridoxal kinase[J].Planta,2002,215:870-879.
[31] WANG H,LIU D,LIU C,et al.The pyridoxal kinase gene tapdxkfrom wheat complements vitamin B6synthesis-defective Escherichia coli[J].J.Plant Physiol.,2004,161:1 053-1 060.
[32] YU SW,LUO LJ.Expression analysis of a novel pyridoxal kinase messenger RNA splice variant,PLK,in oil rape suffering abiotic stress and phytohormones[J].Acta Biochim.Biophys.Sin.,2008,40:1 005-1 014.
[33] GONZALEZ E,DANEHOWER D,DAUB ME.Vitamer levels,stress response,enzyme activity,and gene regulation of Arabidopsis lines mutant in the pyridoxine/pyridoxamine 5′-phosphate oxidase(PDX3)and the pyridoxal kinase(SOS4)genes involved in the vitamin B6salvage pathway[J].Plant Physiol.,2007,145:985-996.
[34] RUESCHHOFF EE,GILLIKIN JW,SEDEROFF HW,et al.The SOS4 pyridoxal kinase is required for maintenance of vitamin B6mediated processes in chloroplasts[J].Plant Physiol.Biochem.,2013,83:281-291.
[35] SANG Y,BARBOSA J M,WU H,et al.Identification of a pyridoxine(pyridoxamine)5′-phosphate oxidase from Arabidopsis thaliana[J].FEBS Letters,2007,581:344-348.
[36] SANG Y,Locy B,GOERTZEN,L R,et al.Expression,in vivolocalization and phylogenetic analysis of a pyridoxine 5′-phosphate oxidase in Arabidopsis thaliana[J].Plant Physiol.Biochem.,2011,49:88-95.
[37] MORITA T,TAKEGAWA K,YAGI T.Disruption of the plr1tgene encodingpyridoxal reductase of Schizosaccharomyces pombe[J].J.Biochem.,2004,135:225-230.
[38] HERREROS,GONZALEZE,GILLIKINJW,et al.Identification and characterization of a pyridoxal reductase involved in the vitamin B6salvage pathway in Arabidopsis[J].Plant Molecular Biology,2011,76:157-169.
[39] HUANG SH,ZENG HB,ZHANG JY,et al.Interconversions of different vitamin B6forms in tobacco plants[J].Phytochem.,2011,72:2 124-2 129.
[40] HUANG SH,ZHANG JY,TAO Z,et al.Enzymatic conversion from pyridoxal to pyridoxine caused by microorganisms within tobacco phyllosphere[J].Plant Physiol.Biochem.,2014,85:9-13.
[41] HUANG SH,ZENG HB,ZHANG JY,et al.Characterization of enzymes involved in the interconversions of different vitamin B6forms in tobacco plants[J].Plant Physiol.Biochem.,2011,49:1 299-1 305.
[42] FONDA ML.Purification and characterization of vitamin B6-phosphate phosphatase from human erythrocytes[J].J.Biol.Chem.,1992,267:15 978-15 983.
[43] JANG YM,KIM DW,KANG TC,et al.Human pyridoxal phosphatase.Molecular cloning,functionalexpression,and tissue distribution[J].J.Biol.Chem.,2003,278:50 040-50 046.
[44] HUANG S H,ZHANG J Y,MA YP,et al.Characterization of an acid phosphatase responsible for hydrolysis of pyridoxal 5′-phosphate in tobacco plants[J].Plant Physiol.Biochem.,2012,57:114-119.
[45] WADA H,SNELL EE.Enzymatic transamination of pyridoxamine:I.Withoxaloacetate and α-ketoglutarate[J].J.Biol.Chem.,1962,237:127-132.
[46] YOSHIKANE Y,YOKOCHI N,OHNISHI K,et al.Molecular cloning,expression and characterization of pyridoxamine-pyruvate transaminase[J].Biochem J.,2006,396:499-507.
[47] TANI Y,UKITA M,OGATA K.Studies on vitamin B6metabolism in microorganisms:part X.Further purification and characterization of pyridoxamine5′-phosphate-alpha-ketoglutarate transaminase from Clostridium kainantoi[J].Agric.Biol.Chem.,1972,36:181-188.
[48] HUANG SH,ZHANG JY.,WU M,et al.Enzymatic transamination of pyridoxamine in tobacco plants[J].Plant Sci.,2013,212:55-59.
[49] GREGORY JF,INK SL.Identification and quantification of pyridoxine-β-glucoside as a major form of vitamin B6in plant-derivedfoods[J].J.Agr.Food Chem.,1987,35:76-82.
[50] SAMPSON DA,EOFF LA,YAN XL,et al.Analysis of freeand glycosylated vitamin B6in wheat by high-performance liquidchromatography[J].Cereal Chemistry,1995,72:217-221.
[51] GE F,YOKOSHI N,YOSHIKANE Y,et al.Gene identification and characterization of the pyridoxine degradative enzyme 4-pyridoxic acid dehydrogenase fromthe nitrogen-fixing symbiotic bacterium Mesorhizobium Loti MAFF303099[J].J.Biochem.,2008,143:603-609.

