雄全异株植物白牛槭功能性状与碳素含量关联性研究
朱燕艳,王 娟*,赵秀海,邳田辉,张忠辉,赵珊珊
(1 北京林业大学 森林资源与生态系统过程北京市重点实验室,北京100083;2 吉林省蛟河林业试验区管理局,吉林蛟河132517;3 吉林省林业科学研究院,长春130033)
植物在复杂的自然环境条件下长期生存,逐渐演化出各种各样的繁育系统,如:雌雄异株、雌雄同株、雄全同株、雌全同株、雄全异株、雌全异株等。目前有关雌雄异株植物性比、资源分配及性别二态性方面的研究较多[1-3],而针对雄全异株植物的相关研究相对较少[4-5]。雄全异株植物是被子植物中极为罕见的一类繁育系统,其植株可分为雄株和两性植株两种类型。雄株只产生雄花,两性植株则可产生两性花或雄花和雌花两种单性花[6]。目前,对雄全异株研究的方向主要集中在繁育系统进化及性比方面。在繁育系统进化方面,雄全异株繁育系统对雌雄异株进化的潜在意义一直是生态学家研究的热点问题[7],雌雄异株是由雄全异株进化而来。雄全异株植物十分稀少,绝大多数已经确定的雄全异株植物并不是完全意义上的雄全异株植物,从功能上来看属于雌雄异株植物,只是雌性个体在形态学上表现为雌雄同花[8]。在性比方面,Liston等[9]研究表明,雄全异株草本植物四数木(Datiscaglomerata)的两性植株个数远远大于雄株,性别比例明显偏离1∶1,而Lepart等[10]研究显示法国南部的一种木犀科风媒灌木的性比接近1∶1,说明不同地域不同物种的雄全异株植物其性别比例差异显著。
植物功能性状反映了植物对生长环境的响应和适应,是生态学研究的热点之一[11-13]。其具有完整的分类体系,主要包括枝干性状、地下性状和叶性状[14]。植物各功能性状间的权衡和组合反映了植物对环境的适应策略、群落物种的分布状况和生态系统的进化过程[15]。这些权衡关系主要体现在叶性状、枝性状、根性状和种子性状之间[16],其中植物叶性状与生物量和碳分配之间的权衡最为重要,反映了植物在特定环境下对环境资源的获得及其利用。植物性状种类繁多,比叶面积是最重要的植物叶性状之一,反映了一定干物质投资所展开的捕光表面积数量[17]。比叶面积与植物的光拦截效率直接相关,表达了植物的碳获取策略,对植物的相对生长和生存策略都具有重要影响[18-19]。叶干物质含量反映了植物的资源获取能力[20],是在资源利用分类轴上定位植物种类的最佳变量[21],也是量化植物功能的最佳性状,可代替相对生长速率等硬性状,用于大尺度的监测和研究[22],并且枝干物质含量、叶干物质含量更易于测定,具有很强的可操作性。
碳元素是构成植物体内干物质最主要的元素[23],在植物生长和各种生理调节机能中发挥着重要作用。从物质生产角度来看,占植物体干重90%以上的有机物质都是通过碳同化形成的[24]。通常,人们认为碳可以被用来作为适宜的衡量植物资源分配的“通货”,并假定植物行使功能所需的其它重要资源可以由碳以蔗糖的形式去“购买”[25]。所以,大多数研究都将干重作为“通货”来衡量植物的资源分配及权衡关系[26]。
目前,植物功能性状研究多探讨成年植株在一个特定时间(如茎叶完全发育成熟后)的功能性状之间的关系,是一个相对的“静态变量”,而忽略了在植株个体和构件单元不同发育时期植物功能性状的动态变化[27]。并且,对植物功能性状的研究多集中在种群、群落等尺度上,而研究的内容多集中在各个性状之间内部的关联性以及影响各性状的气候、地理、人为干扰等因素[28-29]方面。关于雄全异株繁育系统植物的功能性状特征,以及与碳元素之间的关联性方面的研究还未见报道。本研究以雄全异株植物白牛槭为对象,研究了不同花果发育期白牛槭两性植株与雄株的功能性状和碳元素含量的动态特征,以及白牛槭的枝叶干物质含量与碳元素含量之间的关联性。以期从功能性状与碳元素含量的角度探讨白牛槭不同性别植株是否会由于面临不同的繁殖和生长压力,而在资源获取能力、养分保持能力等方面存在性别间的差异,以及在营养生长和繁殖生长之间是否存在权衡关系,为进一步探讨白牛槭生长状况及适应环境的能力奠定基础。
1 研究区概况与研究方法
1.1 研究区概况
研究区位于吉林省蛟河林业实验管理局,地理位置:43°57.524′~43°58.042′N,127°44.111′~127°44.667′E,海拔459~517m。该地区属于受季风影响的温带大陆性山地气候,年均气温为3.8℃,最热月7月日均温为21.7℃,最冷月1月日均温为-18.6 ℃,年均降水量为695.9mm。土壤为山地暗棕色森林土,土层厚度20~100cm。植被类型属于典型的针阔叶混交林,主要树种包括:水曲柳(Fraxinusmandshurica)、鱼鳞云杉(Piceajezoensis)、山荆子(Malusbaccata)、白牛槭(Acermandshuricum)、春榆(Ulmusjaponica)、稠李(Padus racemosa)、白桦(Betulaplatyphylla)、色木槭(Acermono)、紫椴(Tiliaamurensis)、蒙古栎(Quercus mongolica)、裂叶榆(Ulmuslaciniata)、枫桦(Betulacostata)、黄檗(Phellodendronamurense)、糠椴(Tiliamandshurica)、青楷槭(Acertegmentosum)、山杨(Populusdavidiana)、红松(Pinuskoraiensis)、鼠李(Rhamnusdavurica)等。
1.2 研究方法
2014年在研究区内进行雄全异株植物的定位观测研究。研究对象白牛槭为典型雄全异株植物,植株性别(两性植株和雄株)在盛花期根据花结构加以判断,整株树上只有雄花的为雄株,既有雄花又有雌花或既有两性花又有雄花的为两性植株。由于白牛槭开始繁育的年龄较大,因此,本研究选取的植株样本胸径全部≥25cm,是具有繁殖功能的成年个体。本研究选取两性植株8株,平均胸径31.4cm,雄株6株,平均胸径28.5cm 为观测对象,并于盛花期(5月中旬),果实膨大期(8月中旬)以及果实成熟期(10月上旬)3个不同花果发育期爬树进行采样。在每个观测期内分别在不同树冠位置(上、中、下3层)收集叶片、枝条样品各500g;从中选取完整成熟叶片10片,利用惠普G3110 扫描仪扫描以计算叶面积。在盛花期和果实膨大期分别采集花和果实。将所有样品带回实验室后,置于烘箱内于105 ℃杀青30min后,在80 ℃下烘干至恒重、粉碎、过60目筛,装袋储于真空干燥器中用于碳含量测定。样品碳含量采用重铬酸钾容量法测定。植物枝叶功能性状指标比叶面积(SLA)、叶干物质含量(LDMC)和枝干物种含量(BDMC)计算方式如下:SLA=叶面积(m2)/叶片干重(kg);LDMC=叶片干重(g)/叶片饱和鲜重(kg);BDMC=枝条干重(g)/枝条饱和鲜重(kg)。
利用单因素方差分析检验性别和花果发育期对白牛槭枝叶功能性状特征的影响;利用Pearson相关系数检验不同枝叶功能性状之间的关系;采用线性回归分析方法检验枝叶碳元素含量与枝叶干物质含量之间的关联性。
2 结果与分析
2.1 枝叶功能性状的性别相关性
单因素方差分析(表1)显示,同一花果发育期内,除了果实膨大期两性植株与雄株的叶干物质含量具有显著差异外,其他2个花果发育期内两性植株与雄株的比叶面积(SLA)、叶干物质含量(LDMC)、枝干物种含量(BDMC)均无显著差异;白牛槭枝叶功能性状在不同花果发育期(盛花期、果实膨大期、果实成熟期)间差异显著,两性植株与雄株的LDMC、BDMC均随花果发育期呈上升趋势,并在成熟期达到最大;SLA则呈先减小后增大的趋势,SLA在果实膨大期最小;两性植株盛花期与果实膨大期的LDMC差异显著,果实膨大期和成熟期的SLA差异显著,而雄株并没有存在这样的显著差异(表1)。
白牛槭两性植株和雄株枝叶功能性状Pearson相关性分析表明,两性植株的LDMC与BDMC呈极显著正相关,雄株的LDMC与BDMC仅呈显著正相关(表2)。综上,两性植株的繁殖和营养活动具有更加明显的阶段性,从枝叶的联系紧密度程度来看两性植株与雄株相比具有更加系统性的资源整合能力。
2.2 枝叶碳含量的性别相关性
图1显示,同一花果发育期(盛花期、果实膨大期和果实成熟期)内,两性植株与雄株的叶碳、枝碳含量均无显著差异;不同花果发育期间,盛花期两性植株和雄株叶片碳含量显著低于果实膨大期和果实成熟期,果实膨大期两性植株的叶碳含量与成熟期无显著差异;除了盛花期雄株枝碳含量与果实膨大期无显著差异外,两性植株和雄株枝碳含量在不同花果发育期差异显著,大小顺序为:盛花期<果实膨大期<果实成熟期。说明白牛槭两性植株与雄株的繁殖和营养生长活动具有明显阶段性,导致叶片、枝条中累积的碳元素含量具有显著差异。
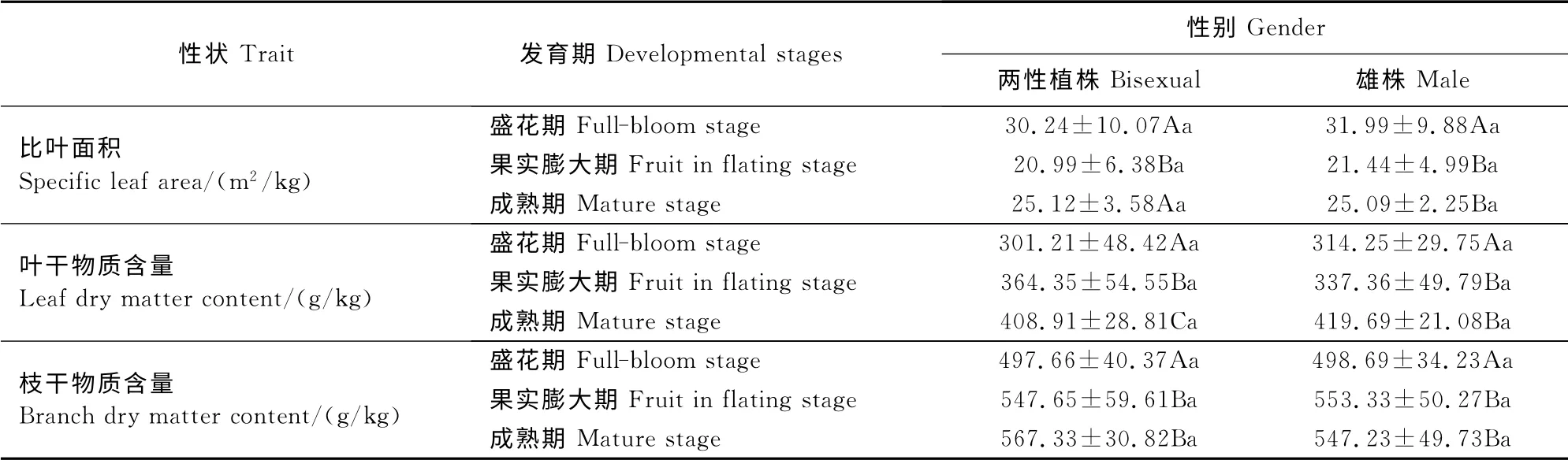
表1 不同花果发育期白牛槭枝叶功能性状的性别差异Table1 Functional traits for different genders of A.mandshuricumin different flower and fruit developmental stages

表2 白牛槭两性植株与雄株枝叶功能性状间的Pearson相关性分析Table2 Pearson analysis for branch and leaf functional traits for different genders of A.mandshuricum

图1 不同花果发育期白牛槭两性植株与雄株的枝叶碳含量变化特征Fig.1 Carbon contents of leaf and branch for different genders of A.mandshuricumbetween different flower and fruit developmental stages

图2 白牛槭植株枝叶碳含量与枝叶干物质含量的相关性Fig.2 The relationship between branch,leaf carbon content and branch dry matter content,leaf dry matter content of A.mandshuricum
2.3 枝叶功能性状与碳含量关联性
图2显示,白牛槭两性植株枝碳、叶碳含量分别与叶干物质含量和枝干物质含量呈极显著正相关,只有叶碳含量与枝干物质含量呈显著正相关。雄株只有叶碳含量与叶干物质含量呈显著正相关外,其他各变量之间都不存在显著相关性(图2)。这表明白牛槭两性植株在繁殖压力的作用下,其养分制造及传输系统具有高度的一致性,而雄株因没有繁殖压力,其养分制造及传输系统较两性植株而言则不具有明显的关联性。
3 讨 论
叶干物质含量反映了植物体内养分的保持能力[30],叶干物质含量大表明植株体内养分保持能力较强。白牛槭两性植株与雄株虽然在果实成熟期所累积的总叶干物质含量相当,但在果实膨大期二者叶干物质含量存在显著差异,且两性植株的叶干物质含量(364.35±54.55)显著大于雄株(337.36±49.79),表明在果实膨大期两性植株体内养分保持能力显著大于雄株。这可能是因为两性植株在果实膨大期不仅要进行营养生长,还要有足够的养分以促进果实生长,才能保证其繁殖活动的顺利完成。具有较强的养分保持能力也是两性植株为适应繁殖压力植株机体做出的相应的养分策略。比叶面积与植物的生长状况和生存策略有着密切的联系,综合反映了植物获取资源的能力以及对不同生境的适应对策[31]。同时,比叶面积能够反映植物获取环境资源的能力,比叶面积低的植物能更好地适应相对贫瘠与干旱的环境,而比叶面积高的植物则体内营养的保持能力较强[17]。另有研究表明比叶面积多与干物质含量呈明显负相关关系,比叶面积较大的植物,其叶干物质含量通常较小[32-34]。本研究结果表明不论两性植株还是雄株其比叶面积与干物质含量都不存在显著负相关关系。这可能是与所选取白牛槭大小有关,本研究所选白牛槭是高大乔木,叶片在多年的生长过程中与所在生长环境(如光照、水分、温度等)相互影响已经进化成最能适应环境的叶面积大小,叶片的可塑能力可能变弱,Strauss-debenedetti S等[35]认为植物适应生境在时间和空间异质性上的一种重要机制就是叶片的这种可塑性。两性植株与雄株的叶面积特性在漫长的生长过程中已经进化成为其适应环境的重要因子。
达尔文[36]在早期的观察中发现减少对一种繁殖功能的投入,并把这减少的部分分配给另一性功能时,这种减少就得到了补偿。这种分配权衡理论后来被进一步研究阐述,Lloyd[37]和Charnov等[38]认为植物可利用的资源总量肯定是有限的,投入到某一功能(性状)的资源量增加必然会降低它投入到其它功能的资源量,即在植物的不同功能(生活史性状)之间存在着“此消彼长”的权衡关系。在本研究中,两性植株除了进行营养生长以外,还要进行繁殖生长,盛花期开出大量的花,果实膨大期要供应充足养分以确保果实成熟,完成种子生长,那么,两性植株会不会因为其繁殖生长而降低了营养生长,从本研究的初步结果来看,两性植株并没有因为其繁殖而降低了对生长的投入,两性植株似乎存在着获取资源的补偿机制,以同时满足营养生长和繁殖生长,具体表现为:两性植株盛花期的枝碳含量与果实膨大期差异显著,雄株在这两个生长发育期的枝碳含量差异不显著;两性植株的叶干物质含量与枝干物质含量呈极显著正相关,而雄株呈显著正相关,这说明两性植株较雄株枝叶联系更加紧密;两性植株叶碳枝碳含量与干物质含量有显著的线性关系,而雄株仅叶碳含量与叶干物质含量呈显著相关;果实膨大期两性植株的叶干物质含量显著大于雄株,表明在果实膨大期两性植株体内养分保持能力显著大于雄株;并且在成熟期两性植株和雄株制造的枝干物质含量和叶干物质含量以及碳含量都没有显著差异,说明两性植株与雄株在生长期结束时蓄积在叶片、枝条中的总营养物质含量没有差异,两性植株并未因繁殖而降低了养分的存储。这些都说明了两性植株并没有因繁殖结果而降低了其营养生长,并且较雄株来说两性植株枝条和叶片联系性更加紧密,整个生长机体更加具有系统性,这些都是在繁殖压力下两性植株做出的适应环境的表现,并以此来补偿繁殖所消耗的养分,进一步表明两性植株在获取养分方面存在着某种补偿机制。有关雌雄异株植物繁殖与营养分配策略的研证明了补偿机制存在这一点。Delph L F等[39]认为雌花萼固定的碳含量远大于雄花,甚至雌树的花和果等繁殖器官也可以进行光合作用,制造有机养分以对繁殖所投入的资源做出补偿[40]。
但是,在本研究中所选白牛槭属于高大乔木,对其操作本身难度较大,要具体的从植株水平探讨两性植株和雄株繁殖和营养之间是否存在权衡关系更具有一定的调查难度。并且有关自然观察数据和短期的实验数据都存在着局限性,可能揭示不出实际存在的营养与繁殖的权衡关系;另外,微生境的差异也会造成白牛槭资源分配的差异。
[2] HESSE E,PANNELL J R.Sexual dimorphism in a dioecious population of the wind-pollinated herbMercurialisannua:the interactive effects of resource availability and competition[J].AnnalsofBotany,2011,107(6):1 039-1 045.
[3] SCHMIDT J P.Sex ratio and spatial pattern of males and females in the dioecious sandhill shrub,Ceratiolaericoides(Empetraceae)Michx[J].PlantEcology,2008,196(2):281-288.
[4] CHARLESWORTH D.Androdioecy and the evolution of dioecy[J].BiologicalJournaloftheLinneanSociety,1984,22(4):333-348.
[5] YAMPOLSKY C.Distribution of Sex Forms in the Phanerogamic Flora[M].BibliothecaGenetica,1922,3:1-62.
[6] LANDRY C L,RATHCKE B J.Do inbreeding depression and relative male fitness explain the maintenance of androdioecy in white mangrove,Lagunculariaracemosa(Combretaceae)?[J].NewPhytologist,2007,176(4):891-901.
[7] LLOYD D G.The maintenance of gynodioecy and androdioecy in angiosperms[J].Genetica,1975,45:325-339.
[8] CHARLESWORTH D.Androdioecy and the evolution of dioecy[J].BiologicalJournaloftheLinneanSociety,1984,23(4):333-348.
[9] LISTON A,RIESEBERG L H,ELIAS T S.Functional androdioecy in the flowering plantDatiscaglomerata[J].Nature,1990,343:641-642
[10] LEPART J,DOMMÉE B.IsPhillyreaangustifoliaL.(Oleaceae)an androdioecious species?[J].BotanicalJournaloftheLinneanSociety,1992,108(4):375-387.
[11] ALBERT C H,THUILLER W,YOCCOZ N G,etal.Intraspecific functional variability:extent,structure and sources of variation[J].JournalofEcology,2010,98(3):604-613.
[13] MENG T T(孟婷婷),NI J(倪 健),WANG G H(王国宏).Plant functional traits,environments and ecosystem functioning[J].Journal ofPlantEcology(植物生态学报),2007,31(1):150-165(in Chinese).
[14] CORNELISSEN J,LAVOREL S,GARNIER E,etal.A handbook of protocols for standardised and easy measurement of plant functional traits worldwide[J].AustralianJournalofBotany,2003,51(4):335-380.
[15] FORTUNEL C,FINE P V A,BARALOTO C.Leaf,stem and root tissue strategies across 758Neotropical tree species[J].FunctionalEcology,2012,26(5):1 153-1 161.
[16] FENG Q H (冯秋红),SHI Z M(史作民),DONG L L(董 莉莉).Response of plant functional traits to environment and its application[J].ScientiaSilvaeSinicae(林业科学),2008,44(4):125-131(in Chinese).
[17] WRIGHT I J,REICH P B,WESTOBY M,etal.The worldwide leaf economics spectrum[J].Nature,2004,428(6 985):821-827.
[18] MILLA R,REICH P B.The scaling of leaf area and mass:the cost of light interception increases with leaf size[J].Proceedingsofthe RoyalSocietyB:BiologicalSciences,2007,274(1 622):2 109-2 114.
[19] WRIGHT I J,WESTOBY M,REICH P B.Convergence towards higher leaf mass per area in dry and nutrient-poor habitats has different consequences for leaf life span[J].JournalofEcology,2002,90(3):534-543.
[20] LI Y L(李玉霖),CUI J Y(崔建垣),SU Y ZH(苏永中).Specific leaf area and leaf dry matter content of some plants in different dune habitats[J].ActaEcologicaSinica(生态学报),2005,25(2):304-311(in Chinese).
[21] WILSON P J,THOMPSON K,HODGSON J G.Specific leaf area and leaf dry matter content as alternative predictors of plant strategies[J].NewPhytologist,1999,143(1):155-162.
[22] GARNIER E,LAURENT G,BELLMANN A,etal.Consistency of species ranking based on functional leaf traits[J].NewPhytologist,2001,152(1):69-83.
[23] ETHERINGTON J R.Plant Physiological Ecology[M].Edward Arnold Ltd,1978:11-16.
[24] STITT M,KRAPP A.The interaction between elevated carbon dioxide and nitrogen nutrition:the physiological and molecular background[J].Plant,Cell&Environment,1999,22(6):583-621.
[25] REEKIE E G,BAZZAZ F A.Reproductive effort in plants.3.Effect of reproduction on vegetative activity[J].AmericanNaturalist,1987,129(6):907-919.
[26] BAZZAZ F A,ACKERLY D D,REEKIE E G.Reproductive Allocation in Plants[M].New York:CABI Publishing,2000:1-30.
[27] YANG D M(杨冬梅),ZHANG J J(章佳佳),ZHOU D(周 丹),etal.Leaf and functional traits of woody plants and their relationships with environmental change:A review[J].ChineseJournalofEcology(生态学杂志),2012,31(3):702-713(in Chinese).
[28] 梁瑞云.缙云山不同森林演替阶段群落植物叶片功能性状研究[D].重庆:西南大学,2013.
[29] LIU J H(刘金环).Leaf traits and their interrelationships of main plant species in southeast Horqin sandy land[J].ChineseJournalof Ecology(生态学杂志),2006,25(8):921-925(in Chinese).
[30] QI J(祁 建),MA K M(马克明),ZHANG Y X(张育新).Comparisons on leaf traits ofQuercusliaotungensisKoidz.on different slope position in Dongling Mountain of Beijing[J].ActaEcologicaSinica(生态学报),2008,28(1):122-128(in Chinese).
[31] REICH P B,WALTERS M B,ELLSWORTH D S,etal.Relationships of leaf dark respiration to leaf nitrogen,specific leaf area and leaf life-span:a test across biomes and functional groups[J].Oecologia,1998,114(4):471-482.
[32] WRIGHT I J,REICH P B,WESTOBY M.Strategy shifts in leaf physiology,structure and nutrient content between species of high-and low-rainfall and high-and low-nutrient habitats[J].FunctionalEcology,2001,15(4):423-434.
[33] WESTOBY M.A leaf-height-seed(LHS)plant ecology strategy scheme[J].PlantandSoil,1998,199(2):213-227.
[34] BAO L(宝 乐),LIU Y H(刘艳红).Comparison of leaf functional traits in different forest communities in Mt.Dongling of Beijing[J].ActaEcologicaSinica(生态学报),2009,29(7):3 692-3 703(in Chinese).
[35] STRAUSS-DEBENEDETTI S,BAZZAZ F A.Plasticity and acclimation to light in tropical Moraceae of different successional positions[J].Oecologia,1991,87(3):377-387.
[36] DARWIN C.The different forms of flower on plants of the same species[M].New York:Appleton Press,1877.
[37] LLOYD D G.Gender Allocations in Outcrossing Cosexual Plants[M]//Perspectives on Plant Population Ecology.Sinauer:Sunderland Mass Press,1984:277-300.
[38] CHARNOV E L.The Theory of Sex Allocation[M].Princeton:Princeton University Press,1982
[39] DELPH L F,MEAGHER T R.Sexual dimorphism masks life history trade-offs in the dioecious plantSilenelatifolia[J].Ecology,1995,76(3):775-785.
[40] BAZZAZ F A,CARLSON R W.Photosynthetic contribution of flowers and seeds to reproductive effort of an annual colonizer[J].New Phytologist,1979,82(1):223-232.

