泸州烟草黑胫病病原生理小种组成及对甲霜灵和烯酰吗啉的敏感性
战徊旭, 温娜娜, 罗定棋, 夏建华, 徐传涛, 张成省*
(1.中国农业科学院烟草研究所,青岛 266101;2.四川省烟草公司泸州市公司,泸州 646000)
泸州烟草黑胫病病原生理小种组成及对甲霜灵和烯酰吗啉的敏感性
战徊旭1, 温娜娜1, 罗定棋2, 夏建华2, 徐传涛2, 张成省1*
(1.中国农业科学院烟草研究所,青岛 266101;2.四川省烟草公司泸州市公司,泸州 646000)
烟草黑胫病(Phytophthora nicotianae)是四川省泸州烟区最为严重的病害之一,为明确泸州烟草黑胫病生理小种组成及其对甲霜灵和烯酰吗啉的敏感性,从泸州主产烟区采集样品,分离得到24株烟草黑胫病菌株;通过鉴别寄主法结合TTZ生化反应,发现24株菌株中,0号生理小种15株,占62.50%,1号生理小种9株,占37.50%。对24株菌株进行甲霜灵和烯酰吗啉的药剂敏感性检测,发现甲霜灵对24株菌株的EC50范围在0.052~0.513μg/mL之间,敏感菌株和中抗菌株分别占41.67%和58.33%,未发现高抗菌株;烯酰吗啉对24株菌株的EC50范围在0.110~1.615μg/m L之间,敏感菌株和中抗菌株分别占37.50%和62.50%,未发现高抗菌株。上述结果表明,泸州烟区烟草黑胫病菌同时存在0号生理小种和1号小种,而且该烟区的黑胫病菌已对甲霜灵和烯酰吗啉产生不同程度的抗性。
烟草黑胫病; 生理小种; 药剂敏感性; 甲霜灵; 烯酰吗啉
目前,烟草黑胫病的主要防治方法有种植抗病品种、栽培措施、化学防治和生物防治,其中化学防治是综合防治措施中的重要手段[8]。随着化学药剂的普遍使用,烟草疫霉的抗药性问题日益凸显。甲霜灵和烯酰吗啉是生产上常用的两种烟草黑胫病防治药剂,研究人员发现甲霜灵在超过20年的连续使用后,烟草疫霉抗性菌株已在美国、西班牙和南非陆续出现[9-11]。1994年Albert检测到了葡萄霜霉病菌对烯酰吗啉的抗性菌株,也证实了烯酰吗啉抗药性风险的存在[12]。四川省烟草黑胫病菌对于甲霜灵和烯酰吗啉的敏感性测定结果尚未见报道,因此,本文在明确泸州烟区烟草黑胫病菌生理小种组成和分布的基础上,检测它们对甲霜灵和烯酰吗啉的敏感性,摸清泸州烟区抗性菌株的分布及抗药性水平,以期为烟草黑胫病的药剂防治提供科学依据。
1 材料与方法
1.1 材料
供试样品:自2010年6月至2011年9月,从泸州烟区古蔺、叙永两个产烟县的主要产烟乡镇采集具有典型症状的烟草黑胫病病株,带回实验室进行分离鉴定。
供试药剂:95%甲霜灵原药由江苏宝灵化工股份有限公司提供。96%烯酰吗啉原药由巴斯夫欧洲公司提供。
根据文献分别配制燕麦培养基、TTZ液体培养基和TTZ固体培养基[1315]。
甲霜灵固体培养基:甲霜灵原药先用丙酮溶解,再用无菌水分别配成0、0.01、0.05、0.10、0.50、1.00 mg/L,使各浓度甲霜灵溶液中所含丙酮的量一致,然后经0.22μm细菌过滤器除菌,再分别加入熔化后冷却至40℃左右的燕麦培养基中,即制成不同浓度的甲霜灵固体培养基。
烯酰吗啉固体培养基:烯酰吗啉原药先用丙酮溶解,再用无菌水配成0、0.05、0.10、0.25、0.50、2.00 mg/L,并使各浓度中所含丙酮的量一致,然后经0.22μm细菌过滤器除菌,再分别加入熔化后冷却至40℃左右的燕麦培养基中,即制成不同浓度的烯酰吗啉固体培养基。
鉴别寄主:选择反应相对稳定且能鉴定出0号、1号、2号和3号生理小种的3个烟草品种‘NC1071’、‘Nicotiana nesophila’和‘Florida301’作为鉴别寄主,‘小黄金1025’为感病对照。以上烟草品种皆由中国烟草总公司青州烟草研究所提供。烟草黑胫病菌4个生理小种在各鉴别寄主上的反应见表1。
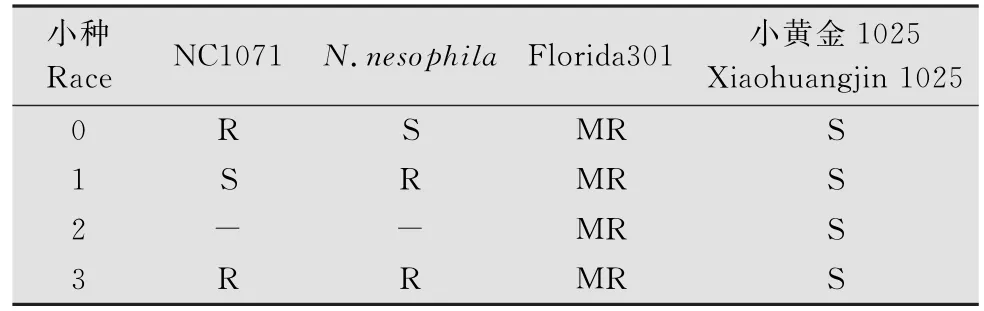
表1 烟草黑胫病菌在鉴别寄主上的反应1)Table 1 Reaction of Phytophthora nicotianae on different hosts
1.2 方法
1.2.1 病原分离
取典型的烟草黑胫病病株,将新鲜病组织表面用蒸馏水冲洗干净,超净工作台内晾干,切取茎基部病健交界处组织5 mm×5 mm小块,在75%乙醇中消毒1 min,0.1%升汞消毒1 min,而后用灭菌水清洗3次,每次2~3 min。表面消毒后,取出组织用灭菌滤纸将其表面水分吸干,置于选择性燕麦琼脂培养基平板上培养,每皿均匀放置3~4块,28℃光照培养箱中培养,2~4 d后挑取边缘菌落纯化。
1.2.2 TTZ颜色反应
供试烟草黑胫病菌在28℃恒温培养箱内培养3~5 d,用直径为5 mm的打孔器取边缘菌龄一致的菌块,移入TTZ固体培养基和液体培养基中,以不加TTZ(2,3,5-氯化三苯基四氮唑)的基础培养基为对照,每处理设3个重复。28℃条件下培养24 h后,观察固体培养基及菌体的颜色变化,培养72 h后,观察液体培养基及菌体的颜色变化。
判断依据:0号和1号生理小种在TTZ液体培养基中,72 h内菌丝全部变为红色;在固体培养基中,24 h菌体变为红色;3号生理小种在TTZ液体培养基和固体培养基中均不变色[14]。
1.2.3 接种
首先按照文献[20]中方法制备游动孢子悬浮液,然后用5号针头大小的医用注射器吸取制备好的游动孢子悬浮液,在6~8叶期烟苗茎基部以上1 cm处注射,每株0.5 m L。每处理4次重复,每重复3株。接种后的烟苗置于25~28℃温室内,维持湿度90%,诱发病害发生。接种后每7 d调查1次发病情况,连续调查3次。病害分级标准与病情指数计算参照烟草行业标准YC/T39-1996[16]。
1.2.4 烟草黑胫病菌药剂敏感性测定
将在燕麦培养基上培养了5~7 d的菌株,用直径为5 mm的打孔器于距菌落中心等距、菌丝生长均匀处打取菌饼,菌面向下,分别接于含有不同浓度的甲霜灵和烯酰吗啉的固体培养基平板上,每皿1片,置于25℃恒温培养箱内黑暗培养,每个浓度4次重复。培养5 d后,用十字交叉法测量菌落直径,计算生长抑制率。利用SPSS 22.0软件对数据进行统计分析,计算EC50和抗性倍数,建立毒力回归方程,求出相关系数[17]。
1.2.5 烟草黑胫病菌抗性水平划分
参照胡燕[18]的方法划分,以本实验室保存的敏感菌株(甲霜灵敏感菌株FJ1和烯酰吗啉敏感菌株JM01)的EC50为1.0,计算抗性倍数,根据抗性倍数将菌株分为敏感性菌株:EC50(R)/EC50(S)<5;中抗菌株:5≤EC50(R)/EC50(S)<20;高抗性菌株:EC50(R)/ EC50(S)≥20。
2 结果与分析
2.1 TTZ颜色反应鉴定结果
观察发现,分离得到的24个供试菌株在TTZ液体培养基中培养72 h后,菌体变红,且液体培养基呈现出浅红色。在TTZ固体培养基上接种24 h后菌饼变为红色,随着培养时间的增加,红色范围逐渐扩大。试验结果表明,供试菌株为0号或1号生理小种,而非3号生理小种[14]。
2.2 鉴别寄主鉴定结果
从表2可以看出,全部供试菌株在‘Florida301’品种上的反应表现为抗病至中抗,病情指数为16.24~45.38,在‘小黄金1025’品种上的反应表现为中感至感病,病情指数为50.82~91.34,但在‘NC1071’和‘N.nesophila’品种上的反应表现有所差异。其中15个菌株在‘NC1071’品种上表现为抗或中抗,在‘N.nesophila’品种上表现为感或中感,病情指数分别为9.85~30.52和50.27~75.07,其余9个菌株在‘NC1071’品种上的反应皆表现为感或中感,在‘N.nesophila’品种上表现为抗或中抗,病情指数分别为50.20~76.24和8.75~34.13。结合TTZ颜色反应结果,判断来自泸州主产区的24个菌株均为0号生理小种和1号生理小种,其中0号生理小种占62.50%,1号生理小种占37.50%,0号生理小种为四川省泸州烟区烟草黑胫病菌的优势小种。

表2 烟草黑胫病菌在鉴别寄主上的反应及生理小种类型Table 2 Physiological race and response of Phytophthora nicotianae on different hosts

续表2 Table 2(Continued)
2.3 烟草黑胫病菌对甲霜灵敏感性测定结果
采用菌落直径法测定各菌株对甲霜灵的敏感性水平,从表3和图1可知,甲霜灵敏感菌株(FJ1)的EC50为0.027μg/m L,泸州烟区的24个田间菌株的EC50范围在0.052~0.513μg/m L之间,其抗性倍数为1.98~19.37。来自古蔺县石屏乡的菌株GL9最为敏感,来自古蔺县石庄乡的菌株GL3最为耐药,菌株GL3的EC50是菌株GL9的9.78倍。样品中敏感菌株10个,占测定总数的41.67%,EC50平均值为0.098μg/m L,中抗菌株14个,占测定总数的58.33%,无高抗菌株。除GL3以外的菌株的EC50呈连续单峰频次分布。
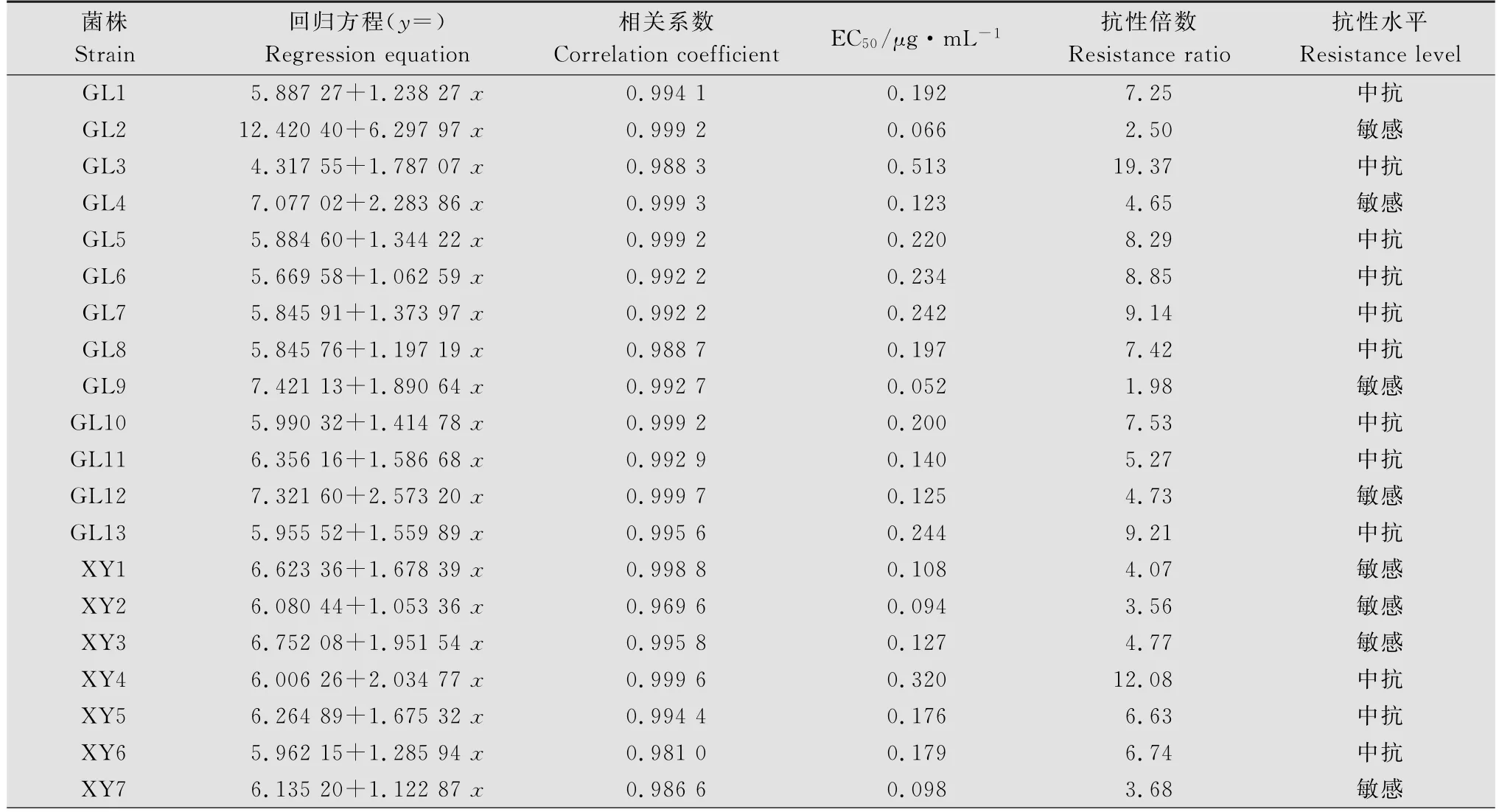
表3 烟草黑胫病菌菌株对甲霜灵的敏感性Table 3 Sensitivity of Phytophthora nicotianae isolates to metalaxyl

续表3 Table 3(Continued)
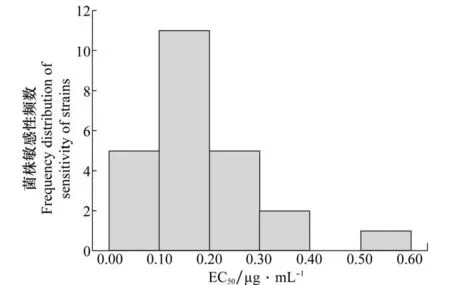
图1 烟草黑胫病菌菌株对甲霜灵敏感性的频数分布Fig.1 Frequency distribution of sensitivity of Phytophthora nicotianae strains to metalaxyl
2.4 烟草黑胫病菌对烯酰吗啉敏感性测定结果
试验结果(表4)表明,烯酰吗啉敏感菌株(JM01)的EC50为0.107μg/m L,测试菌株的EC50范围为0.110~1.615μg/m L,抗性倍数为1.02~15.05。其中,敏感菌株9个,占测定总数的37.50%,中抗菌株15个,占测定总数的62.50%,EC50平均值为0.820μg/m L,无高抗菌株。古蔺县石庄乡菌株GL3最为敏感,其EC50为0.110μg/m L,叙永县麻城乡菌株XY5的EC50(1.615μg/m L)最大,菌株XY5的EC50是菌株GL3的14.74倍。除GL10和XY5以外的菌株的EC50呈连续单峰频次分布。
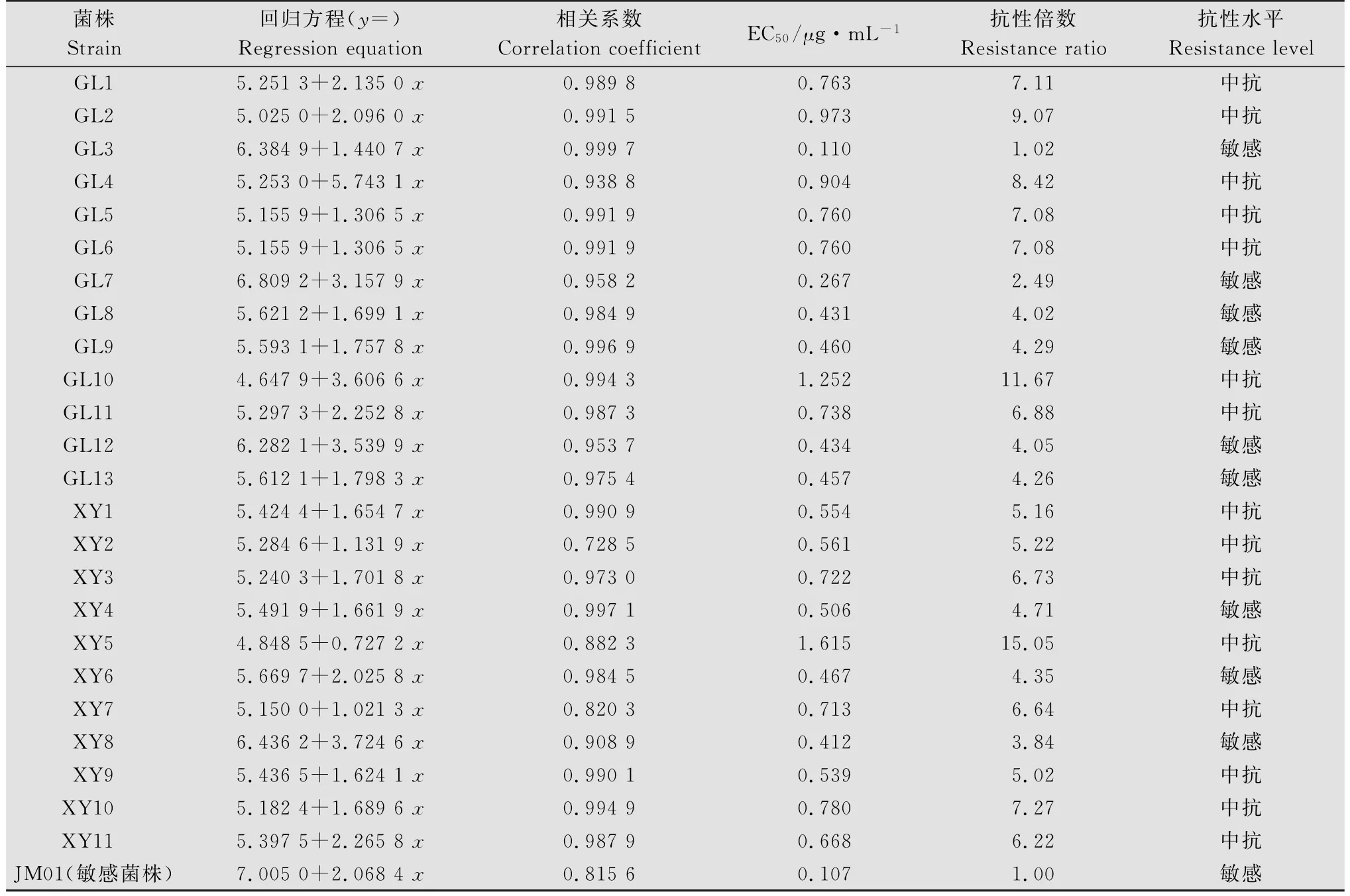
表4 烟草黑胫病菌菌株对烯酰吗啉的敏感性Table 4 Sensitivity of Phytophthora nicotianae isolates to dimethomorph

图2 烟草黑胫病菌菌株对烯酰吗啉敏感性的频数分布Fig.2 Frequency distribution of sensitivity of Phytophthora nicotianae strains to dimethomorph
2.5 不同地理来源菌株对甲霜灵敏感性水平的系统聚类分析
甲霜灵对供试菌株EC50的离差平方和系统聚类分析结果(图3)表明:24个菌株的EC50可分为4个聚类组,第1组包括11个菌株(GL12、XY9、XY3、GL4、GL11、XY2、XY7、XY1、GL2、XY11、GL9),第2组包括2个菌株(XY4、XY10),第3组包括10个菌株(XY5、XY6、GL8、GL10、GL1、GL7、GL13、GL6、GL5、XY8),第4组仅包括1个菌株(GL3)。大部分菌株出现在第1和第3聚类组中,只有少部分菌株单独聚成一类,古蔺县菌株样品出现在除第2组外的其余3组中,而叙永县菌株样品出现在除第4组外的其余3组中,表明菌株对甲霜灵的敏感性与其地理来源具有一定相关性。同时,来自于古蔺县石屏乡的4个菌株样品在3个聚类组中出现,而古蔺县德耀镇、叙永县麻城乡、叙永县水潦乡的菌株样品在2个聚类组中出现,说明石屏乡菌株抗性的变化幅度大,德耀镇、麻城乡、水潦乡的菌株抗性变化幅度小,进而说明来自于同一烟区的菌株样品抗性有所差异。GL3自成一组,EC50最大,和其他聚类组的差别最大。
2.6 不同地理来源菌株对烯酰吗啉敏感性水平的系统聚类分析
烯酰吗啉对供试菌株EC50的离差平方和系统聚类分析结果(图4)表明:24个菌株的EC50可分为3个聚类组,第1组包括10个菌株(GL5、GL6、GL1、XY10、XY3、XY7、GL11、XY11、GL2、GL4),第2组包括12个菌株(GL3、GL7、XY1、XY2、XY9、 GL8、GL12、XY8、GL9、GL13、XY6、XY4),第3组包括2个菌株(GL4、XY5)。大部分菌株出现在第1和第2聚类组中,只有菌株GL10和XY5单独聚成一类,古蔺县菌株样品和叙永县菌株样品均出现在3个聚类组中,说明烟草黑胫病菌对烯酰吗啉抗性的地区性差异不明显。同时,来自于古蔺县石屏乡的4株菌株样品和来自于叙永县麻城乡的4个菌株样品均在这3个聚类组中出现,表明石屏乡和麻城乡菌株抗性的变化幅度大,再次说明来自于同一烟区菌株样品抗性有所差异。XY5和GL10自成一组,其EC50和其他聚类组的差别最大。
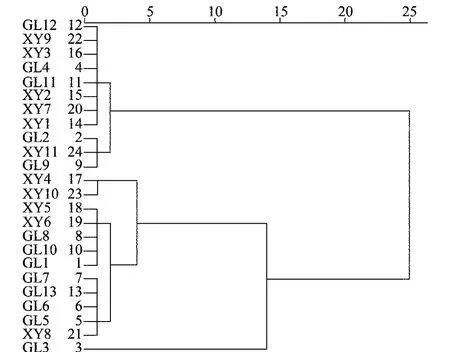
图3 烟草黑胫病菌菌株对甲霜灵敏感性水平的系统聚类分析Fig.3 Systemic cluster analysis of sensitivity level of Phytophthora nicotianae strains to metalaxyl

图4 烟草黑胫病菌菌株对烯酰吗啉敏感性水平的系统聚类分析Fig.4 Systemic cluster analysis of sensitivity level of Phytophthora nicotianae strains to dimethomorph
3 结论与讨论
目前,国内外较为常用的烟草黑胫病菌生理小种鉴别寄主有‘NC1071’、‘L8’、‘Florida301’、‘N.nesophila’、‘N.nudicaulis’、‘N.plunbaginifolia’、‘N. stocktonii’、‘Burley21’、‘Burley37’、(‘L8’בBurley21’)F1、‘小黄金1025’等[1920]。朱贤朝等[5]认为‘L8’和‘NC1071’的抗性分别来自于‘N.longiflora’和‘N.plumbaginifolia’,两者抗性基因片段相似,均为显性单基因遗传,对0号和1号生理小种的抗感反应稳定。然而,鉴于不同来源的‘L8’会对烟草黑胫病菌产生抗、感截然不同的结果,所以本研究没有将‘L8’作为标准鉴别寄主[1]。‘N.nesophila’作为野生品种,基因比较稳定,自然变异性较小[15];‘Florida 301’作为抗病品种,‘小黄金1025’作为感病品种常应用于烟草黑胫病菌生理小种鉴定之中[57,2022]。因此,本研究最终选用‘NC1071’、‘N.nesophila’、‘Florida301’、‘小黄金1025’作为鉴别寄主。
目前,国内报道的烟草黑胫病菌生理小种为0号和1号生理小种。本研究结果表明,供试菌株中0号生理小种占62.50%,1号生理小种占37.50%, 0号生理小种是四川省泸州烟区烟草黑胫病菌的优势小种。本研究结果与王智发等[1]和李斌等[22]的研究结果不同,但与朱贤朝等[23]鉴定国内烟区1号生理小种为优势小种的结果基本一致,推测这与鉴别寄主的选择和取样样品差别有关。同时本研究结果与凉山州烟草黑胫病菌生理小种研究结果也有所不同[24],说明不同地域间烟草黑胫病菌生理小种分布有所差别。未来还需进一步扩大采样范围,以便确定泸州烟区是否还存在其他烟草黑胫病菌生理小种类型。
甲霜灵和烯酰吗啉作为内吸性杀菌剂因具有良好的治疗作用而广泛应用于烟草生产之中。但是这类药剂对病菌作用位点单一,作用位点一旦发生突变,病菌就会产生抗药性[12,25]。近年来随着这两种药剂的抗性疫霉的相继报道[12,2628],其抗药性风险正逐步为人们所关注。本研究结果表明,24株分离物对甲霜灵敏感菌株占41.67%,中抗菌株占测定总数的58.33%,无高抗菌株。古蔺县石屏乡菌株GL3甲霜灵抗性最高,古蔺县中抗菌株数量占中抗菌株总数的64.29%,说明古蔺县烟田中甲霜灵抗药性菌株较多,应采取相应措施,避免抗药性菌株的进一步增加。样品中烯酰吗啉敏感菌株占37.50%,中抗菌株占62.50%,无高抗菌株。古蔺县石庄乡菌株GL3烯酰吗啉抗性最低,叙永县麻城乡菌株XY5抗性最高。菌株GL3在两种药剂下的不同敏感性反映出药剂的轮换使用可以有效避免抗药性菌株的产生。两种药剂敏感性测定结果及菌株的抗性系统聚类分析结果表明,不同烟区菌株之间对甲霜灵的敏感性差异较大,而同一烟区不同菌株间的敏感性也有所差异。烟草黑胫病菌对烯酰吗啉抗性的地区性差异不明显。
泸州烟区已经有两种药剂的中抗菌株的出现,说明两种药剂均存在一定的抗性风险,鉴于甲霜灵抗性倍数大于10倍的菌株数多于烯酰吗啉的菌株数,且古蔺县样品中已经出现抗性倍数接近20倍的菌株,甲霜灵抗性风险更大。建议在改进药剂使用技术的同时,合理进行药剂的混用及轮换,以减缓泸州烟区烟草黑胫病菌抗药性产生的速度。下一步试验应进一步增加取样地区,同时进行烟草黑胫病菌对甲霜灵和烯酰吗啉交互抗性的研究工作,为日后合理用药提供理论依据。
[1] 王智发,刘延荣,谢成颂,等.我国烟草黑胫病菌生理小种鉴定[J].山东农业大学学报,1987(1):1-8.
[2] 孙计平,李雪君,吴照辉,等.烟草黑胫病的研究进展[J].湖北农业科学,2011,50(16):3253-3256.
[3] 屈霞,李爱国,颜合洪.烟草黑胫病研究进展[J].作物研究, 2007,21(5):725-728.
[4] McIntyre J L,Taylor G S.Race 3 of Phytophthora parasitica var.nicotianae[J].Phytopathology,1978,68(1):35.
[5] 朱贤朝,郭振业,刘保安.山东省烟草黑胫病菌生理小种研究[J].植物病理学报,1987,17(2):28-33.
[6] 朱贤朝,郭振业,刘保安.烟草黑胫病菌(Phytophthora parasitica var.nicotianae)生理小种研究初报[J].中国烟草,1984(1):4-7.
[7] 朱贤朝.烟草黑胫病菌(Phytophthora parasitica var.nicotianae)生理小种研究概况和鉴定技术[J].中国烟草,1982(1):23-26.
[8] 苏凯,桑维钧,张新强,等.贵州省烟草黑胫病菌对烯酰吗啉的敏感性[J].植物保护,2013,39(1):154-158.
[9] Csinos A S,Bertrand P F.Distribution of Phytophthora parasitica var.nicotianae races and their sensitivity to metalaxyl in Georgia[J].Plant Disease,1994,78(5):471-474.
[10]van Jaarsveld E,Wingfield M J,Drenth A.Effect of metalaxyl resistance and cultivar resistance on control of Phytophthora nicotianae in tobacco[J].Plant Disease,2002,86(4):362-366.
[11]Shew H D.Response of Phytophthora parasitica var.nicotianae to metalaxyl exposure[J].Plant Disease,1985,69(7):559-562.
[12]胡燕,王开运,许学明,等.烯酰吗啉对我国烟草黑胫病菌的毒力研究[J].农药学学报,2006,8(4):339-343.
[13]方中达.植病研究方法[M].北京:中国农业出版社,1998:49.
[14]王智发,马德岭,刘延荣.用生化方法研究烟草黑胫病菌生理分化[J].山东农业大学学报,1990(1):1-6.
[15]谢成颂,王智发,刘延荣,等.烟草黑胫病菌(Phytophthora parasitica var.nicotianae)生理小种鉴定技术研究[J].山东农业大学学报,1989(1):20-25.
[16]国家烟草专卖局.YC/T39-1996,烟草病害分级及调查方法[S].北京:中国标准出版社,1996.
[17]赵善欢.植物化学保护[M].第2版.北京:中国农业出版社, 1983:518-520.
[18]胡燕.烟草黑胫病菌对烯酰吗啉的抗性风险研究[D].泰安:山东农业大学,2007.
[19]刘廷利,肖崇刚,陈国康,等.重庆市烟草黑胫病菌生理小种研究初报[J].烟草科技,2008(2):61-64.
[20]李锡坤、孔凡玉、李锡宏,等.湖北省烟草黑胫病菌生理小种研究初报[J].中国烟草科学,2011,32(3):84-88.
[21]王成.烟草黑胫病生防菌的筛选[D].福州:福建农林大学,2012.
[22]李斌,杨益芬,龚国淑.四川省烟草黑胫病菌生理小种的分离鉴定[J].烟草科技,2012(10):81-84.
[23]朱贤朝,郭振业,刘保安,等.我国烟草黑胫病菌生理小种研究初报[J].中国烟草,1987(4):1-3.
[24]刘铭,尹福强,张文友,等.凉山州烟草黑胫病菌生理小种的鉴定[J].广东农业科学,2012(18):71-75.
[25]马国胜,高智谋,陈娟.烟草黑胫病菌研究进展(Ⅲ)[J].烟草科技,2004(2):44-48.
[26]Ersek T,Schoelz J E,English J T.Characterization of selected drug-resistant mutants of Phytophthora capsici,P.parasitica and P.citrophthora[J].Acta Phytopathologica et Entomologica Hungarica,1994,29(3/4):215-229.
[27]Chang T T,Ko W H.Resistance to fungicides and antibiotics in Phytophthora parasitica:genetic nature and use in hybrid determination[J].Phytopathology,1990,80:1414-1421.
[28]Chabane K,Leroux P.Selection and characterization of Phytophthora parasitica mutants with ultraviolet-induced resistance to dimethomorph or metalaxyl[J].Pesticide Science,1993,39:325-329.
(责任编辑:王 音)
Races of Phytophthora nicotianae and their sensitivity to metalaxyl and dimethomorph in Luzhou,Sichuan
Zhan Huaixu1, Wen Nana1, Luo Dingqi2, Xia Jianhua2, Xu Chuantao2, Zhang Chengsheng1
(1.Tobacco Research Institute of Chinese Academy of Agricultural Sciences,Qingdao 266101,China; 2.Luzhou Tobacco Company of Sichuan Province,Luzhou 646000,China)
Tobacco black shank,caused by Phytophthora nicotianae,is one of the most destructive diseases in Luzhou,Sichuan.In order to confirm the races of P.nicotianae and their sensitivity to metalaxyl and dimethomorph,24 strains of P.nicotianae were firstly isolated from samples of the tobacco production areas in Luzhou. All 24 isolates were identified as race 0 and race 1 based on host assay and TTZ color reaction.Fifteen isolates were identified as race 0,and 9 isolates were race 1,which accounted for 62.50%and 37.50%respectively.The sensitivity of these isolates to metalaxyl and dimethomorph were measured subsequently.The EC50values of metalaxyl to these isolates ranged from 0.052μg/m L to 0.513μg/m L,with the proportions of sensitive and moderate resistant strains of 41.67%and 58.33%,respectively.EC50values of dimethomorph to these isolates ranged from 0.110μg/mL to 1.615μg/mL and the proportions of the sensitive and the intermediate resistant strain were 37.50%and 62.50%,respectively.No high resistant strain to metalaxyl and dimethomorph was found.These results indicated that both of race 0 and race 1 of P.nicotianae existed in Luzhou and these isolates had developed fungicide resistance to metalaxyl and dimethomorph.
Phytophthora nicotianae; physiological race; fungicides sensitivity; metalaxyl; dimethomorph
S 435.72
A
10.3969/j.issn.0529-1542.2015.06.033
2014-11-15
2015-01-09
国家烟草专卖局重点项目(110200902065);四川省烟草专卖局项目(201101007)
由烟草疫霉(Phytophthora nicotianae)引起的烟草黑胫病是一种极具毁灭性的病害,自1896年在印度尼西亚的爪哇首次被发现后,该病已广泛分布于世界各烟草种植区[1],严重影响了烟叶的产量和品质。自20世纪60年代初,美国、南非、印度、中国等主要产烟国家相继开展了大量的烟草黑胫病菌生理小种
*通信作者 E-mail:zhangchengsheng@caas.cn鉴定工作。目前已经明确了烟草黑胫病菌存在0号、1号、2号、3号,共4个生理小种,0号和1号生理小种广泛分布于世界各烟区,2号生理小种发现于南非, 3号生理小种发现于美国[24]。朱贤朝等[57]和王智发等[1]报道我国主产烟区至少存在0号和1号两个生理小种。泸州烟区烟草黑胫病近年来发生严重,而关于泸州烟区烟草黑胫病菌生理小种的研究尚未见报道。因此,本试验对2010-2011年间泸州烟区采集的烟草黑胫病菌样品进行生理小种鉴定,旨在掌握泸州烟区烟草黑胫病菌生理小种分布及组成情况。

