玉米雌穗挥发物对亚洲玉米螟幼虫取食选择的影响
谢兴伟, 杨 真, 陈 晓, 苏国连, 陈 斌, 严乃胜, 董文霞
(云南农业大学植物保护学院,农业生物多样性与病害控制教育部重点实验室,云南省农业生物多样性利用与保护重点实验室,昆明 650201)
玉米雌穗挥发物对亚洲玉米螟幼虫取食选择的影响
谢兴伟#, 杨 真#, 陈 晓, 苏国连, 陈 斌, 严乃胜, 董文霞*
(云南农业大学植物保护学院,农业生物多样性与病害控制教育部重点实验室,云南省农业生物多样性利用与保护重点实验室,昆明 650201)
为了探明玉米雌穗挥发物组成及其对亚洲玉米螟(Ostrinia furnacalis)幼虫取食行为的影响,本研究利用顶空吸附法及气相色谱/质谱联用技术(GC/MS)测定了离体玉米雌穗的挥发物组分,并通过幼虫取食选择试验测定了11种玉米雌穗挥发物在4个不同浓度下(5×10-6、5×10-5、5×10-4、5×10-3g/mL,正己烷为溶剂)对亚洲玉米螟取食行为的影响。结果表明:从离体玉米雌穗中共计收集并鉴定出32种挥发物组分,主要包括绿叶气味物质、萜类化合物和脂肪族化合物。其中,萜类化合物的含量最高,占玉米雌穗挥发物总释放量的84.40%。在所有测定的浓度范围内,β-石竹烯、十四烷表现为引诱活性,壬醛表现为驱避作用。除浓度为5×10-3g/m L外,癸烷、反-罗勒烯、6-甲基-5-庚烯-2-酮对幼虫取食表现为引诱作用。
亚洲玉米螟; 玉米雌穗; 植物挥发物; 取食行为
玉米(Zea mays L.)是世界上种植面积最大、分布最广的作物,也是我国的第三大粮食作物,其种植面积位居我国秋粮之首[12]。亚洲玉米螟[Ostrinia furnacalis(Guenée)]是重要的玉米害虫,也是我国玉米螟的优势种。据统计,每年由亚洲玉米螟造成的危害可使玉米减产达30%以上[3]。目前,对亚洲玉米螟的防治仍以化学农药为主,迫切需要探索新的防治手段。
昆虫通常依靠自身的化学感受器与周围环境中的化学信息产生关联,为其寻找适宜的寄主植物,以完成生存和繁衍[4-7]。通过植物挥发物调控昆虫的行为是探索害虫防治的新途径[8]。国内外关于玉米挥发物与玉米螟行为互作关系的研究已有大量报道[912]。但是有关玉米雌穗挥发物的研究较少,已有的研究主要集中在玉米雌穗苞叶、玉米花丝等的挥发物研究上[13-14],而玉米雌穗挥发物对昆虫行为的影响也未见报道。
本研究利用顶空吸附法及气相色谱/质谱联用技术(GC/MS)测定了玉米雌穗的挥发物成分,并测定了幼虫对添加了挥发物单组分的人工饲料的取食选择,旨在筛选对亚洲玉米螟幼虫取食具有引诱或驱避作用的组分。
1 材料与方法
1.1 材料
1.1.1 供试植物
玉米‘会单4号’为云南常用的普通品种,在光照培养箱中催芽,并于5 d后选取长势一致的玉米芽种植于温室内,行距1 m,株距25 cm,种植后覆盖地膜。待玉米开花1个月后摘取玉米雌穗进行试验,无虫害。
1.1.2 供试虫源
亚洲玉米螟采自云南农业大学玉米试验田,在人工气候箱中连续饲养10代以上,温度为(26± 1)℃、相对湿度为70%±10%、光周期为L∥D= 14 h∥10 h。幼虫饲以人工饲料[15];成虫饲以10%的蜂蜜水。试验时选取孵化当天的幼虫。
1.1.3 供试试剂
正己烷(色谱纯,98%,Merck)、α-蒎烯(98%, Aldrich)、反-罗勒烯(90%,Aldrich)、β-石竹烯(90%, TCI)、2-己酮(98%,J&K)、6-甲基-5-庚烯-2-酮(98%,TCI)、壬醛(95%,TCI)、癸醛(95%,TCI)、1-辛烯-3-醇(98%,J&K)、癸烷(99%,Acros Organics)、十四烷(98%,J&K)、十六烷(98.5%,J&K)。
1.2 方法
1.2.1 离体玉米雌穗挥发物的收集
离体玉米雌穗挥发物的收集采用动态顶空吸附法。试验时选取长势一致、无病虫害的玉米植株20株,剪下整个雌穗,放入玻璃干燥器(d=500 mm, h=400 mm)进行挥发物的收集。试验前通气10 min去除收集装置中的气味。玻璃干燥器上部通入两根装有吸附剂(700 mg Porapak Type Q,80-100 mesh,Waters)的巴斯德管,一根用Teflon管连接大气采样仪(QC-1S型,北京市劳动保护科学研究所);一根与活性炭相连接,作为净化空气的入口。收集时,控制空气流量为500 m L/min,连续吸附24 h,保持环境通风、无异味,光源为自然光。收集完成后的样品用2 m L正己烷洗脱至棕色样品瓶中,加入辛烷和壬酸乙酯各1 000 ng作为内标,用氮吹法浓缩至100μL,于-20℃冷藏待用。重复3次,系统为空白对照。3次试验所用玉米雌穗质量分别为3 186.35、2 966.16、3 021.17 g。

图1 气体收集装置示意图Fig.1 Schematic diagram of collection device
1.2.2 挥发物组分的分离与鉴定
利用气相色谱(GC)/质谱(MS)联用仪(Agilent 6890A/5973MS,美国Agilent公司)对离体玉米雌穗挥发物进行分析,氢火焰离子检测器,色谱柱为HP-5毛细管柱(30 m×0.25 mm×0.25μm);程序升温:起始温度40℃,以3℃/min升温至80℃,再以5℃/min升温至260℃;柱前压100 k Pa,载气为高纯氦气,流速1.0 m L/min,分流进样,分流比为10∶1,进样量2.0μL。质谱条件:EI离子源,电子能量70 e V,质子扫描范围35~500 amu,四级杆温度150℃,离子源温度230℃,传输线温度250℃,柱压100 k Pa。通过核对标准谱库(Wiley7n.l)与标准化合物的质谱图,根据标准化合物的保留时间对提取物组分进行定性分析。
1.2.3 玉米雌穗挥发物组分对亚洲玉米螟幼虫取食选择试验
选取已经购买到的11种具有代表性的玉米穗挥发物组分(萜类化合物:α-蒎烯、反-罗勒烯、β-石竹烯;烷烃化合物:癸烷、十四烷、十六烷;酮类化合物:2-己酮、6-甲基-5-庚烯-2-酮;醛类化合物:壬醛、癸醛;醇类化合物:1-辛烯-3-醇),将上述标准化合物配制成5×10-6、5×10-5、5×10-4、5×10-3g/m L的正己烷溶液,取等量正己烷作对照。取200μL待测样品溶液均匀涂抹于长方体状人工饲料(l×w×h=0.8 cm ×0.8 cm×3.0 cm)表面;将处理和对照饲料等距离摆放在普特斯瓶(d×h=6 cm×8 cm)中,接入100头初孵幼虫,4 d后统计饲料上幼虫数量。重复6次。
1.3 数据统计分析
利用峰面积归一法和内标法对玉米雌穗挥发物各组分进行定量分析,利用χ2检验分析幼虫取食处理与对照间的差异性,利用Duncan氏新复极差法进行显著性检验,相对取食率(%)=处理端幼虫数/ (处理端幼虫数+对照端幼虫数)×100。数据统计分析采用Excel和SPSS 18.0软件进行。
2 结果与分析
2.1 离体玉米雌穗挥发物的组成及含量
利用顶空吸附法从离体玉米雌穗中共计收集并鉴定出32种挥发物组分,主要包括绿叶气味物质、萜类化合物和脂肪族化合物(表1)。绿叶气味物质释放量较少,占挥发物总释放量的2.05%,仅有3-己醇和2-己醇。萜类化合物的释放量最高,占总释放量的84.40%,包括α-蒎烯、(-)-柠檬烯、反-罗勒烯、反-4.8-二甲基-1.3.7-壬三烯、(+) -环苜蓿烯等18种组分。其中,(+)-环苜蓿烯和α-衣兰烯的释放量较高,分别占萜类化合物释放总量的35.93%和24.17%,反-4.8-二甲基-1.3.7-壬三烯和α-愈创烯的含量较低,分别占萜类化合物释放总量的0.68%和0.67%。脂肪族化合物包括烃类、酮类、醛类、醇类和酯类共13种,约占挥发物释放总量的13.56%。其中,2-己酮是释放量最高的脂肪族化合物,占脂肪族化合物释放总量的15.20%;十一烷的释放量最低,占脂肪族化合物释放总量的3.28%。
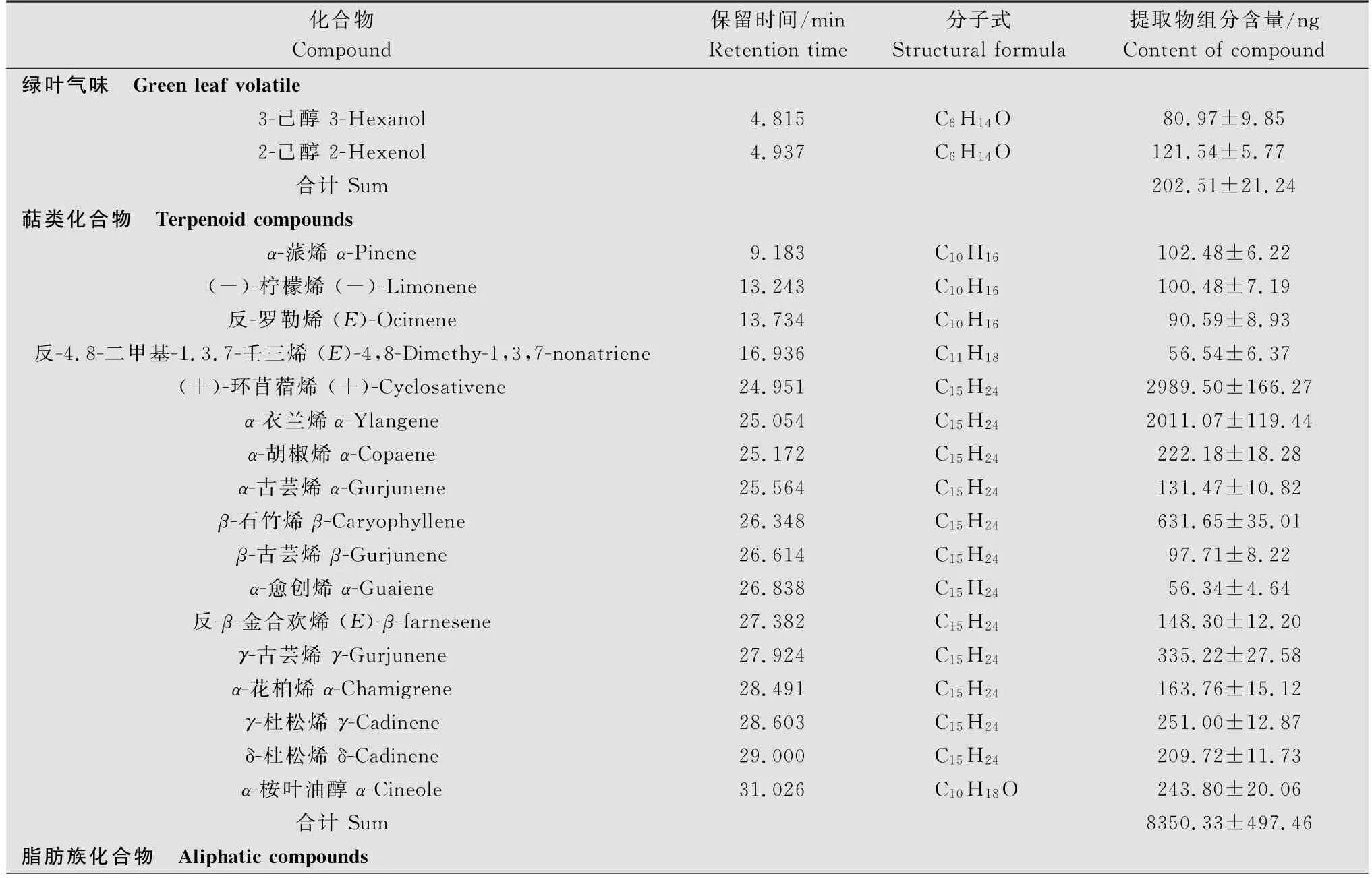
表1 玉米雌穗挥发物的组成及含量1)Table 1 Component quantities of corn ear volatiles

续表1 Table 1(Continued)
2.2 玉米雌穗挥发物组分对亚洲玉米螟幼虫取食行为的影响
亚洲玉米螟幼虫对经正己烷处理与未经处理的饲料的取食选择没有显著差异(χ2=6.359;P= 0.384),处理端的取食率为51.11%±2.25%,未处理端的取食率为48.89%±2.25%。11种化合物在4种不同浓度下对亚洲玉米螟初孵幼虫取食选择的结果表明,β-石竹烯(5×10-6g/m L:χ2=39.587, P=0.000;5×10-5g/m L:χ2=32.914,P= 0.000;5×10-4g/m L:χ2=170.753,P=0.000; 5×10-3g/m L:χ2=17.610,P=0.007)和十四烷(5×10-6g/m L:χ2=18.363,P=0.005;5×10-5g/m L:χ2=20.087,P=0.003;5×10-4g/m L:χ2=44.9736,P=0.000;5×10-3g/m L:χ2= 13.089,P=0.042)对初孵幼虫的取食行为表现出显著的引诱作用,壬醛(5×10-6g/mL:χ2=17.464, P=0.008;5×10-5g/m L:χ2=19.330,P=0.004; 5×10-4g/m L:χ2=16.631,P=0.011;5×10-3g/ m L:χ2=20.632,P=0.002)对初孵幼虫的取食行为表现出显著的驱避作用。其余8种化合物在浓度为5×10-6g/m L时,6-甲基-5-庚烯-2-酮(χ2= 32.821,P=0.000)、反-罗勒烯(χ2=18.301,P= 0.006)、癸烷(χ2=16.008,P=0.014)、对初孵幼虫有显著的引诱作用;6-甲基-5-庚烯-2-酮(χ2=32.740, P=0.000)、2-己酮(χ2=16.249,P=0.012)、α-蒎烯(χ2=29.781,P=0.000)、反-罗勒烯(χ2=85.390, P=0.000)、癸烷(χ2=18.954,P=0.004)在浓度为5×10-5g/m L时具有引诱作用;6-甲基-5-庚烯-2-酮(χ2=67.110,P=0.000)、1-辛烯-3-醇(χ2= 64.808,P=0.000)、十六烷(χ2=38.001,P= 0.000)、反-罗勒烯(χ2=39.258,P=0.000)、癸烷(χ2=40.831,P=0.000)、2-己酮(χ2=15.968, P=0.014)、α-蒎烯(χ2=16.561,P=0.011)在浓度为5×10-4g/m L时对初孵幼虫取食有显著的引诱效果;当浓度为5×10-3g/mL时,2-己酮(χ2=57.741, P=0.000)对幼虫取食具有引诱作用,而6-甲基-5-庚烯-2-酮(χ2=37.989,P=0.000)和癸醛(χ2=14.549, P=0.024)对初孵幼虫取食有显著的驱避效果。
3 讨论
植物挥发物通常包括绿叶气味物质、萜类化合物、芳香族化合物和脂肪族化合物[16]。其中,萜类化合物对于植物体的防御系统具有重要意义,一些萜类化合物不仅对植食性昆虫具有驱避甚至是毒杀作用,还具有引诱天敌的通讯作用[1718]。本研究中,从离体玉米雌穗中收集到的萜类化合物的含量占总释放量的80%以上,与Huang等[10]的研究结果较为相似。这可能是由于受机械损伤后激活了自身的防御机制而导致一些具有防御意义的次生物质大量释放;也可能是在长期的进化过程中所形成的一种自我保护的特性[19]。本研究所收集到的32种挥发物组分中,未鉴定出芳香族化合物的存在。
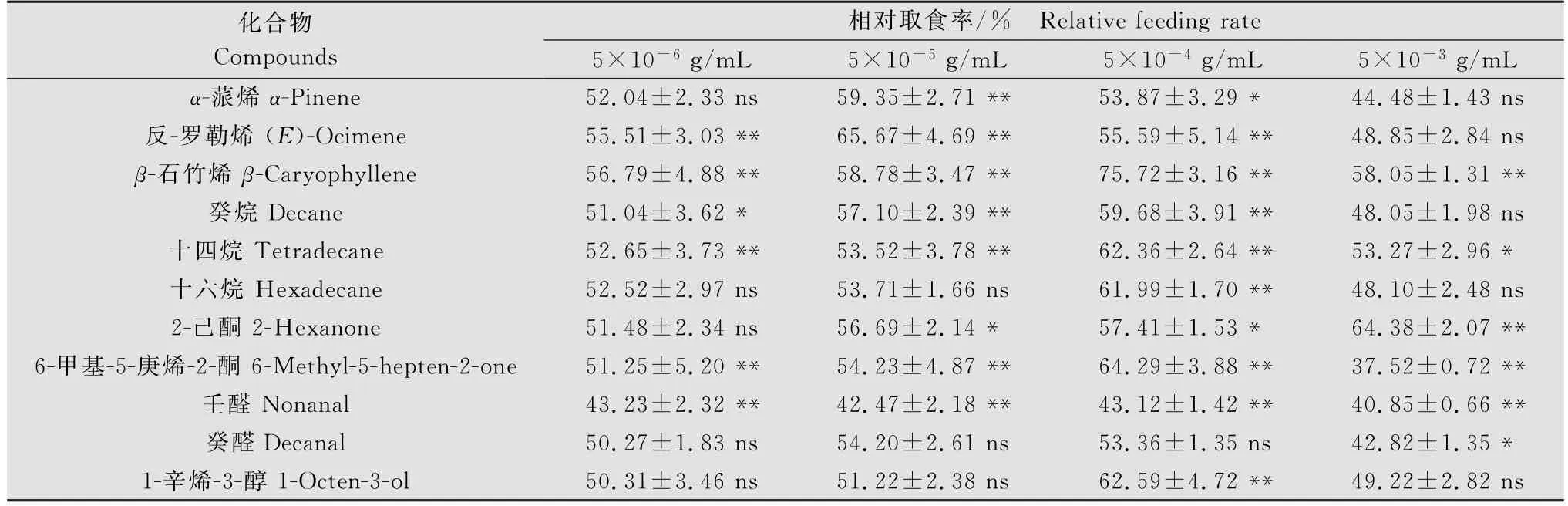
表2 11种挥发物组分对亚洲玉米螟幼虫取食行为的影响1)Table 2 Effects of 11 volatile compounds on feeding behavior of Asian corn borer larvae
国内外已利用水蒸馏法、固相微萃取法、顶空吸附法等对玉米花丝[2022]、玉米籽粒[21,2324]、玉米苞叶[20]的挥发物组分进行了研究。本研究共鉴定出32种挥发物,其中17种挥发物成分在上述研究中已有报道。此外,本研究中发现了11种萜类化合物,如反-罗勒烯、反-4.8-二甲基-1,3,7-壬三烯、(+)-环苜蓿烯、α-古芸烯、β-古芸烯、α-愈创烯、γ-古芸烯、α-花柏烯、γ-杜松烯、δ-杜松烯、α-桉叶油醇和4种脂肪族化合壬烷、癸烷、3-己酮、2-甲基辛酸乙酯,这些物质尚未见报道,这些特有组分可能是由于收集的时间、方法及玉米的品种、部位等差异所导致。
当挥发物样品浓度较高时,6-甲基-5-庚烯-2-酮处理后的饲料对幼虫表现出显著的驱避活性,而在低浓度条件下表现引诱效果。这可能是由于供试化合物的浓度过大,远高于自然状态下的挥发物浓度,导致幼虫出现明显的逃逸反应。因此,挥发物的浓度对昆虫的行为调控起着重要作用。
当挥发物样品浓度较高时,6-甲基-5-庚烯-2-酮处理后的饲料对幼虫表现出显著的驱避活性,而在低浓度条件下表现引诱效果。Huang等[10]的研究发现,在0.5μg浓度条件下,壬醛对亚洲玉米螟初孵幼虫定向行为具有显著的驱避效果,与本研究的结果一致;2-己酮和β-石竹烯对幼虫幼虫定向行为没有影响,而本研究中发现2-己酮(5×10-4、5×10-5、5×10-6g/mL)和β-石竹烯(5×10-3、5×10-4、5×10-5、5×10-6g/mL)对亚洲玉米螟初孵幼虫取食具有引诱作用,这可能是因为试验浓度范围存在差异所导致,也可能是幼虫定向和取食行为之间不具有明显的关联性。
4 结论
本研究从离体玉米果穗挥发物中初步筛选出了对亚洲玉米螟初孵幼虫的取食行为具有引诱作用的组分—β-石竹烯、十四烷、癸烷、反-罗勒烯、6-甲基-5-庚烯-2-酮,以及具有驱避作用的组分—壬醛。
[1] 何奇瑾,周广胜.我国玉米种植区分布的气候适宜性[J].科学通报,2012,57(4):267-275.
[2] 魏湜,曹广才,高杰,等.玉米生态基础[M].北京:中国农业出版社,2010:1-13.
[3] 周大荣,王蕴生,李文德.我国玉米螟优势种的研究[J].植物保护学报,1988(3):147-152.
[4] Dethier V G.Mechanism of host-plant recognition[J].Entomologia Experimentalis et Applicata,1982,31(1):49-56.
[5] Pickett J A,Wadhams L J,Woodcock C M.Insect supersense:mate and host location by insects as model systems for exploiting olfactory interactions[J].The Biochemist,1998,20(4):8-13.
[6] 孔垂华,娄永根.化学生态学前沿[M].北京:高等教育出版社,2010.
[7] 钦俊德.昆虫与植物的关系:论昆虫与植物的相互作用及其演化[M].北京:科学出版社,1987.
[8] 钦俊德,王琛柱.论昆虫与植物的相互作用和进化的关系[J].昆虫学报,2001,44(3):360-365.
[9] 刘海凤,王蕴生,张荣.玉米花丝对亚洲玉米螟抗性的初步研究[J].中国农业科学,1989,20(6):58-63.
[10]Huang C H,Yan F M,Byers J A,et al.Volatiles induced by the larvae of the Asian corn borer(Ostrinia furnacalis)in maize plants affect behavior of conspecific larvae and female adults[J].Insect Science,2009,16(4):311-320.
[11]Udayagiri S,Mason C E.Epicuticular wax chemicals in Zea mays Influence oviposition in Ostrinia nubilalis[J].Journal of Chemical Ecology,1997,23(7):1675-1687.
[12]蒋兴川,谢兴伟,李祥,等.甘蔗,玉米气味对亚洲玉米螟成虫产卵和幼虫取食的影响[J].应用昆虫学报,2014,51(3):615-622.
[13]Flath R A,Forrey R R,John J O,et al.Volatile components of corn silk(Zea mays L.):possible Heliothis zea(Boddie)attractants[J].Journal of Agricultural and Food Chemistry, 1978,26(6):1290-1293.
[14]任顺成,丁霄霖.用气相色谱—质谱法分析玉米须中化学成分的研究[J].玉米科学,2006,14(Z1):148-149.
[15]乔利,郑坚武,成卫宁,等.不同饲料配方对亚洲玉米螟生长发育和繁殖的影响[J].西北农林科技大学学报(自然科学版),2008,36(5):109-112.
[16]莫圣书,赵冬香,陈青.植物挥发物与昆虫行为关系研究进展[J].热带农业科学,2006,26(6):84-89,93.
[17]Mumm R,Schrank K,Wegener R,et al.Chemical analysis of volatiles emitted by Pinussylvestris after induction by insect oviposition[J].Journal of Chemical Ecology,2003,29(5):1235-1252.
[18]Mumm R,Tiemann T,Varama M,et al.Choosy egg parasitoids:Specificity of oviposition-induced pine volatiles exploited by an egg parasitoid of pine sawflies[J].Entomologia Experimentalis et Applicata,2005,115(1):217-225.
[19]彭少麟,南蓬,钟扬.高等植物中的萜类化合物及其在生态系统中的作用[J].生态学杂志,2002,21(3):33-38.
[20]Buttery R G,Ling L C,Chan B G.Volatiles of corn kernels and husks:possible corn ear worm attractants[J].Journal of Agricultural and Food Chemistry,1978,26(4):866-869.
[21]Buttery R G,Ling L C,Teranishi R.Volatiles of corn tassels:possible corn ear worm attractants[J].Journal of Agricultural and Food Chemistry,1980,28(4):771-774.
[22]任顺成,丁霄霖.不同品种玉米须黄酮类含量研究[J].玉米科学,2007,15(6):135-137.
[23]赵阳阳,林海伟,欧仕益.甜玉米籽粒及其芯风味成分分析[J].食品与机械,2011,27(1):52-55.
[24]崔丽静,林家永,周显青,等.顶空固相微萃取与气-质联用法分析玉米挥发性成分[J].粮食储藏,2011,40(1):36-40.
(责任编辑:田 喆)
Effects of volatiles from corn ear on the larval feeding behavior of the Asian corn borer,Ostrinia furnacalis
Xie Xingwei, Yang Zhen, Chen Xiao, Su Guolian, Chen Bin, Yan Naisheng, Dong Wenxia
(College of Plant Protection,Yunnan Agricultural University,Key Laboratory of Agro-Biodiversity and Pest Management of Education Ministry of China,Yunnan Key Laboratory of Agro-Biodiversity and Conservations,Kunming 650201,China)
In order to understand the volatile components of corn ear and their effects on larval feeding behavior of Asian corn borer,Ostrinia furnacalis,the volatile chemicals from corn ear were collected using headspace,and identified by using the gas chromatography-mass spectrometry(GC-MS).The feeding behavior of the first-instar larvae were evaluated by exposing them to 11 selected volatile compounds at four dosages(5×10-6,5×10-5,5× 10-4and 5×10-3g/m L with hexane as solvent).There were 32 compounds identified,including green leaf volatiles(GLV),terpenoids,and aliphatic compounds.The content of terpenoids was the highest,reaching 84.40% of total compounds.β-Caryophyllene and tetradecane showed significant attractant effect on larval feeding behavior at all tested concentrations,but nonanal showed significant repellent effect.Decane,(E)-ocimene and 6-methyl-5-hepten-2-one showed significant attractant effect except at the concentration of 5×10-3g/m L.
Ostrinia furnacalis; corn ear; plant volatile; feeding behavior
S 435.132,Q 968.1
A
10.3969/j.issn.0529-1542.2015.06.016
2014-09-17
2015-01-20
国家“973”计划项目(2011CB100404);云南农业大学学生科技创新创业基金项目(2013ZK031)
致 谢: 感谢中国科学院昆明植物研究所余珍老师在植物挥发物鉴定上给予帮助。
*通信作者 E-mail:dongwenxia@163.com
#同等贡献,为并列第一作者

