转化生长因子-β1对大鼠心房、心室成纤维细胞胶原表达的影响
刘发金,肖骅,唐雪娇,张磊
论 著
转化生长因子-β1对大鼠心房、心室成纤维细胞胶原表达的影响
刘发金,肖骅,唐雪娇,张磊
目的观察转化生长因子-β1(TGF-β1)对大鼠心房、心室成纤维细胞胶原蛋白表达的不同影响,并探讨其可能的分子机制。方法用组织贴块法培养大鼠原代心房、心室成纤维细胞,经SABC免疫细胞化学染色方法鉴定细胞,分别进行以下实验:①应用羟脯氨酸消化法观察不同浓度TGF-β1(0、5、10ng/ml)及不同作用时间(6、12、24、48h)对心房、心室成纤维细胞羟脯氨酸含量的影响。②用筛选的TGF-β1最佳干预浓度及作用时间分别刺激心房、心室成纤维细胞,Western blotting检测α-平滑肌肌动蛋白(α-SMA)鉴定肌成纤维细胞后,采用羟脯氨酸法比较两种细胞培养液中羟脯氨酸的表达情况,RT-PCR检测二者Ⅰ、Ⅲ型胶原蛋白的mRNA表达,Western blotting检测二者Smad2/3、p-Smad2/3及Smad7蛋白的表达情况。结果TGF-β1对大鼠心房、心室成纤维细胞均具有促进胶原蛋白合成的作用,当TGF-β1刺激条件为5ng/ml、24h时作用最强。用上述条件TGF-β1刺激心房、心室成纤维细胞,与对照组相比,心房成纤维细胞Ⅰ、Ⅲ型胶原蛋白,p-Smad2/3表达增加,Smad7表达降低,差异有统计学意义(P<0.05);心房成纤维细胞TGF-β1刺激组与心室成纤维细胞TGF-β1刺激组相比,两组Smad2/3的表达差异无统计学意义,但心房成纤维细胞TGF-β1刺激组Ⅰ、Ⅲ型胶原蛋白,p-Smad2/3的表达明显升高,Smad7的表达明显降低(P<0.05)。结论TGF-β1能诱导心脏成纤维细胞转化为肌成纤维细胞,可引起细胞胶原代谢异常,而且心房成纤维细胞中胶原代谢异常表现较心室成纤维细胞明显,其机制可能与TGF-β1/SMAD信号通路相关。
转化生长因子β1;心房颤动;胶原;Smads蛋白质类
心房颤动(atrial fibrillation,AF)是临床上最常见的持续性心律失常,结构重构被认为是AF的发生和维持基础,而心房纤维化是最主要的结构重构改变[1-3]。转化生长因子-β1(transforming growth factor beta 1,TGF-β1)已被证实可诱发心肌细胞肥厚和心肌纤维化[4],能诱导成纤维细胞分化为以α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)为表型标志的肌成纤维细胞[5]。而肌成纤维细胞可产生大量的细胞外基质(ECM),如collagenⅠ、Ⅲ、纤连蛋白及弹性蛋白等促进心肌纤维化[6]。研究发现,过度表达TGF-β1的转基因小鼠,其心房的选择性纤维化和AF易损性均增加[7-8]。本研究探索成纤维细胞在心脏基质重构及心房选择性纤维化中的作用,并探索可能参与这一过程的Smad信号转导分子,以期为AF抗纤维化治疗的探索提供思路。
1 材料与方法
1.1 实验动物及主要试剂 清洁级2周龄SD大鼠购自重庆医科大学实验动物中心,体重60~80g,雌雄不限。主要试剂:DMEM-F12(1:1)培养基、胎牛血清(美国Gibco公司),重组人TGF-β1(美国Peprotech公司),兔抗波形蛋白抗体(美国Proteintech公司),兔抗Smad2、Smad3、p-Smad2(phospho S467)、p-Smad3 (phospho S423+S425)、Smad7抗体(美国Abcam公司),兔抗α-SMA抗体(美国CST公司),辣根过氧化物酶(HRP)标记的山羊抗兔二抗(美国Abbkine公司),羟脯氨酸检测试剂盒(南京建成公司),RT-PCR试剂盒(日本TaKaRa公司),蛋白裂解试剂盒、蛋白测定试剂盒(碧云天公司)。
1.2 方法
1.2.1 原代心肌成纤维细胞的培养与鉴定 取SD大鼠2只,在无菌条件下开胸取心脏置于培养皿中,分离心脏及大血管等结缔组织,采用4℃ 0.01mol/L PBS清洗分离的心房及心室组织,并将心房、心室组织剪成约1mm3大小种于6孔板中,5%CO2、37℃孵育约2~4h后加入含20%FBS的DMEM培养液进行培养。每隔3d换液一次,实验采用培养的第3~5代细胞。采用波形蛋白免疫组化染色鉴定心肌成纤维细胞。中性树胶封固后在光学显微镜下观察胞质染色是否呈棕黄色并进行纯度计算。
1.2.2 筛选构建心肌纤维化细胞模型的最佳条件
取第3代生长良好的心房、心室成纤维细胞,用20%FBS的DMEM培养液培养至80%~90%,换用无血清DMEM培养基饥饿细胞24h。①筛选TGF-β1最佳刺激浓度,将心房、心室成纤维细胞分为3组:对照组(加入DMEM培养基干预24h)和5、10ng/ ml TGF-β1刺激组(分别加入终浓度为5、10ng/ml TGF-β1培养基干预24h)。羟脯氨酸法检测细胞上清液中羟脯氨酸含量。②用筛选出的最佳浓度的TGF-β1刺激心房、心室成纤维细胞不同时间,筛选最佳刺激时间,实验分为对照组及TGF-β1刺激组,分别加入DMEM及终浓度为5ng/ml TGF-β1培养基干预6、12、24、48h,同样用羟脯氨酸法检测细胞上清液内羟脯氨酸含量。
1.2.3 TGF-β1诱导心房、心室成纤维细胞胶原蛋白的差异表达 将心房、心室成纤维细胞分为4组。①心室成纤维细胞对照组:加入DMEM培养基作用24h;②心室成纤维细胞TGF-β1刺激组:加入终浓度为5ng/ml TGF-β1培养基刺激24h;③心房成纤维细胞对照组:加入DMEM培养基作用24h;④心房成纤维细胞TGF-β1刺激组:加入终浓度为5ng/ ml TGF-β1培养基刺激24h。采用羟脯氨酸检测试剂盒、RT-PCR检测胶原蛋白的表达,Western blotting检测α-SMA、Smad2、Smad3、p-Smad2、p-Smad3 和Smad7蛋白的表达。
1.2.4 细胞培养上清液羟脯氨酸含量检测 采用羟脯氨酸试剂盒检测细胞培养上清液中羟脯氨酸含量,按操作说明书操作,最后在550nm处测各管吸光度(A)值。羟脯氨酸含量=(测定A值-空白A值)/(标准A值-空白A值)×标准品浓度。
1.2.5 RT-PCR检测Ⅰ、Ⅲ型胶原蛋白mRNA的表达 用RNA提取试剂(RNAiso plus)提取各组细胞总RNA,根据不同引物反转录为cDNA,进行反转录-聚合酶链反应。引物序列为:Ⅰ型胶原蛋白,上游5'-CGAGTATGGAAGCGAAGGT-3',下游5'-CCACAAGCGTGCTGTAGGT-3',产物长度230bp;Ⅲ型胶原蛋白,上游5'-CCACCCTGAACTC AAGAGC-3',下游5'-TGAACTGAAAGCCACCATT-3',产物长度212bp;β-actin,上游5'-AGATGACCCAGA TCATGTTTGA-3',下游5'-TTGGCATAGAGGTCTT TA-3',产物长度535bp。反应体系25μl,PCR扩增条件:94℃预变性5min;94℃变性45s、42℃(Ⅰ/Ⅲ型胶原蛋白)/58℃(β-actin)退火45s、72℃ 1min,循环35次;72℃再延伸10min。扩增产物用2%琼脂糖凝胶电泳后,采用Quantity One系统分析电泳条带的光密度值。
1.2.6 Western blotting检测α-SMA、Smad2/3、p-Smad2/3和Smad7蛋白的表达 RIPA蛋白裂解液收集各组细胞的蛋白质,BCA法测定蛋白浓度。SDS-PAGE电泳分离、电转至PVDF膜,5%脱脂牛奶室温封闭后,加入1:1000稀释的兔抗α-SMA、兔抗Smad2、兔抗Smad3、兔抗p-Smad2、兔抗p-Smad3和兔抗Smad7抗体,4℃过夜后,TBST洗膜3次,再加入1:2000稀释的HRP标记的二抗,室温孵育1h,洗膜,DAB显色,拍照。Quantity One系统进行电泳条带光密度值分析。
1.3 统计学处理 采用SPSS 21.0软件进行数据分析。计量资料以表示,两组间比较采用Tukey检验,多组间比较采用单因素方差分析(One-way ANOVA)。P<0.05为差异有统计学意义。
图1 心脏成纤维细胞光镜图(×200)Fig.1 Morphology of cardiac fibroblasts under light microscope (×200)A, C. Atrial fibroblasts growth 3, 7 days; B, D. Ventricular fibroblasts growth 3, 7 days

图2 原代成纤维细胞的鉴定(SABC ×200)Fig.2 Identification of the cardiac fibroblasts (SABC ×200)A. Atrial fibroblasts; B. Ventricular fibroblasts

图3 不同浓度TGF-β1刺激心脏成纤维细胞后羟脯氨酸的表达Fig.3 Expression of hydroxyproline in cardiac fibroblasts induced by different concentration of TGF-β1A. Atrial fibroblasts; B. Ventricular fibroblasts; (1)P<0.05 compared with control group (0ng/ml)
2 结 果
2.1 大鼠心肌成纤维细胞的培养
2.1.1 倒置显微镜下成纤维细胞的观察结果 成纤维细胞可于组织块贴壁后24h开始长出,贴壁3d后细胞呈长梭形或不规则三角形,细胞质透明,中央有卵圆核,胞质向外伸出突起,放射状或蜗旋状生长(图1A、B)。第7~9天后组织块间的细胞相互汇合、连接成片,甚至出现重叠生长(图1C、D)。
2.1.2 大鼠心肌成纤维细胞的鉴定 心肌细胞增殖能力低,故组织贴块法培养的细胞为成纤维细胞和少量上皮细胞混杂生长。波形蛋白免疫组化染色呈强阳性反应,几乎所有细胞的胞质均呈棕黄色,苏木素复染,细胞核呈淡蓝色,阳性率>99%(图2)。
2.2 筛选TGF-β1刺激大鼠心肌成纤维细胞的最佳条件 刺激心房、心室成纤维细胞24h后,与对照组相比,TGF-β1刺激组细胞培养上清液中羟脯氨酸含量均明显增加,浓度为5ng/ml时羟脯氨酸含量最高,说明TGF-β1能促进大鼠心房、心室成纤维细胞分泌胶原,5ng/ml为最佳刺激浓度(图3)。
TGF-β1刺激心房成纤维细胞后,细胞培养上清液中羟脯氨酸含量较对照组明显增加,刺激24h时细胞上清液中羟脯氨酸含量达到峰值(P<0.01,图4A),而TGF-β1促进心室成纤维细胞羟脯氨酸的合成作用呈时间依赖性,但24h组与48h组羟脯氨酸的表达差异无统计学意义(图4B)。
2.3 TGF-β1诱导心房、心室成纤维细胞胶原蛋白的差异表达
2.3.1 心房、心室成纤维细胞中α-SMA的表达变化 从上述实验得出的结果,将诱导条件TGF-β1(5ng/ml,24h)用于后续实验。Western blotting检测结果显示,与心房、心室成纤维细胞对照组相比,心房、心室成纤维细胞TGF-β1刺激组中α-SMA蛋白的表达均明显增加(P<0.01);与心室成纤维细胞TGF-β1刺激组比较,心房成纤维细胞TGF-β1刺激组α-SMA蛋白的表达升高(P<0.05,图5),提示心房成纤维细胞可能更易分化为肌成纤维细胞。
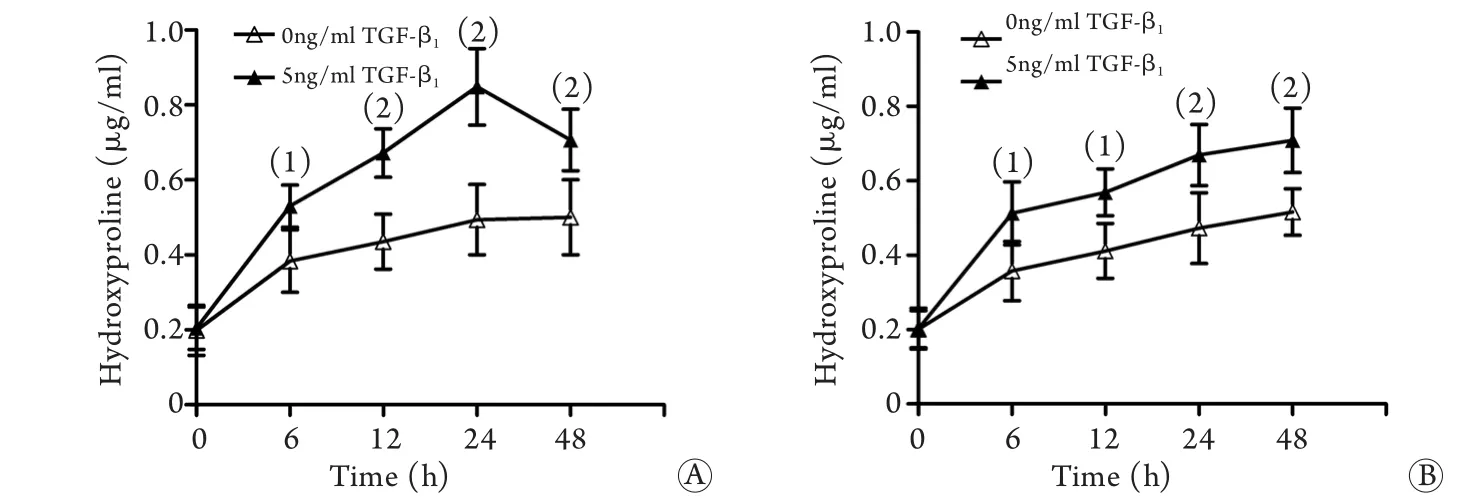
图4 TGF-β1刺激心脏成纤维细胞不同时间羟脯氨酸的表达Fig. 4 Expression of hydroxyproline in cardiac fibroblasts induced by TGF-β1at different time pointsA. Atrial fibroblasts; B. Ventricular fibroblasts. (1)P<0.05, (2)P<0.01 compared with control group (0ng/ml TGF-β1)

图5 TGF-β1干预的各组成纤维细胞α-SMA蛋白的表达(Western blotting)Fig.5 Protein expression of α-SMA in cardiac fibroblasts induced by TGF-β1in each group (Western blotting)1. Control group (ventricular fibroblasts); 2. TGF-β1stimulation group (ventricular fibroblasts); 3. Control group (atrial fibroblasts); 4. TGF-β1stimulation group (atrial fibroblasts). (1)P<0.01 compared with control group; (2)P<0.05 compared with TGF-β1stimulation group (ventricular fibroblasts)
2.3.2 心房、心室成纤维细胞中羟脯氨酸的差异表达 与心室成纤维细胞对照组(0.53±0.09)相比,心室成纤维细胞TGF-β1刺激组的羟脯氨酸表达量增加(0.74±0.10,P<0.05),与心房成纤维细胞对照组(0.55±0.10)比较,心房成纤维细胞TGF-β1刺激组羟脯氨酸的表达明显增加(0.89±0.15,P<0.01);与心室成纤维细胞TGF-β1刺激组相比,心房成纤维细胞TGF-β1刺激组的羟脯氨酸表达明显升高(P<0.01),提示TGF-β1促进心房成纤维细胞分泌胶原蛋白的作用可能较心室成纤维细胞更强。
2.3.3 心房、心室成纤维细胞Ⅰ、Ⅲ型胶原蛋白mRNA的差异表达 与对照组相比,仅心房成纤维细胞Ⅰ、Ⅲ型胶原蛋白mRNA的表达明显升高(P<0.01);与心室成纤维细胞TGF-β1刺激组相比,心房成纤维细胞TGF-β1刺激组内Ⅰ、Ⅲ型胶原蛋白mRNA的表达明显升高(P<0.01,图6)。提示TGF-β1促进心房成纤维细胞合成胶原蛋白的作用较心室成纤维细胞更强。
2.3.4 心房、心室成纤维细胞Smad2/3、p-Smad2/3 和Smad7蛋白的差异表达 与对照组相比,心房成纤维细胞TGF-β1刺激组p-Smad2/3表达明显增加,Smad7表达明显降低(P<0.01),而心室成纤维细胞TGF-β1刺激组无明显变化;与心室成纤维细胞TGF-β1刺激组比较,心房成纤维细胞TGF-β1刺激组p-Smad2/3表达明显升高(P<0.01),Smad7表达明显降低(P<0.01),而Smad2/3表达差异无统计学意义(图7)。结果提示,p-Smad2/3及Smad7可能参与了心房成纤维细胞对TGF-β1易感性。
3 讨 论
AF是临床上最常见的一种心律失常,随年龄增长其发病率逐渐增加[9]。目前,虽然药物和导管消融治疗可使AF得到一定程度的控制,但药物治疗转复率低,导管消融治疗仅能用于部分患者[10]。研究发现,结构重构是AF发生和发展的核心环节,心房纤维化能显著影响AF导管消融的疗效[11]。针对AF心房重构的抗重塑治疗已引起人们的关注[12]。

图6 TGF-β1干预后各组成纤维细胞Ⅰ、Ⅲ型胶原mRNA的表达(RT-PCR)Fig.6 mRNA expression of type Ⅰand Ⅲ collagen in cardiac fibroblasts induced by TGF-β1in each group (RT-PCR)M. Marker; 1. Control group (ventricular fibroblasts); 2. TGF-β1stimulation group (ventricular fibroblasts); 3. Control group (atrial fibroblasts); 4. TGF-β1stimulation group (atrial fibroblasts). (1)P<0.01 compared with control group; (2)P<0.01 compared with TGF-β1stimulation group (ventricular fibroblasts)
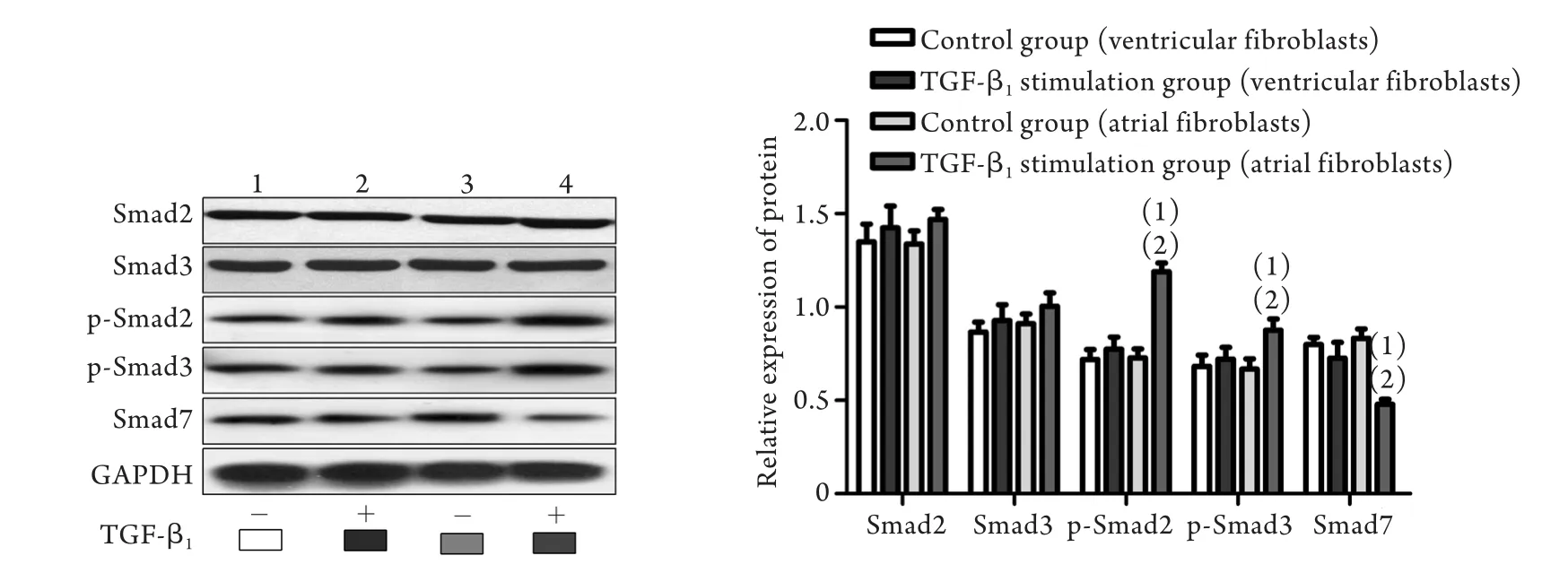
图7 Western blotting检测各组细胞Smad2/3、p-Smad2/3、Smad7蛋白的水平Fig.7 Western blotting analysis of the protein expression of Smad2/3, p-Smad2/3 and Smad7 in cardiac fibroblasts1. Control group (ventricular fibroblasts); 2. TGF-β1stimulation group (ventricular fibroblasts); 3. Control group (atrial fibroblasts); 4. TGF-β1stimulation group (atrial fibroblasts). (1)P<0.01 compared with control group; (2)P<0.01 compared with TGF-β1stimulation group (ventricular fibroblasts)
AF的病理生理机制十分复杂,心房结构重构与AF关系密切,心肌纤维化是最主要的结构重构改变。心肌纤维化是胶原合成与分解代谢失衡的结果[13],特征是ECM蛋白的过度沉积,如Ⅰ、Ⅲ型胶原蛋白,纤连蛋白等[14]。研究发现,成纤维细胞是ECM产生的主要来源,可经TGF-β1刺激后增殖并转化为肌成纤维细胞[15-16]。肌成纤维细胞合成ECM的能力显著高于成纤维细胞,且可分泌多种促纤维化细胞因子。可见,成纤维细胞在心肌纤维化的发病机制中起着重要作用。
本研究通过观察不同浓度TGF-β1作用不同时间对心房、心室成纤维细胞羟脯氨酸合成的影响,筛选出TGF-β1刺激浓度5ng/ml、作用24h对成纤维细胞的作用较强。TGF-β1是一种关键的致纤维化因子,是加速心房纤维化的主要因素之一[17-18]。研究发现,在风湿性心脏病继发的慢性AF患者中,TGF-β1的表达明显上升[19]。原发性高血压尤其是伴有靶器官损害的患者血清内亦可见TGF-β1的明显升高[20]。TGF-β1可以从4个独立但同时进行的途径启动纤维化:①直接刺激ECM蛋白的合成;②通过减少蛋白酶表达,增加蛋白酶抑制剂的合成抑制基质蛋白的降解;③调节对细胞整合素的表达,从而提高细胞基质之间相互作用;④通过自动感应显著放大其生物作用[21]。TGF-β1因可促进心脏成纤维细胞产生ECM而在体外实验中被广泛应用,目前实验研究中TGF-β1的使用浓度多集中在5~10ng/ml,可见,筛选体外实验中TGF-β1诱导成纤维细胞的最佳条件,可以更好地建立心肌纤维化模型,有利于后续实验的进行。
本研究通过外源性添加TGF-β1诱导细胞分化,在心房、心室成纤维细胞内均检测到α-SMA蛋白表达增加,表明TGF-β1能成功诱导心房、心室成纤维细胞分化为肌成纤维细胞。我们还发现,与心室成纤维细胞比较,α-SMA的表达在心房成纤维细胞内显著增加,提示心房成纤维细胞较心室成纤维细胞可能更易分化为肌成纤维细胞。心肌间质胶原网络主要是由肌成纤维细胞产生和分泌的Ⅰ、Ⅲ型胶原组成,其中Ⅰ型胶原约占总数的80%~85%,Ⅲ型胶原约占12%[22-23],对细胞培养上清液中羟脯氨酸含量进行测定,可以了解心脏成纤维细胞分泌的总胶原的表达情况,也可以间接反映Ⅰ、Ⅲ型胶原的蛋白水平。因此,用羟脯氨酸测试盒、RT-PCR对两种细胞胶原蛋白的mRNA水平及蛋白水平进行检测,同样观察到Ⅰ、Ⅲ型胶原蛋白mRNA及蛋白的表达在心房成纤维细胞内增加更明显。提示TGF-β1促进胶原合成与分泌的能力在心房、心室成纤维细胞间存在差异,推测可能与心房成纤维细胞更易转变为肌成纤维细胞有关。
TGF-β1/SMAD被认为是AF结构重构的关键信号通路。研究发现,TGF-β1诱导的AF主要与p-Smad2和Smad7的改变有关。本研究用Western blotting检测心房、心室成纤维细胞Smad2/3、p-Smad2/3和Smad7蛋白的表达,结果显示,与对照组比较,仅心房成纤维细胞TGF-β1刺激组p-Smad2/3表达明显增加,Smad7表达明显下降;而Smad2/3的表达在心房、心室成纤维细胞中差异无统计学意义。与心室成纤维细胞TGF-β1刺激组比较,心房成纤维细胞TGF-β1刺激组p-Smad2/3的表达明显增加,Smad7的表达明显下降。我们发现,TGF-β1可以选择性刺激心房成纤维细胞α-SMA,Ⅰ、Ⅲ型胶原蛋白的表达,同时也选择性影响心房成纤维细胞p-Smad2/3、Smad7的蛋白表达,提示p-Smad2/3及Smad7可能是TGF-β1选择性促心房成纤维细胞合成α-SMA、胶原蛋白的重要信号分子,在后续实验中,我们将利用基因工程的方法进一步予以证实。
本研究结果发现,在TGF-β1构建的心肌纤维化体外刺激模型中,心房成纤维细胞可能较心室成纤维细胞更易转化为肌成纤维细胞,继而产生大量胶原蛋白参与细胞间质重构,提示心房成纤维细胞可能对TGF-β1的敏感性更强,这也许是心房纤维化易损性较高的原因,其机制可能与TGF-β1/SMAD信号通路有关。本研究有利于更好的理解AF的发病机理,也为探索中断心房这种特异性反应的干预治疗措施提供了实验基础。
[1]Xiao H, Lei H, Qin S,et al. TGF-beta1 expression and atrial myocardium fibrosis increase in atrial fibrillation secondary to rheumatic heart disease[J]. Clin Cardiol, 2010, 33(3):149-156.
[2]Li Y, Ma RY, Chen L,et al. Expression and significance of TGF-β1signal pathway in atrium of patients with valvular heart diseases complicated by atrial fibrillation[J]. Med J Chin PLA, 2011, 36(11):1159-1162. [李勇, 马瑞彦, 陈林, 等. TGF-β1信号通路在瓣膜病合并房颤患者心房中的表达变化及意义[J]. 解放军医学杂志, 2011, 36(11):1159-1162.]
[3]Sun XL, Bu PL, Liu JN,et al. Relationship between SIRT1 expression in atrial tissue and atrial fibrosis in patients with atrial fibrillation[J]. J Shandong Univ (Health Sci), 2012, 50(9):68-72. [孙雪林, 卜培莉, 刘军妮, 等. 心房颤动患者心房组织SIRT1表达与心房纤维化的相关性[J]. 山东大学学报(医学版), 2012, 50(9):68-72.]
[4]Sheng W, Li LB, Lu JY. Role of TGF-β, MMPs and TIMPs in persistent atrial fibrillation associated with rheumatic mitral stenosis[J]. Med J Chin PLA, 2014, 39(8):614-617. [盛炜, 李力兵, 陆江阳. TGF-β、MMPs和TIMPs在风湿性心脏病二尖瓣狭窄合并持续性房颤中的作用[J]. 解放军医学杂志, 2014, 39(8):614-617.]
[5]Leask A. Getting to the heart of the matter:new insights into cardiac fibrosis[J]. Circ Res, 2015, 116(7):1269-1276.
[6]Xiao H. Mechanisms of atrial fibrosis in patients with rheumatic heart disease (RHD) and atrial fibrillation[D]. Chongqing medical university doctoral dissertation, 2008. 05. [肖骅. 风湿性心脏病房颤患者心房纤维化机制的初步研究[D]. 重庆医科大学博士论文, 2008. 05.]
[7]Park SJ, On YK, Kim JS,et al. Transforming growth factor β1-mediated atrial fibrotic activity and the recovery of atrial mechanical contraction after surgical maze procedure[J]. Int J Cardiol, 2013, 164(2):232-237.
[8]Nakajima H, Nakajima HO, Salcher O,et al. Atrial but not ventricular fibrosis in mice expressing a mutant transforming growth factor-beta(1) transgene in the heart[J]. Circ Res, 2000, 86(5):571-579.
[9]Ball J, Carrington MJ, McMurray JJ,et al. Atrial fibrillation:Profile and burden of an evolving epidemic in the 21st century[J]. Int J Cardiol, 2013, 167(5):1807-1824.
[10]Chen AH, Song XD, Yang PZ. Current status and dilemma of radiofrequency ablation for atrial fibrillation[J]. Med J Chin PLA, 2015, 40(2):85-91. [陈爱华, 宋旭东, 杨平珍. 房颤射频消融治疗的现状与困境[J]. 解放军医学杂志, 2015, 40(2):85-91.]
[11]Peng ZH, Liu ZZ. Risk factors of recurrence of atrial fibrillation after catheter ablation[J]. Adv Cardiovasc Dis, 2011, 32(5):707-711.
[12]Dobrev D, Nattel S. New antiarrhythmic drugs for treatment of atrial fibrillation[J]. Lancet, 2010, 375(9721):1212-1223.
[13]Zhu F, Li Y, Zhang J,et al. Senescent cardiac fibroblast is critical for cardiac fibrosis after myocardial infarction[J]. PloS One, 2013, 8(9):e74535.
[14]Karagueuzian HS. Targeting cardiac fibrosis:a new frontier in antiarrhythmic therapy[J]. Am J Cardiovasc Dis, 2011, 1(2):101-109.
[15]Fletcher DA, Mullins RD. Cell mechanics and thecytoskeleton[J]. Nature, 2010, 463(7280):485-492.
[16]MacLean J, Pasumarthi KB. Signaling mechanisms regulating fibroblast activation, phenoconversion and fibrosis in the heart[J]. Indian J Biochem Biophys, 2014, 51(6):476-482.
[17]Mariscalco G, Engstrom KG, Ferrarese S,et al. Relationship between atrial histopathology and atrial fibrillation after coronary bypass surgery[J]. J Thorac Cardiovasc Surg, 2006, 131(6):1364-1372.
[18]Lei B, Hitomi H, Mori T,et al. Effect of efonidipine on TGF-β1-induced cardiac fibrosis through Smad2-dependent pathway in rat cardiac fibroblasts[J]. J Pharmacol Sci, 2011, 117(2):98-105.
[19]Li Y, Jian Z, Yang ZY,et al. Increased expression of connective tissue growth factor and transforming growth factor-beta-1 in atrial myocardium of patients with chronic atrial fibrillation[J]. Cardiology, 2013, 124(4):233-240.
[20]Lin X, Wu N, Wang S,et al. Association between transforming growth factor β1and atrial fibrillation in essential hypertensive patients[J]. Clin Exp Hypertens, 2015, 37(1):82-87.
[21]Kishore A, Vail A, Majid A,et al. Detection of atrial fibrillation after ischemic stroke or transient ischemic attack:A systematic review and meta-analysis[J]. Stroke, 2014, 45(2):520-526.
[22]Zhou DY, Huang J, Sheng WW,et al. Effects of human fibroblast growth factor-2 on ventricular remodeling after acute myocardial infarction in rats[J]. Med J Chin PLA, 2009, 34(6):691-694. [周大燕, 黄晶, 盛娓娓, 等. 成纤维细胞生长因子对大鼠急性心肌梗死后心室重构的影响[J]. 解放军医学杂志, 2009, 34(6):691-694.]
[23]Liu BC, Sun LL, Wang HY,et al. Effect of hydrogen sulfide on collagen synthesis in rat cardiomyocytes through down regulation of TGF-β1/Smad2/3 signaling pathway[J]. Med J Chin PLA, 2014, 39(9):681-684. [刘百川, 孙莉莉, 王海英, 等. 硫化氢下调TGF-β1/Smad2/3通路对大鼠心肌细胞胶原合成的影响[J]. 解放军医学杂志, 2014, 39(9):681-684.]
Effect of TGF-β1on the expression of collagen in rat atrial and ventricular fibroblasts
LIU Fa-jin, XIAO Hua*, TANG Xue-jiao, ZHANG Lei
Department of Cardiology, First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
*< class="emphasis_italic">Corresponding author, E-mail: xiaohua197408@163.com
, E-mail: xiaohua197408@163.com
This work was supported by the National Natural Science Foundation of China (81300140)
ObjectiveTo observe the effect of transforming growth factor beta 1 (TGF-β1) on the expression of collagen in rat atrial and ventricular fibroblasts, and to investigate its specific molecular mechanisms.MethodsTissue explant attachment was used to culture fibroblasts obtained from the atrium and ventricle of rat heart, and they were identified with SABC immunocytochemical staining, and then the following experiments were carried out. (1) Hydroxyproline digestion was performed to study the effects of TGF-β1, within different concentrations (0, 5, 10ng/ml) and different action time (6, 12, 24, 48h) on the content of hydroxyproline in rat's atrial and ventricular fibroblasts. (2) Rat's atrial and ventricular fibroblasts were stimulated with TGF-β1in optimal concentration and action time, the expression of α-smooth muscle actin (α-SMA) was determined with Western blotting, and the expressions of typeⅠand Ⅲ collagen mRNA were evaluated with reverse-transcription PCR. The contents of hydroxyproline in the respective cells were measured with hydroxyproline determination. Western blotting was used to measure the protein expression of Smad2/3, p-Smad2/3 and Smad7.Results(1) TGF-β1was shown to stimulate the collagen synthesis in rat's atrial and ventricular fibroblasts, and the optimal stimulus was TGF-β1concentration 5ng/ml with action time of 24h. (2) After being stimulated by optimal stimulation effect of TGF-β1, the expression of typeⅠand Ⅲ collagen and p-Smad2/3 increased, while that of Smad7 decreased significantly only in atrial fibroblasts (P<0.05), but not in ventricular fibroblasts. No statistical difference was found in the expression of Smad2/3 between the atrial and ventricular fibroblasts after being stimulated by TGF-β1under optimal stimulating conditions.ConclusionTGF-β1can induce dysbolism of collagen of cardiac fibroblasts with abnormal expression of cytoskeletal protein, which may occur more obviously in rat's atrial fibroblasts than in ventricular fibroblasts, and its mechanism may be related with TGF-β1/SMAD pathway.
transforming growth factor beta 1; atrial fibrillation; collagen; Smad proteins
R541.75
A
0577-7402(2015)07-0540-07
10.11855/j.issn.0577-7402.2015.07.06
2015-03-12;
2015-05-29)
(责任编辑:张小利)
国家自然科学基金面上项目(81300140)
刘发金,硕士研究生。主要从事心房颤动机制的研究
400016 重庆 重庆医科大学附属第一医院心内科(刘发金、肖骅、唐雪娇、张磊)
肖骅,E-mail:xiaohua197408@163.com

