细胞型朊蛋白(PrPC)在直肠癌和直肠腺瘤中的表达及其临床意义
李卫平,张江南
·临床研究·
细胞型朊蛋白(PrPC)在直肠癌和直肠腺瘤中的表达及其临床意义
李卫平,张江南
目的检测细胞型朊蛋白(PrPC)在正常直肠黏膜、直肠腺瘤及直肠癌组织中的表达情况,并探讨其与直肠癌发生发展的关系。方法采用免疫组化SP法检测PrPC在直肠癌(60例)、直肠腺瘤(20例)及正常直肠组织(20例)中的表达水平,并分析其在直肠癌组织中的表达与患者性别、肿瘤分化程度、临床分期及淋巴结转移等临床病理参数的相关性。结果PrPC在正常直肠、直肠腺瘤及直肠癌中均有表达,在直肠癌中的阳性表达率为65%(39/60),明显高于直肠腺瘤(35%)及正常直肠组织(15%),差异有统计学意义(P<0.01)。相关分析显示,PrPC在直肠癌中的表达与肿瘤分化程度、TNM分期及淋巴结转移密切相关(P<0.05),与患者的性别、年龄、肿瘤位置及肿瘤大小无明显相关性(P>0.05)。结论PrPC可能在直肠癌的发生发展及转移过程中发挥重要作用。
朊病毒;直肠肿瘤;病理学,临床
直肠癌是人类消化道常见的恶性肿瘤之一,其发病率在全球范围内呈逐年上升趋势,由于早期临床症状不明显,患者就诊时大多属中晚期,目前手术切除仍是主要的治疗方法,但术后总的5年生存率仅60%左右[1],因此寻找直肠癌肿瘤标志物对其早发现、早诊断、早治疗具有十分重要的意义[2]。细胞型朊蛋白(cellular prion protein,PrPC)广泛存在于多种正常组织器官,在哺乳动物中非常保守,但其生理功能并不十分清楚。有研究发现PrPC在胃癌、胰腺癌、肠癌和乳腺癌等癌细胞中均有较高表达且能增进癌细胞的转移、扩增和抗药性,提示其与人类多种肿瘤的发生、发展、侵袭及转移等有密切关系[3-6]。PrPC在直肠癌中的表达及意义目前国内外尚未见报道,本研究应用免疫组化SP法检测PrPC在正常直肠黏膜、直肠腺瘤及直肠癌组织中的表达情况,初步探讨其在直肠癌的发生、发展及转移中的作用,为直肠癌的预防、诊断及治疗提供新的研究思路。
1 资料与方法
1.1 一般资料 选取南昌大学第一附属医院胃肠外科2013年6月-2014年4月手术切除的直肠癌标本60例,其中男32例,女28例,年龄51.2±3.6岁(36例年龄≥60岁,24例年龄<60岁),中/高位(距齿状线5cm以上)35例,低位(距齿状线5cm以下)25例,术后标本检查肿瘤大小(以最大直径计算)≥3cm者30例,<3cm者30例,中/高分化及低分化者分别为42例和18例,根据美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)结直肠癌TNM分期(第7版)[7],Ⅰ-Ⅱ期及Ⅲ-Ⅳ期者分别为22例及38例,有淋巴结转移与无淋巴结转移者分别为36例及24例。同期收集直肠腺瘤和正常直肠(距癌肿2cm之外,经HE染色证实为无病变组织)标本各20例作为对照。所有入选患者资料齐全,术前无放化疗史,术后经病理确诊。
1.2 主要试剂及仪器 兔抗人PrPC多克隆抗体(ab6664)购于美国Abcam公司,生物素化山羊抗兔HRP-conjugated IgG二抗、DAB显色试剂盒、正常山羊血清、链霉菌抗生物素蛋白-过氧化酶(streptavidin-peroxidase,SP)、苏木素及0.5%伊红染色液等均购于福州迈新生物技术开发有限公司;光学显微镜(CKX41-F32F)为日本Olympus公司产品,石蜡切片机、石蜡包埋机为德国Leica公司产品,–80℃超低温冰箱为美国Thermo Scientific公司产品,图像采集系统为法国JENA公司产品。
1.3 免疫组化检测 所有标本取石蜡包埋,行4μm连续切片,60℃恒温箱中烘干后保存,石蜡切片依次经脱蜡、水化后,3%H2O2浸泡10min以灭活内源性过氧化物酶,PBS浸泡5min,再加入柠檬酸缓冲液于高压锅中煮沸10min修复抗原,滴加正常山羊血清封闭抗原,然后加入PBS液稀释兔抗人PrPC多克隆抗体(1:200),4℃过夜,PBS清洗3次,加入山羊抗兔HRP-conjugated IgG二抗室温孵育1h,PBS清洗3次,滴加SP,DAB显色,蒸馏水冲洗,苏木素复染,脱水,二甲苯透明及中性树胶封片后镜检。以PBS代替一抗作为阴性对照。
1.4 结果判定 显微镜下观察到胞核和(或)胞质呈棕色或黄色判定为阳性着色,随机选取10个200倍视野,计数1000个细胞,根据每个视野中阳性细胞比例和染色深浅对组织染色进行赋值。阳性细胞比例<10%计0分,10%~25%计1分,25%~50% 计2分,50%~75%计3分,≥75%计4分。无染色为阴性(0分),细胞核和(或)细胞质呈淡棕色为弱阳性(1分),呈棕色者为阳性(2分),深棕色为强阳性(3分)。根据阳性细胞比例和染色强度得分的乘积对组织染色结果进行评分分级:0~2分为阴性(-),3~5分为弱阳性(+),6~8分为阳性,9~12分为强阳性阳性率=(阳性例数+强阳性例数)/总例数×100%。所有免疫组化结果由本院两位病理医师在不知临床和病理资料的情况下进行评估。
1.5 统计学处理 采用SPSS 19.0软件进行统计分析。正常直肠、直肠腺瘤及直肠癌中PrPC表达率差异的比较采用χ2检验,直肠癌中PrPC表达与临床参数相关性的分析采用Spearman检验,P<0.05为差异有统计学意义。
2 结 果
2.1 PrPC在不同直肠组织中的表达情况 在直肠癌、直肠腺瘤及正常直肠组织均可见PrPC阳性表达,其阳性染色主要位于细胞核(图1)。PrPC在正常直肠及直肠腺瘤组织的中阳性表达率分别为15%(3/20)及35%(7/20),而在直肠癌组织中的阳性表达率为65%(39/60),明显高于正常结肠组织及直肠腺瘤组织(P<0.01,表1),其阳性率随分化程度下降而升高,即正常黏膜-腺瘤-癌序列中PrPC表达逐渐升高。
2.2 PrPC在直肠癌组织中的表达与临床病理参数的相关性 Spearman检验显示,直肠癌组织中PrPC阳性率与肿瘤分化程度、TNM分期及淋巴结转移密切相关(P<0.05),而与患者性别、年龄、肿瘤位置及肿瘤大小无明显相关性(P>0.05,表2)。

图1 PrPC在直肠癌中的表达(SP法)Fig. 1 Expression of PrPCin rectal cancer tissue (SP) A. Rectal cancer tissue (×200);B. Rectal cancer tissue (×400);C. Negative control (×200)

表1 PrPC在不同直肠组织中的阳性表达率比较Tab. 1 Comparison of the positive rate of PrPCin different rectal tissues
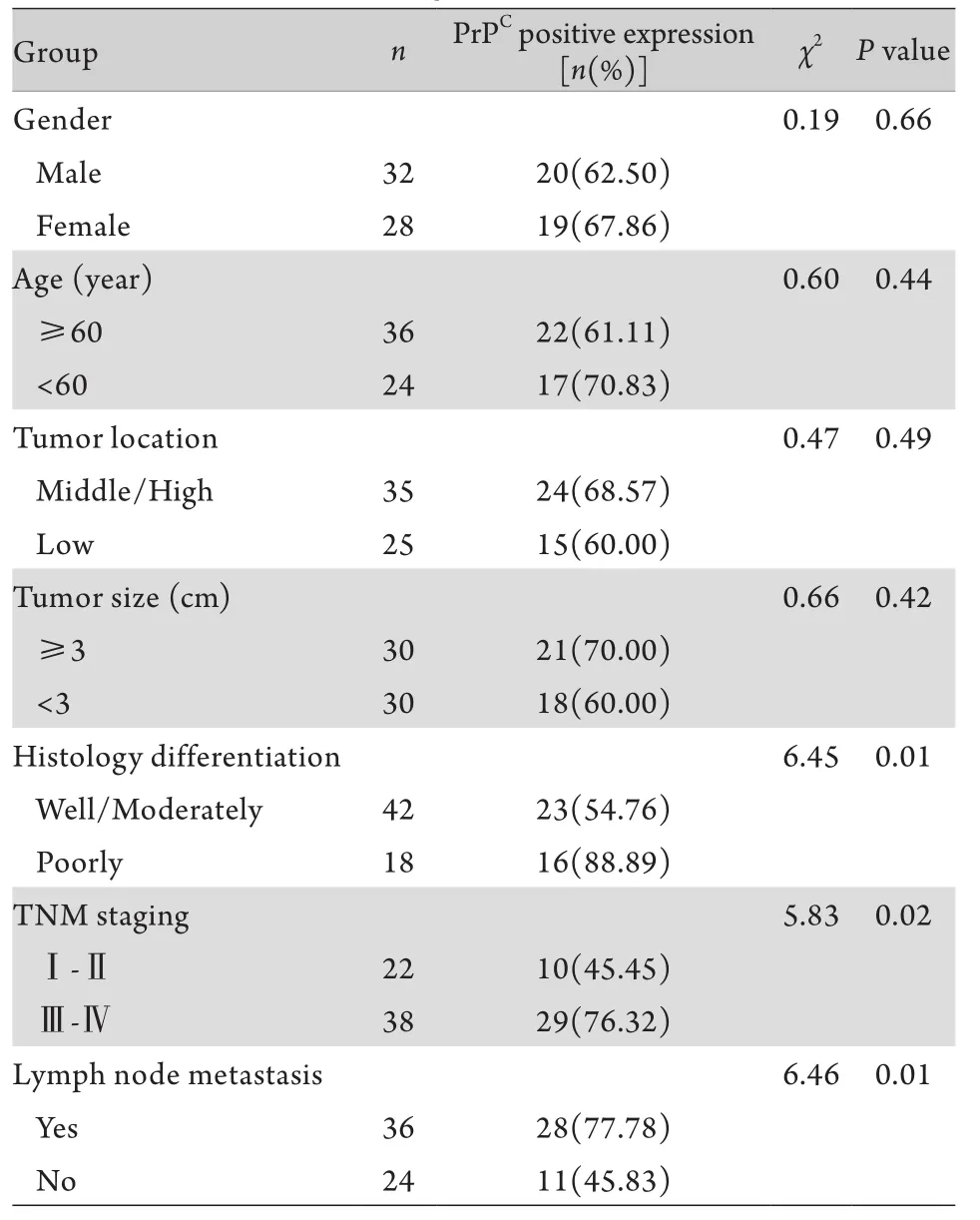
表2 直肠癌组织中PrPC表达与临床病理参数的关系Tab. 2 Relationship of the PrPCexpression in rectal cancer tissue to the clinical pathological parameters
3 讨 论
朊蛋白(prion protein,PrP)由美国科学家Prusiner首先发现并命名,包括PrPC和致病型朊蛋白(PrPSc),两者的分子量均为33~35kD,且是异构体,由同一染色体的PrP基因(PRNP)编码,具有完全相同的氨基酸序列,差别在于空间构型不同,导致二者的蛋白功能有极大差异[8]。正常的细胞型构象PrPC没有致病性,但在一定条件下可以转化成致病型PrPSc这种异常构象,从而导致朊病毒疾病的发生[9]。人类PrPC由PRNP基因编码,PRNP位于20号染色体短臂上,编码253个氨基酸,由于PRNP基因剔除小鼠没有明显的表现型,导致该蛋白的功能在相当长的时间内不明确。PrPC是一个在人体内分布较广的糖蛋白,从单细胞的酵母到鱼类、鸟类、两栖类、爬行类及哺乳动物等真核生物中均存在PrPC,在哺乳动物体内,PrPC主要存在于神经系统中,以神经元的表达量最高,如脑、脊髓和外周神经组织,其次为胃、肠道、乳腺、脾脏等器官[10]。研究显示PrPC在胃癌、胰腺癌、肠癌、乳腺癌及口腔鳞状细胞癌等肿瘤组织及细胞株中的含量显著升高,提示其可能在肿瘤的发生、发展过程中发挥着重要作用[11-13]。近年来随着对PrP的深入研究,发现PrPC对胃癌、胰腺导管腺癌及肠癌等消化系统癌症的恶性化(如抗药性及癌细胞的迁移等)均有促进作用[14]。
研究显示PrPC在结肠癌组织及细胞株中呈高表达[5,15-17]。在大肠癌组织中高表达的PrPC能够通过Fyn-HIF-2α-Glut1途径促进肿瘤细胞对葡萄糖的摄取,促进大肠癌的发生、发展及转移[18]。另有研究发现针对结肠癌细胞株HCT116的抗PrP特异性抗体(BAR221和F89/160.1.5)能在体外实验中有效抑制癌细胞的增殖,并在不同程度上加强化疗药物(伊立替康、5-FU、顺铂和阿霉素)的疗效[19]。但目前国内外有关PrPC在直肠癌及直肠腺瘤中的表达及其临床意义尚未见报道,本研究利用免疫组化SP法检测PrPC在正常直肠黏膜、直肠腺瘤及直肠癌组织中的表达情况,结果显示直肠癌组织中的PrPC表达于细胞核,且其阳性率明显高于正常直肠黏膜及直肠腺瘤,同时其表达水平与直肠癌的分化程度、TNM分期及淋巴结转移明显相关,而与患者的性别、年龄、肿瘤位置及肿瘤大小无明显相关性,表明PrPC可能在直肠癌的发生、发展、侵袭及转移过程中起着重要作用,提示PrPC有望作为直肠癌早期诊断、生物靶向治疗及预后判断的肿瘤生物标记物。
综上所述,本研究结果显示PrPC在直肠癌中高表达,且其表达水平与直肠癌的恶性进展密切相关,但具体作用机制还不清楚,有待于进一步应用siRNA、基因转染等技术进行深入研究。
[1]Ng F, Ganeshan B, Kozarski R,et al. Assessment of primary colorectal cancer heterogeneity by using whole-tumor texture analysis:contrast-enhanced CT texture as a biomarker of 5-year survival[J]. Radiology, 2013, 266(1):177-184.
[2]Wei JB, Liu H, Xie CH,et al. Expressions of dendritic cells markers CD1a and CD83 in colorectal cancer tissue and significance[J]. J Jilin Univ (Med Ed), 2014, 40(4):847-850, 916.[魏静波, 刘辉, 谢朝辉, 等. 结直肠癌组织中树突状细胞标志物CD1a和CD83的表达及意义[J]. 吉林大学学报(医学版), 2014, 40(4):847-850, 916.]
[3]Diarra-Mehrpour M, Arrabal S, Jalil A,et al. Prion protein prevents human breast carcinoma cell line from tumor necrosis factor alpha-induced cell death[J]. Cancer Res, 2004, 64(2):719-727.
[4]Liang J, Pan Y, Zhang D,et al. Cellular prion protein promotes proliferation and G1/S transition of human gastric cancer cells SGC7901 and AGS[J]. FASEB J, 2007, 21(9):2247-2256.
[5]McEwan JF, Windsor ML, Cullis-Hill SD. Antibodies to prion protein inhibit human colon cancer cell growth[J]. Tumour Biol, 2009, 30(3):141-147.
[6]Antonacopoulou AG, Grivas PD, Skarlas L,et al. POLR2F, ATP6V0A 1 and PRNP expression in colorectal cancer:new molecules with prognostic significance[J]? Anticancer Res, 2008, 28(2B):1221-1227.
[7]Edge SB, Compton CC. The American Joint Committee on Cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6):1471-1474.
[8]Du L, Rao G, Wang H,et al. CD44-positive cancer stem cells expressing cellular prion protein contribute to metastatic capacity in colorectal cancer[J]. Cancer Res, 2013, 73(8):2682-2694.
[9]Lin DH, Wen Y. Progresses on prion proteins[J]. Sci China Chem, 2011, 11(4):683-698. [林东海, 文祎. 朊病毒蛋白的研究进展[J]. 中国科学:化学, 2011, 41(4):683-698.]
[10]Peralta OA, Eyestone WH. Quantitative and qualitative analysis of cellular prion protein (PrPC) expression in bovine somatic tissues[J]. Prion, 2009, 3(3):161-170.
[11]Linden R, Martins VR, Prado MA,et al. Physiology of the prion protein[J]. Physiol Rev, 2008, 88(2):673-728.
[12]Li C, Yu S, Nakamura F,et al. Binding of pro-prion to FLNa disrupts cytoskeleton and correlates with poor prognosis in pancreatic cancer[J]. J Clin Invest, 2009, 119(9):2725-2736.
[13]Zhang J, Zeng Y, Xu J,et al. Expression of Prion protein and its clinical significance in oral squamous cells carcinoma and oral leukoplakia[J]. Chin J Stomatol, 2013, 48(12):752-754. [张杰,曾妍, 徐江, 等. 朊蛋白在口腔鳞状细胞癌和黏膜白斑中的表达及意义[J]. 中华口腔医学杂志, 2013, 48(12):752-754.]
[14]Li WP, Zhang JN. The research progress of PrPC in digestive tumors[J]. Guangdong Med J, 2014, 35(20):3275-3278. [李卫平, 张江南. 细胞型朊蛋白在消化系肿瘤中研究进展[J]. 广东医学, 2014, 35(20):3275-3278.]
[15]Wang WJ, Liu HL, Tan SL,et al. Effect of cellular prion protein expression on proliferation and invasion of colorectal cancer cells[J]. Chin J Exper Surg, 2014, 31(2):269-271. [王伟建, 刘海龙, 谭首海, 等. 朊蛋白表达对结直肠癌细胞增殖及侵袭能力的影响[J]. 中华实验外科杂志, 2014, 31(2):269-271.]
[16]Zheng YT, Huang ZH, Luo YW,et al. The high expression and clinical significance of PrPC in colorectal carcinoma[J]. Guangdong Med J, 2012, 33(8):1132-1134. [郑彦涛, 黄宗海,罗宇维, 等. 朊蛋白在结肠癌中高表达及意义[J]. 广东医学, 2012, 33(8):1132-1134.]
[17]de Wit M, Jimenez CR, Carvalho B,et al. Cell surface proteomies identifies glucose transporter type l and prion protein as candidate biomarkers for colorectal adenoma-to-carcinoma progression[J]. Gut, 2012, 61(6):855-864.
[18]Li QQ, Sun YP, Ruan CP,et al. Cellular prion protein promotes glucose uptake through the Fyn-HIF-2α-Glut1 pathway to support colorectal cancer cell survival[J]. Cancer Sci, 2011, 102(2):400-406.
[19]Yang XW, Zhang Y, Zhang LH,et al. Prion protein and cancers[J]. Acta Biochim Biophys Sin, 2014, 46(6):431-440.
Expression and clinical significance of cellular prion protein in rectal cancer and adenoma
LI Wei-ping, ZHANG Jiang-nan*
Department of Gastrointestinal Surgery, First Affiliated Hospital of Nanchang University, Nanchang 330006, China
*< class="emphasis_italic">Corresponding author, E-mail: zjnss@sina.com
, E-mail: zjnss@sina.com
This work was supported by the Science and Technology Planning Project of Jiangxi Health and Family Planning Commission (20155197)
ObjectiveTo determine the expressions of cellular prion protein (PrPC) in normal rectal mucosa, rectal adenoma and rectal carcinoma tissues, and to study the relationship of PrPCwith development and progression of rectal carcinoma.MethodsImmunohistochemical method (SP method) was used to determine the expressions of PrPCin rectal carcinoma (60 samples), rectal adenoma (20 samples) and normal rectal mucosa (20 samples), and the correlations between the expression of PrPCin rectal carcinoma tissue, and clinical pathological parameters including sex, tumor differentiation, clinical stages, lymph node metastasis, etc. were analyzed.ResultsPrPCwas expressed in normal rectal mucosa, rectal adenoma and rectal carcinoma tissues. The positive rate of PrPCexpression in rectal carcinoma (65%) was significantly higher than that in rectal adenoma (35%) and normal rectal mucosa (15%) with statistical significance (P<0.01). The correlation analysis showed that the positive rate of PrPCwas closely related with tumor differentiation, TNM stage and lymph node metastasis (P<0.05), while there was no significant correlation with sex, age, tumor location and tumor size (P>0.05).ConclusionPrPCmay play an important role in the process of development, progression and metastasis of rectal carcinoma.
prions; rectal neoplasms; pathology, clinical
R735.37
A
0577-7402(2015)07-0574-04
10.11855/j.issn.0577-7402.2015.07.12
2014-12-01;
2015-05-24)
(责任编辑:胡全兵)
江西省卫生计生委科技计划课题(20155197)
李卫平,硕士研究生。主要从事消化道肿瘤方面的基础与临床研究
330006 南昌 南昌大学第一附属医院胃肠外科(李卫平、张江南)
张江南,E-mail:zjnss@sina.com

