淹水对三峡库区消落带香附子生理特性的影响
刘泽彬,程瑞梅*,肖文发,郭泉水,王彦辉,王 娜
(1中国林业科学研究院森林生态环境与保护研究所,国家林业局森林生态环境重点实验室,北京100091;2南京林业大学南方现代林业协同创新中心,南京210037)
淹水对三峡库区消落带香附子生理特性的影响
刘泽彬1,2,程瑞梅1,2*,肖文发1,2,郭泉水1,王彦辉1,王 娜1,2
(1中国林业科学研究院森林生态环境与保护研究所,国家林业局森林生态环境重点实验室,北京100091;2南京林业大学南方现代林业协同创新中心,南京210037)
为了阐明香附子对三峡库区消落带水淹的耐淹机理,该研究模拟三峡库区消落带夏季汛期水淹环境,设置常规水分管理(CK)、根部水淹(T1)、半淹(T2)以及全淹(T3)4个不同处理组,研究香附子对不同淹水环境的生理响应机制。结果显示:(1)经过45d的水淹处理,所有水淹处理香附子叶片叶绿素a、叶绿素b、类胡萝卜素以及总叶绿素的含量均显著下降,但叶绿素a/b值仍维持在CK水平;(2)淹水并没有增加T1和T3处理植株可溶性蛋白、脯氨酸和可溶性糖含量,但显著增加了T2植株叶片脯氨酸和可溶性糖的含量;(3)随着水淹时间的延长,各水淹处理植株叶片丙二醛含量逐渐升高,且自水淹15d后均与CK植株差异显著;(4)所有水淹处理香附子植株SOD、CAT和APX等抗氧化酶活性均有所增加,但随着水淹时间的继续延长,T3植株叶片SOD和CAT活性逐渐下降。(5)经过45d的水淹处理,各水淹处理植株淀粉含量在叶和根中均显著增加。研究表明,虽然淹水对香附子产生了一定的伤害,但香附子能够通过调节体内各种保护酶活性和渗透调节物质含量来增加对水淹的抵御能力,而且根部高浓度淀粉含量也为香附子耐受水淹胁迫提供了稳定的能量供应。
淹水;香附子;叶绿素;丙二醛;渗透调节物质;抗氧化酶活性;淀粉
三峡水库建成后形成了落差近30m面积达300km2的消落带,由于库区施行“冬蓄夏排”的反季节水位运行方案,整个消落带将在冬季遭受长时间的水淹,同时,受夏季洪水汛期的影响,消落带低海拔区域(145~160m)将在夏季再次遭受水淹。消落带的频繁淹水及大幅度的水位涨落严重影响了植被的生长及生理节律,从而加剧了消落带生境的破碎及植被的退化,由此三峡库区消落带的生态环境引起了国内外学者的广泛关注。近几年来,针对三峡库区水位特点已做了大量有关耐淹植被的筛选与研究,主要涉及不同种类植物在耐淹过程中的群落特征[1-3]、生长特征[4-5]、存活率[6]、光合特性[7-9]、碳水化合物分配[10]、营养元素吸收[11]以及植物抗性生理[12]等,为三峡库区消落带植被的恢复与重建提供了重要的理论依据。但对于明显特征的冬季蓄水淹没和夏季汛期水淹过程未得到有效的区分[1],此外,目前的研究更多的是针对冬季淹水过程[6,12-13],而对于经历过冬季水淹的植物如何适应次年夏季汛期水淹的机制研究未见报道。
香附子(Rhizoma cyperi)为莎草科植物,又称为香头草、回头青、雀头香,是目前三峡库区消落带低水位主要生长的多年生草本植物之一,具有喜湿、繁殖速度快、适应性强的特点,在消落带景观恢复中发挥着重要的作用。但目前就香附子对水淹的响应机制的研究相对较少[14],尤其是对经历过冬季水淹的香附子如何适应次年夏季汛期水淹的机制研究更为缺乏,笔者先前已从生长、光合以及荧光特性方面研究和探讨了香附子对夏季汛期水淹的响应机制[8]。因此,本实验模拟三峡库区水位波动规律(7~8月),选取消落带实生香附子幼苗,再从生理生化特性方面来进一步研究和探索消落带香附子实生幼苗对不同水淹环境的响应机制,旨在为三峡库区消落带低海拔区域(145~160m)植被筛选与重建提供技术支撑和理论指导。
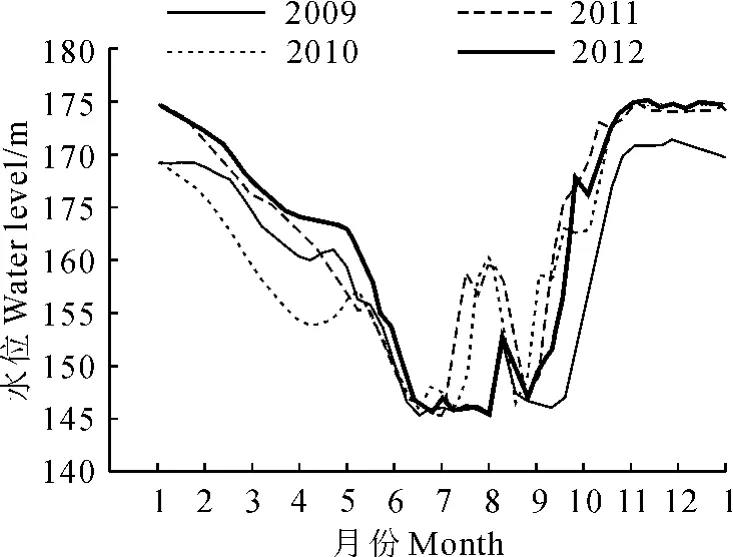
图1 2009~2012年三峡库区消落带水位变化Fig.1 Water levels in the Three Gorges Reservoir during 2009-2012
1 材料和方法
1.1 实验材料与地点
2012年6月中旬,在三峡库区消落带(秭归段)挖取经历过冬季水淹后重新萌生的香附子幼苗作为研究对象,将生长基本一致的幼苗统一栽入盆高17 cm、盆口直径22cm的花盆中,每盆3株,供试土壤为当地砂壤土。将所有植株置于湖北秭归三峡库区森林生态系统国家定位观测研究站(30°53′N,110° 54′E,海拔高度296m)内的遮阴棚里,待植株生长稳定,移出遮阴棚放入空地上进行相同光照和水分的管理。于2012年7月15日选取80盆幼苗(平均株高为18.1cm,基径为0.1cm)开展实验。
1.2 实验设计
实验模拟三峡库区夏季(7~8月)水位波动规律(水位数据来自于中国长江三峡集团公司,图1),将供试幼苗随机分成4组:对照组CK(常规水分管理)、根部水淹组T1(水面超土表1cm左右)、半淹组T2(水面超土表9cm左右)、全淹组T3(水面超植株顶端5cm左右),每组20盆,共80盆。将盆栽植株放入内径为30cm、高40cm的水桶内,然后通过向水桶内注水,实现对水淹组供试材料的水位控制。实验过程中每天傍晚更换1次水。
于实验开始的第7、15、30、45天分别对香附子叶片进行取样,然后放入液氮罐中进行冷冻保存以用于叶绿素、MDA含量以及SOD、CAT和APX活性的测定,每处理3次重复。淹水处理第45天后,将植株从花盆中取出,清洗根部的土,分叶和根两部分放入105℃烘箱中杀青15min,后调至70℃烘干48h。每处理采集9棵植株,每3棵为一个重复。
1.3 指标测定
1.3.1 叶绿素含量 采用浸提法[15]用GENERAL TU-1221紫外可见分光光度计测定浸提液在663、645和470nm处吸光度值,并根据文献[16]修正的公式计算叶绿素a、叶绿素b和类胡萝卜素含量,总叶绿素含量=叶绿素a含量+叶绿素b含量。
1.3.2 可溶性蛋白、丙二醛含量及抗氧化酶活性
参照Grace等[17]的方法,稍作修改。称取植物组织叶片0.30g,在液氮中研成粉末,加入3mL提取缓冲液[0.1mol/L K2HPO4-KH2PO4(pH 7.6),1 mmol/L EDTA,0.3%Triton X-100,4%PVP]及少许石英砂于冰浴中研磨匀浆,12 000g、4℃离心20min,取上清液并分装保存于-70℃超低温冰箱备用。可溶性蛋白含量测定利用考马斯亮蓝G-250染色法[18],MDA含量测定采用硫代巴比妥酸比色法[18],SOD活性测定利用氮蓝四唑比色法[18],CAT活性测定参照Knörzer等[19]的方法,APX活性测定参照Nakanno等[20]的方法。
1.3.3 脯氨酸含量 参照李合生[18]的方法进行测定。
1.3.4 非结构碳水化合物含量 利用Waters2695型高效液相色谱仪(美国,Waters公司)测定可溶性糖和淀粉的含量。色谱条件:色谱柱:sugar-pak1(美国,Waters公司);流动相:水;流速:0.6mL/min;柱温:70℃;检测器:视差检测器。可溶性糖的提取参照于建国等[21]的方法。称取0.5g粉粹好的植物干样于三角瓶瓶中,加入50mL蒸馏水,用锡箔纸封口消煮2h,放凉后定容至50mL,过滤。淀粉提取参照刘福岭等[22]的方法,称取0.5g粉粹好的植物干样放入三角中,加入100mL蒸馏水和10 mL 2∶1(V∶V)的盐酸,置于沸水浴中回流8h,冷却后,用40%氢氧化钠中和,定容至150mL后,过滤,滤液用于指标测定。
1.4 数据处理与分析
利用软件SPSS 19.0和SigmaPlot 11.0软件对实验数据进行分析处理和作图,不同淹水处理对香附子生理生化指标的影响采用单因素方差分析(oneway ANOVA),并用Tukey多重比较检验各指标不同淹水处理间的差异显著性,显著水平为0.05。

表1 不同淹水环境下香附子光合色素含量的变化Table 1 Changes in chlorophyll content of C.rotundus under different flooding levels
2 结果与分析
2.1 淹水对香附子叶片光合色素含量的影响
水淹引起了香附子叶绿素a、叶绿素b、类胡萝卜素以及总叶绿素含量的变化,进而引起植株光合功能的改变。其中,经过45d的水淹,所有淹水处理植株叶绿素a、叶绿素b、类胡萝卜素以及总叶绿素含量均显著低于CK(表1),并以T3处理植株下降最明显,分别比CK植株下降了56.7%、55.6%、29.6%和56.1%,其次为T1处理植株,分别比CK植株下降了39.6%、37.4%、21.0%和39.1%,T2处理植株下降最小,分别比CK植株下降了29.6%、29.3%、11.1%和29.3%。淹水并没有显著影响香附子叶片叶绿素a/b的比值,45d水淹后,所有处理植株叶片叶绿素a/b的比值均约为4左右。
2.2 淹水对香附子叶片可溶性蛋白和脯氨酸含量的影响
图2,A显示,受水淹影响,各水淹处理植株叶片可溶性蛋白含量均出现了一定程度的下降,但这种差异未达到显著水平。至水淹45d,T1、T2和T3植株叶片可溶性蛋白分别为1.84、1.72和1.92mg·g-1,稍低于同期对照。同时,淹水对香附子叶片脯氨酸的影响在各水淹处理植株中有所不同(图2,B),淹水始终没有显著影响T1和T3植株叶片脯氨酸的含量,但显著增加了T2植株叶片脯氨酸的含量,至水淹45d,T2植株叶片脯氨酸含量比CK植株增加了66.7%。以上结果说明,水淹并没有明显影响根淹、半淹和全淹植株蛋白质的合成或促进其分解;脯氨酸在根淹和全淹植株抵御水淹中并没有发挥明显的作用,但在半淹植株抵御水淹中发挥了积极的作用。
2.3 淹水对香附子叶片丙二醛含量和抗氧化酶活性的影响
图3,A显示,不同水淹处理香附子植株叶片丙二醛含量对水淹的响应基本一致,T1、T2和T3植株叶片丙二醛含量均随着水淹时间的延长而逐渐增加,自水淹15d开始,均与CK植株差异显著,但与T1和T3相比,T2植株叶片丙二醛含量上升的幅度要小于前两者。这表明T2处理植株受到的淹水伤害较轻。
同时,不同水淹处理植株叶片SOD活性对水淹的响应有所差异(图3,B)。其中,水淹7d后,各水淹处理SOD活性均有所上升,但T1和T2处理植株叶片SOD活性与CK相比差异并不显著,而T3植株SOD活性显著高于CK植株。随着水淹时间的继续增加,T1和T2植株SOD活性逐渐显著高于CK植株,但T1植株SOD活性从水淹15d开始始终高于T2植株,且差异显著,至水淹45d,T1和T2植株SOD活性分别比CK植株增加了87.7%和38.2%;而T3植株SOD活性在水淹15d时达到最大值后逐渐降低,至水淹45d,T3植株SOD活性与CK植株差异不显著。
其次,随着水淹时间的延长,T1和T2植株叶片CAT活性均逐渐上升,但T1植株上升的幅度要高于T2植株,T1植株在水淹30d时植株叶片CAT活性显著高于CK植株,而T2植株直到水淹45d后植株叶片CAT活性才显著高于CK植株。与T1和T2植株对水淹的响应不同,T3植株叶片CAT活性随着水淹时间的增加呈现出先增加后降低的趋势,于水淹15d时达到最大值,后逐渐降低;至水淹45d时,T3植株叶片CAT活性与CK植株相比差异不显著(图3,C)。
另外,淹水也显著影响了香附子植株叶片APX活性。随着水淹时间的延长,所有水淹处理植株叶片APX活性均逐渐上升(图3,D),T3植株叶片APX活性从水淹7d开始均显著高于CK植株,而T1和T2植株叶片APX活性直到水淹30d后才显著高于CK植株;至水淹45d后,T1、T2和T3植株叶片APX活性分别比CK植株显著增加了129.0%、156.0%和191.4%。
以上结果表明,虽然淹水对香附子植株产生了一定程度的伤害,但香附子植株能够通过提高抗氧化酶的活性来减轻淹水对自身的伤害。
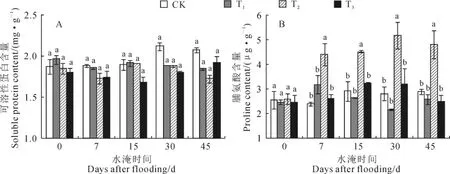
图2 不同水淹环境下香附子叶片可溶性蛋白和脯氨酸含量的变化数据为平均值±标准误;对于每一水淹时间水平中不同字母表示不同处理组间差异显著(P<0.05)。下同Fig.2 The changes of soluble protein and proline in leaves of C.rotundus under different flooding levels Data were given as mean±standard error.Different letters in each flooding time level represented significant difference among different groups at 0.05level.The same as below
2.4 淹水对香附子非结构碳水化合物的影响
由表2可知,香附子叶片可溶性糖含量在不同水淹处理下有不同的响应。水淹45d后,T2处理植株叶片可溶性糖含量显著高于CK植株,T1处理植株叶片可溶性糖含量虽有上升,但与CK植株差异并不显著,T3植株叶片可溶性糖含量显著低于CK植株;而香附子根部可溶性糖含量并没有受到水淹的显著影响,水淹45d后,各水淹处理植株根部可溶性糖含量均与CK差异不显著。同时,淹水也显著增加了淀粉在香附子叶片和根部的积累(表2),所有水淹处理香附子叶片和根部淀粉含量均显著高于CK植株。经过水淹45d后,T1、T2和T3香附子叶片淀粉含量分别比CK植株增加了57.6%、109.2%和96.0%;其根部淀粉含量分别比CK植株增加了81.6%、89.4%和87.2%。以上结果说明,可溶性糖在半淹植株抵抗水淹逆境中发挥了积极的作用;而根部淀粉含量的增加为香附子抵御根淹、半淹和全淹提供了充足的能量供应。
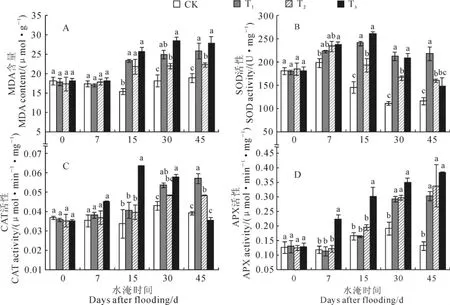
图3 不同水淹环境下香附子叶片MDA、SOD、CAT和APX活性的变化Fig.3 The changes of MDA,SOD,CAT and APX in leaves of C.rotundus under different flooding levels
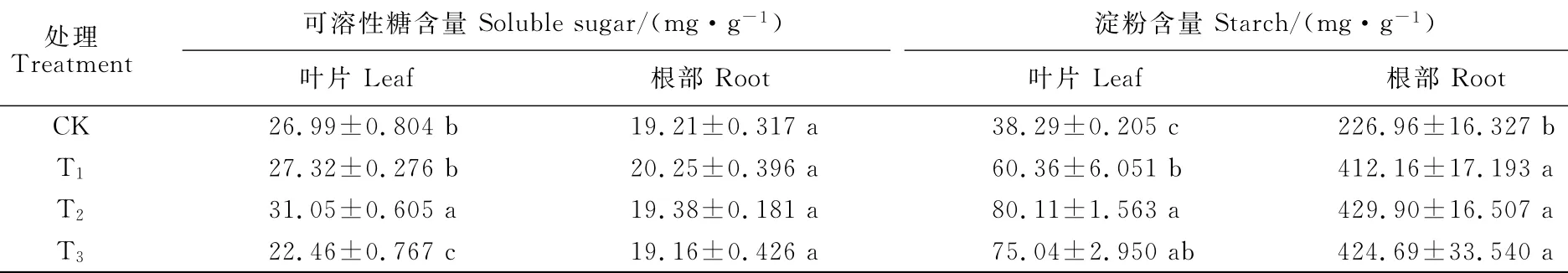
表2 不同淹水环境下香附子根和叶非结构碳水化合物含量的变化Table 2 Changes of non-structural carbohydrates in leaves and roots of C.rotundus under different flooding levels
3 讨 论
光合色素含量是反映植物叶片光合作用强弱的重要指标,在光能的吸收、传递和转换中发挥着重要的作用[23]。有研究表明,水淹会导致植株叶片叶绿素含量下降[24]。本研究也得到了类似的结果,香附子幼苗叶片的叶绿素a、叶绿素b、总叶绿素含量以及类胡萝卜素含量在不同水淹处理下均出现了显著下降,这意味着水淹可能加剧了香附子叶绿素体的降解或抑制其合成[25]。香附子在不同处理下的光合色素含量大小表现为常规水分管理>半淹>根淹>全淹,这与前人研究的一些树种叶片光合色素含量会随着水淹深度的增加逐渐降低有所不同[7,26]。作者前期研究发现[8],香附子对不同程度水淹具有不同的适应策略,处于根淹和全淹环境下的香附子植株采取“忍耐”水淹的适应策略,逐渐减缓了自身的生长(生物量等显著下降),而处于半淹环境中的香附子植株则采取“趋避”适应策略,加快茎的伸长以“逃离”水淹环境(株高、生物量等均显著增加)。因此,笔者认为叶片保持较高的光合色素可以使植株维持较高的光合速率,从而为茎伸长过程中所需的物质能量和碳水化合物的供给提供保障,这或许是半淹植株光合色素高于其他两种水淹处理的主要原因。淹水条件下叶绿素a/b的变化在不同植物中有所不同,受水淹影响,宜昌黄杨(Buxus ichangensis)[27]、枫杨(Pterocarya stenoptera)[28]等植物叶片叶绿素a/b会降低,而湿地松(Pinus eliotti Engelm.)等[24]植物叶片叶绿素a/b的比值会升高。本实验中,淹水并没有显著影响香附子叶片叶绿素a/b值。叶绿素a主要结合在光系统反应中心上,而叶绿素b主要结合在捕光色素蛋白复合物上[27],不同植物在淹水条件下叶绿素a/b值变化不同可能是由于淹水对不同植物光系统反应中心与捕光色素蛋白复合物的影响程度不同所致。
水淹对植物的伤害主要是来自于抗氧化链反应产生的自由基发生过氧化反应,造成对脂膜的伤害[29]。MDA可以用来反映细胞膜脂过氧化作用的程度[30],也可以度量植株在逆境胁迫下对ROS的清除能力[12]。本研究水淹条件下香附子叶片MDA含量增加,表明水淹对香附子产生了一定的伤害;半淹植株叶片MDA含量低于根淹和全淹植株,又暗示半淹环境下香附子对ROS的清除能力更强,原因可能与香附子形态结构对水淹的调整有关,半淹植株肥大的茎基可以增加对氧气的获取,增强植株清除活性氧的能力[8]。渗透调节是植物在逆境胁迫下降低渗透势、抵抗逆境的一种方式,具有保护酶和植物组织内各种细胞膜结构的功能[31-32]。可溶性蛋白、脯氨酸和可溶性糖等是植物遭受水淹胁迫时所广泛关注的重要渗透调节物质,Carpenter等[32]研究发现,耐淹黑柳植株(Salix nigra)在遭遇水淹胁迫后,根和茎的细胞中存在明显的渗透调节过程以抵御水淹逆境。本研究显示,香附子植株渗透调节物质在不同水淹处理中的变化存在差异。根淹和全淹植株叶片可溶性蛋白、脯氨酸和可溶性糖等渗透调节物质均未出现增加的现象,这表明根淹和全淹植株并没有通过渗透调节物质来抵御水淹胁迫,但受水淹影响,渗透调节物质脯氨酸和可溶性糖在半淹植株中出现了显著的增加。有研究表明[33],脯氨酸和可溶性糖的增加可以调节细胞渗透,保护脂膜。因此,半淹植株相比根淹和全淹植株受到的淹水伤害较轻(半淹植株MDA含量显著低于根淹和全淹植株),也可能与半淹植株能够及时通过增加渗透调节物质可溶性糖和脯氨酸的含量等来参与水淹的防御有关[34]。虽然渗透调节物质可溶性蛋白在各水淹处理中均未出现增加,但其含量也未出现显著的下降,这也从另一个方面说明了水淹并没有明显抑制香附子蛋白质的合成或促进其分解,其具有一定适应水淹的能力。
正常情况下,植物细胞内活性氧的产生与其清除保持平衡。水淹条件下,由于植物缺氧,抗氧化系统清除活性氧的能力降低,植物细胞内活性氧产生与清除的动态平衡被打破,导致活性氧物质(ROS)的产生增加[35]。ROS的增加对细胞膜、叶绿体色素以及脂质等均有破坏作用[36],为了克服这些氧化性损伤,植物在长期进化过程中形成了一套复杂的抗氧化酶系,如SOD、CAT、APX等[37]。Tan等[12]研究发现,三峡库区消落带耐淹植物狗牙根(Cynodon dactylon)在遭受水淹胁迫后可以提高自身SOD、CAT和APX的活性以维持细胞内活性氧产生与清除的动态平衡。本研究结果也与之类似,香附子在各水淹处理中叶片SOD、CAT和APX活性均比对照显著增加,表明水淹导致了香附子根部的缺氧,破坏了根系细胞内活性氧产生与清除的动态平衡,从而诱导SOD、CAT和APX活性的升高。这也体现出香附子可以通过自身的调节机制,提高抗氧化酶系的活性来减轻淹水胁迫下活性氧积累对植物细胞膜的伤害。与其他两种水淹处理相比,全淹植株SOD和CAT活性在水淹后期出现了下降,这表明全淹植株活性氧自由基的产生可能已超出SOD和CAT的清除能力,这与王贵斌等[38]在研究喜树(Camptotheca acuminata)时得出的结论一致,也表明了植物抗氧化酶的活性并不会随着胁迫程度的增强而无限的增大。
受水淹影响,香附子叶片会积累过多的光合产物淀粉,而过多的淀粉会反过来抑制光合作用的正常运行[39],作者前期研究认为水淹胁迫下香附子同化产物运转不畅是影响其光合速率下降的非气孔因素之一[8]。本研究也进一步证实了这一结论。水淹条件下,由于氧气的不足,植物往往采用厌氧代谢来代替有氧呼吸。对于不耐淹的植物而言,虽然厌氧代谢在一定程度上能够缓解因淹水造成的缺氧胁迫,但将会消耗大量的碳水化合物,使根部碳水化合物的储备减少;而耐淹植物在遭遇水淹胁迫后,根部往往能形成更多的碳水化合物[23]。Crawford等[40]认为这可能是植物对水淹的适应性反馈效应,以避免长期水淹造成植物碳水化合物饥饿而死亡。植株根部保持较高的淀粉含量可以有效地维持淹水条件下根部的能量供应,同时也为淹水解除后植株根和叶的重新生长提供了充足的物质能量来源[41],因此,植株对水淹的这种适应策略对于其自身的存活生长极为有利。对于芦苇(phragmites communis)[42]和水稻(Oryza sativa L.)[43]等耐淹植物的研究也验证了这一点。本研究中,所有水淹处理香附子植株根部均有大量淀粉的积累,Peña-Fronteras等[44]证明,低洼地带的香附子之所以能够在水淹环境下存活生长是因为体内含有大量碳水化合物,因此,水淹条件下香附子根部高浓度淀粉含量或许是香附子能够在三峡库区存活生长的重要原因。
本研究表明,虽然淹水对香附子产生了一定的伤害(MDA含量升高),但香附子能够在生理方面对水淹做出积极的响应和调整,如能够通过调节体内各种保护酶的活性、渗透调节物质的含量来增强植株对水淹的抵御能力,减轻水淹对植株自身的伤害。同时,水淹条件下,香附子根部高浓度淀粉含量的贮备或许也是香附子能够耐受三峡库区淹水环境的一个重要生理机制。
[1] AI L J(艾丽皎),YU J H(余居华),ZHANG Y L(张银龙).Influence of flooding on community characterization of the species Salix rosthornii Seemen in water level fluctuation zone of the Three Gorges Reservoir[J].Journal of Nanjing Forestry University(Nat.Sci.Edi.)(南京林业大学学报·自然科学版),2013,37(4):23-28(in Chinese).
[2] HONG M(洪 明),GUO Q SH(郭泉水),et al.Responses of Cynodon dactylon population in hydro-fluctuation belt of Three Gorges Reservoir area to flooding-drying habitat change[J].Chinese Journal of Applied Ecology(应用生态学报),2011,22(11):2 829-2 835(in Chinese).
[3] GUO Q SH(郭泉水),KANG Y(康 义),HONG M(洪 明),et al.Responses of terrestrial plants in hydro-fluctuation belt of the Three Gorges Reservoir area to the first time flooding-drying habitat change[J].Scientia Silvae Sinicae(林业科学),2013,49(5):1-9(in Chinese).
[4] LI CH X,WEI H,GENG Y H,et al.Effects of submergence on photosynthesis and growth of Pterocarya stenoptera(Chinese wingnut)
seedings in the recently-created Three Gorges Reservoir region of China[J].Wetlands Ecology Management,2010,18(4):485-494.[5] GUO Q SH(郭泉水),HONG M(洪 明),PEI SH X(裴顺祥),et al.Form traits and photosynthesis characteristics of Vetiveria zizanioides response to flooding-drying habitat changes in the hydro-fluctuation belts of the Three Gorges Reservoir[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2012,32(11):2 328-2 335(in Chinese).
[6] WANG H F(王海峰),ZENG B(曾 波),et al.Effects of long-term submergence on surival and recovery growth of four riparian plant species in Three Gorges Reservoir region,China[J].Journal of Plant Ecology(Chinese Version)(植物生态学报),2008,32(5):977-984(in Chinese).
[7] LI X L,LI N,YANG J,et al.Morphological and photosynthetic responses of riparian plant Distylium chinense seedlings to simulated Au
tumn and Winter flooding in Three Gorges Reservoir region of the Yangtze River,China[J].Acta Ecologica Sinica,2011,31(1):31-39.[8] LIU Z B(刘泽彬),CHENG R M(程瑞梅),XIAO W F(肖文发),et al.Effects of submergence on the growth and photosynthetic charac
teristics of Rhizoma cyperi in hydro-fluctuation belt of Three Gorges Reservoir area,Southwest China[J].Chinese Journal of Ecology(生态学杂志),2013,32(8):2 015-2 022(in Chinese).
[9] WANG CH Y(王朝英),LI CH X(李昌晓),ZHANG Y(张 晔).Effects of flooding on the photosynthetic physiology characteristics of Pterocarya stenoptera seedlings[J].Chinese Journal of Applied Ecology(应用生态学报),2013,24(3):675-682(in Chinese).
[10] YE X Q,ZENG B.Survival and carbohydrate storage in two tolerant plant species exposed to prolonged flooding in the Three Gorges Reservoir region[J].Acta Hydrobiologica Sinica,2013,37(3):450-457.
[11] WANG Q(王 强),YUAN X ZH(袁兴中),et al.Effect of initial impoundment on the vegetation and species diversity in water-level fluctuation zone of the Three Gorges Reservoir[J].Journal of Natural Resources(自然资源学报),2011,26(10):1 680-1 693(in Chinese).
[12] TAN SH D,ZHU M Y,ZHANG Q F.Physiological responses of bermudagrass(Cynodon dactylon)to submergence[J].Acta Physiologiae Plantarum,2010,32(1):133-140.
[13] QIN H W(秦洪文),LIU ZH X(刘正学),ZHOU D X(周大祥),et al.Physiological responses of Distylium chinense(Fr.)Diels to antiseason submergence[J].Journal of Henan Agricultural Sciences(河南农业科学),2012,41(11):126-128(in Chinese).
[14] LIU X(刘 旭),CHENG R M(程瑞梅),GUO Q SH(郭泉水),et al.Adaptability of Cyperus rotundus Linn.to different soil water gra
dients[J].Resources and Environment in the Yangtze Basin(长江流域资源与环境),2008,17(Z1):60-65(in Chinese).
[15] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2008:74-77.
[16] LICHTENTHALER H K,WELLBURN A R.Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents[J].Biochemical Society Transactions,1983,603(11):591-592.
[17] GRACE S C,LONGAN B A.Acclimation of foliar antioxidant systems to growth irradiance in three broad-leaved evergreen species[J].Plant Physiology,1996,112(4):1 631-1 640.
[18] 李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2000.
[19] KNÖRZER O C,BURNER J,BOGER P.Alterations in the antioxidative system of suspension-cultured soybean cells(Glycine max)in-duced by oxidative stress[J].Physiologia Plantarum,1996,97(2):388-396.
[20] NAKANNO Y,ASADA K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J].Plant Cell Physiology,1981,22(5):867-880.
[21] 于建国,王文芝.现代实用仪器方法[M].北京:中国林业出版社,1994.
[22] 刘福岭,戴行钧.食品物理与化学分析方法[M].北京:轻工业出版社,1987.
[23] LIU Z B(刘泽彬),CHENG R M(程瑞梅),XIAO W F(肖文发),et al.Effect of waterlogging on photosynthetic and physioecological characteristics of plants[J].World Forestry Research(世界林业研究),2013,26(3):33-38(in Chinese).
[24] ZHOU J(周 珺),WEI H(魏 虹),LÜQ(吕 茜),et al.Effects of soil water regime on leaf photosynthetic characteristics of slash pine(Pinus elliottii Engelm.)seedlings[J].Chinese Journal of Ecology(生态学杂志),2012,31(1):30-37(in Chinese).
[25] ASHRAF M,ARFAN M.Gas exchange characteristics and water relations in two cultivars of Hibiscus esculentus under waterlogging[J].Biologia Plantarum,2005,49(3):459-462.
[26] XIN J L(辛俊良),HUANG B F(黄白飞),YANG ZH Y(杨中艺),et al.Physiological responses of Indigofera spicatato different flooding stress[J].Acta Prataculturae Sinica(草业学报),2012,21(3):177-183(in Chinese).
[27] XUE Y H(薛艳红),CHEN F Q(陈芳清),FAN D Y(樊大勇),et al.Ecophysiological responses of Buxus ichangensis to summer waterlogging[J].Biodiversity Science(生物多样性),2007,15(5):542-547(in Chinese).
[28] JIA ZH M(贾中民),WEI H(魏 虹),et al.Effects of long-term flooding on photosynthesis and chlorophyll fluorescence parameters of Pterocarya stenopteraseedlings[J].Journal of Southwest University(Nat.Sci.Edi.)(西南大学学报·自然版),2009,31(5):124-129(in Chinese).
[29] MONK L S,FAGERSTEDT K V,CRAWFORD R M M.Oxygen toxicity and superoxide dismutase as an antioxidant in physiological stress[J].Physiologia Plantarum,1989,76(3):456-459.
[30] CHOUDHARY M,JETLEY U K,KHAN M A,et al.Effect of heavy metal stress on proline,malondialdhyde,and superoxide dismutase activity in the cyanobateriumSpirulina platensis-S5[J].Ecotoxicology Environmental Safety,2007,66(2):204-209.
[31] ZHANG Y P(张永平),CHEN Y Y(陈幼源),et al.Effects of 2,4-epibrassinolide on physiological characteristics and photosynthesis of melon seedlings under high temperature stress[J].Plant Physiology Journal(植物生理学报),2012,48(7):683-688(in Chinese).
[32] CARPENTER L T,PEZESHKI S R,SHIELD F D.Responses of nonstructural carbohydrates to shoot removal and soil moisture in Salix nigra[J].Trees,2008,22(5):737-748.
[33] WANG R(王 瑞),LIANG K L(梁坤仑),ZHOU ZH Y(周志宇),et al.Effect of different waterlogging stress conditions on growth and some physiological characteristics of Amorpha fruticosa[J].Acta Prataculturae Sinica(草业学报),2012,21(1):149-155(in Chinese).
[34] LÜY Y,JIN Y,FU S X.Physiological differences of different waterlogging-resistant Brassica napus L.under waterlogging stress[J].Plant Physiology Journal(植物生理学报),2013,49(9):959-967(in Chinese).
[35] GRANT J J,LOAKE G J.Role of reactive oxygen intermediates and cognate redox signaling in disease resistance[J].Plant Physiology,2000,124(1):21-29.
[36] FANG W C,KAO C H.Enhanced peroxidase activity in rice leaves in response to excess iron,copper and zinc[J].Plant Science,2000,158(1-2):71-76.
[37] MONK L,FAGERSTEDT K,CRAWFORD R.Superoxide dismutase as an anaerobic polypeptide:A key factor in recovery from oxygen deprivation in Iris pseudacorus?[J].Plant Physiology,1987,85(4):1 016-1 020.
[38] WANG G B(王贵斌),CAI J F(蔡金峰),HE X H(何肖华).Effects of waterlogging stress on morphology and physiology of Camptotheca acuminata[J].Chinese Journal of Plant Ecology(植物生态学报),2009,33(1):134-140(in Chinese).
[39] MIELKE M S,MATOS E M,COUTO V B,et al.Some photosynthetic and growth responses of Annona glabra L.seedlings to soil flooding[J].Acta Botanica Brasilica,2005,19(4):905-911.
[40] CRAWFORD R M M.Whole plant adaptations to fluctuating water tables[J].Folia Geobotanica Phytotxon,1996,31(1):7-24.
[41] SHI M F(施美芬),ZENG B(曾 波),SHEN J H(申建红),et al.A review of the correlation of flooding adaptability and carbohydrates in plants[J].Chinese Journal of Plant Ecology(植物生态学报),2010,34(7):855-866(in Chinese).
[42] BRÄNDLE R,CRAWFORD R M M.Rhizome Anoxia Tolerance and Habitat Specialization in Wetland Plants[M]//CRAWFORD R M M.Plant Life in Aquatic and Amphibious Habitats.Oxford,Blackwell Scientific,1987:397-410.
[43] DAS K K,SARKAR R K.ISMAIL A M.Elongation ability and non-structural carbohydrate levels in relation to submergence tolerance in rice[J].Plant Science,2005,168(1):131-136.
[44] PEÑA-FRONTERAS J T,VILLALOBOS M C,et al.Adaptation on flooding in upland and lowland ecotypes of Cyperus rotundus,a troublesome sedge weed of rice:tuber morphology and carbohydrate metabolism[J].Annals of Botany,2009,103(2):295-302.
(编辑:裴阿卫)
Effect of Submergence on Physiological Characteristics of Cyperus rotundus in Hydro-fluctuation Belt of Three Gorges Reservoir Area
LIU Zebin1,2,CHENG Ruimei1,2*,XIAO Wenfa1,2,GUO Quanshui1,WANG Yanhui1,WANG Na1,2
(1Key Laboratory of Forest Ecology and Environment,State Forestry Administration;Research Institute of Forest Ecology,Environmentand Protection,Chinese Academy of Forestry,Beijing 100091,China;2Co-innovation Center for Sustainable Forestry in Southern China,Nanjing Forestry University,Nanjing 210037,China)
In order to explore the adaptation mechanism of Cyperus rotundus seedlings to the water level change in the hydro-fluctuation belt of the Three Gorges Reservoir area,we conducted a simulation experiment to study the physiology response to different submerged environments induced by the water level change.Four treatments were set,i.e.,no submergence(CK),root submergence(T1),semi-plant-submergence(T2),and whole plant submergence(T3).The results indicated that:(1)After treated for 45days,chlorophyll a,chlorophyll b,carotenoid and total chlorophyll in all submergence treatments tended to be decreased,while chlorophyll a/b still kept the CK level.(2)Submergence had no significant effects on the contents of soluble protein,proline and soluble sugar in T1and T3,but it significantly increased the contents of proline and soluble sugar in T2.(3)With the increase of submergence time,the content of MDA was gradually increased in all submergence treatments,and was significantly different compared with CKafter 15-day submergence.(4)The activities of antioxidant enzyme(such as SOD,CAT and APX)in all submergence treatments had some increase during the submergence,however,the activities of SOD and CAT in T3were gradually reduced as the submergence continue to increase.(5)After treated for 45days,the starch concentrations in leaves and roots in all submergence treatments were higher than that in CK.This study indicates that although submergence have some adverse effects,C.rotundus can increase the physical defense to the submergence by adjusting a variety of inner protective enzyme activities and the contents of osmotic adjustment substances.Meanwhile,the accumulation of large amount of starch in root can offer a stable energy supply for tolerance to submergence.
submergence;Cyperus rotundus;chlorophyll;malonaldehyde;osmotic substance;antioxidant enzymes activity;starch
Q945.78
A
10.7606/j.issn.1000-4025.2015.06.1190
1000-4025(2015)06-1190-08
2014-11-25;修改稿收到日期:2015-05-23
十三五林业科技支撑计划(2015BAD07B04);十二五林业科技支撑计划(2011BAD38B04)
刘泽彬(1989-),男,在读博士研究生,主要从事恢复生态和森林生态研究。E-mail:binarystar1989@163.com
*通信作者:程瑞梅,研究员,博士研究生导师,主要从事恢复生态和森林生态研究。E-mail:chengrm@caf.ac.cn

