丹参病程相关蛋白基因PR10的克隆与表达分析
赵 乐,马利刚,王志霜,申 业,郑晓珂
(1河南中医学院药学院,郑州450046;2中国中医科学院中药资源中心,北京100700)
丹参病程相关蛋白基因PR10的克隆与表达分析
赵 乐1,马利刚1,王志霜2,申 业2,郑晓珂1
(1河南中医学院药学院,郑州450046;2中国中医科学院中药资源中心,北京100700)
病程相关蛋白(PR)的产生与积累是植物体应对生物或非生物胁迫的主要特征之一。该研究以人工培养的丹参幼苗为材料,通过分析丹参转录组数据,根据丹参病程相关蛋白基因PR10的序列设计特异性引物,采用逆转录聚合酶链式反应(RT-PCR)从丹参中获得PR10基因的开放阅读框(ORF),命名为SmPR10-1(GenBank注册号KF877034),并进行原核表达和纯化。结果表明:(1)SmPR10-1基因ORF为477bp,编码158个氨基酸,其蛋白质分子质量为17.38kD。(2)通过蛋白结构预测、序列多重比对和构建进化树等生物信息学分析,发现SmPR10-1基因具有保守序列(G-X-G-G-X-G)和(K-A-X-E-X-Y),其编码蛋白与葡萄等双子叶植物中的PR10蛋白同源性较高。(3)经异丙基β-D-硫代半乳糖苷(IPTG)诱导,含有表达载体pET32a-SmPR10-1的大肠杆菌(Escherichia coli BL21)可诱导表达融合蛋白;对影响蛋白表达的4个因素优化结果表明,SmPR10-1蛋白的最佳表达条件为:IPTG终浓度0.4mmol/L、起始宿主菌密度A600为0.8、诱导温度30℃、诱导时间8h,并得到纯化的SmPR10-1蛋白。该结果为进一步研究SmPR10-1基因在丹参抗病方面的生物学功能和培育丹参抗病品种奠定了基础。
丹参;病程相关蛋白;生物信息学分析;原核表达;条件优化
植物在受到真菌、细菌和病毒等病原微生物侵染或受到非生物胁迫时会诱导表达并积累病程相关(pathogenesis-related,PR)蛋白,这类蛋白是植物防御体系的重要组成部分[1]。PR蛋白为多基因编码,根据氨基酸序列的相似程度、血清学关系和生物学活性,目前分为17类[2]。它们在不同的植物中表现为几丁质酶、葡聚糖苷酶、蛋白酶抑制剂、内肽酶和过氧化物酶等,在植物自我防御机制中作为可被诱导的组分发挥作用。
随着对PR蛋白研究的深入,发现PR蛋白不仅在被侵染组织中诱导表达,而在整个植株中都有表达,与系统获得性抗性(systematic acquired resistance,SAR)有关,被认为是SAR的一个显著标志。PR10类蛋白属于类核糖核酸酶,可以降解RNA,有抗细菌和抗真菌的活性[3],有关病毒[4-5]、细菌[6]、真菌[7-9]等病原菌诱导PR10蛋白表达的研究已有广泛报道,作为植物防御系统中的可诱导表达组分,PR10蛋白受多种病原菌的诱导表达,同时PR10蛋白在不同组织、器官及发育时期都有表达,属于组成型表达。植物激素和防御相关的信号分子,包括茉莉酸[10]、脱落酸[11]、水杨酸[12]、赤霉素、茉莉酸甲酯、乙烯也能够调节PR10蛋白的表达。
丹参(Salvia miltiorrhiza Bunge)为唇形科鼠尾草属多年生草本植物,以其干燥根及根茎入药,在临床上被广泛应用于心脑血管疾病以及各种炎症的治疗,是重要的大宗药材,也是栽培面积较大的药材之一。在人工栽培条件下,由于药田生态环境中生物群落多样性差、丰富度低,病虫害优势种群突出,常常发生严重的病虫害,导致药材产量下降,品质变劣,降低丹参药用品质,影响临床药效。近年来,有关丹参的研究多集中在二萜类化合物丹参酮合成途径关键基因的克隆上[13-14],而对于丹参抗病基因的研究则少有报道。
在对课题组前期得到的大量丹参转录组数据的分析中,发现多个植物病程相关基因,本研究采用逆转录聚合酶链式反应(RT-PCR)从丹参中得到了植物病程相关蛋白基因PR10的cDNA全长,将其构建得到含有SmPR10-1的重组质粒pET32a-SmPR10-1,导入大肠杆菌BL21(DE3)中,进行体外诱导表达,并对IPTG浓度、诱导时间、温度等培养条件进行优化,筛选SmPR10-1蛋白的最适表达条件,为进一步研究SmPR10-1基因在丹参抗病中的生物学功能奠定基础。
1 材料和方法
1.1 试验材料
丹参(Salvia miltiorrhiza Bunge)种子采自陕西商洛,种植于人工气候箱内,光照强度为3 000 lx,光周期为光照16h/黑暗8h,温度25℃。种子萌发,长出4片真叶后,移至培养罐中,每个培养罐4颗幼苗,每隔3d换1次Hoagland营养液,培养60d的丹参幼苗做为实验材料,取根、茎、叶,样品采集后液氮冷冻,保存于-80℃冰箱中。表达宿主菌E.coli BL21(DE3)及原核表达载体pET-32a(+)为本实验室保存。
1.2 方 法
1.2.1 SmPR10-1基因克隆与序列分析 采用Trizol法从丹参根中提取总RNA,用NanoDrop 2000进行含量测定,用1%琼脂糖凝胶电泳检测RNA完整性。以提取的RNA为模板,以oligo(dT)18primer为反转录引物,按照RevertAid H Minus Reverse Transcriptase试剂盒(Fermentas公司)说明合成cDNA。根据转录组数据中PR10基因的序列信息,利用Primer 5设计PR10基因编码区的特异引物,正向引物SmPR-10-M1(5′-CGGAATTCATGGGTGTGATCA-3′,下划线部分为EcoRⅠ酶切位点);反向引物SmPR-10-M2(5′-CCGCTCGAGTGTAGTCGGGGTT-3′,下划线部分为XhoⅠ酶切位点),以反转录得到的丹参cDNA为模板,扩增SmPR10-1基因的ORF,用1%的琼脂糖凝胶电泳检测PCR产物,用琼脂糖凝胶回收试剂盒(天根公司)回收目的片段,将回收的PCR产物与pGEM-T Easy vector连接,转化DH5α菌株,在含有氨苄青霉素的LB平板上进行培养,挑取单克隆,经菌液PCR和电泳检测后,挑选阳性克隆送北京华大基因公司测序,将测序结果与转录组数据中的PR10基因序列进行比对,保存序列一致的阳性克隆,准备构建原核表达载体。
通过ExPASy在线服务器的Compute pI/Mw(http://web.expasy.org/compute_pi/)预测SmPR10-1基因编码蛋白质的相对分子量与理论等电点,TargetP 1.1server(http://www.cbs.dtu.dk/services/TargetP/)预测该蛋白的亚细胞定位,SignalP 4.1server(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽分析,TMHMM server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜域分析,PredictProtein server(http://www.predictprotein.org/)进行二级结构预测,SWISSMODEL(http://swissmodel.expasy.org/)进行三维同源建模。用DNAMAN软件对序列进行多重比对,用Clustal W软件与其他植物PR10蛋白的氨基酸序列进行比较,采用MEGA4软件的相邻连接法(neighbor-joining)构建系统进化树,bootstrap重复次数为1 000次。
1.2.2 SmPR10-1原核表达载体的构建与鉴定
用限制性内切酶EcoRⅠ和XhoⅠ分别对原核表达载体pET-32a(+)和测序正确的pGEM-T Easy-SmPR10-1质粒进行双酶切,琼脂糖凝胶电泳检测并切胶回收载体片段和目的基因片段,T4DNA连接酶16℃连接过夜。连接产物转化E.coli BL21(DE3)感受态细胞,在含有氨苄青霉素的LB平板上培养过夜,挑取单克隆,经菌液PCR和双酶切鉴定,挑选阳性克隆送北京华大基因公司测序。
1.2.3 SmPR10-1的诱导表达 挑取测序正确的阳性克隆,接种于含氨苄青霉素的LB液体培养基中,37℃培养过夜后,按照1∶100比例稀释到含氨苄青霉素的LB液体培养基中,220r/min振荡培养至对数生长期(A600为0.6),然后针对诱导温度(15、20、25、30、37℃)、诱导时间(4、6、8、20h)、IPTG浓度(0.1、0.4、0.8、1.0mmol/L),及A600(即诱导起始宿主菌密度0.4、0.6、0.8、1.0)这4个影响原核表达产物积累的因素,当研究其中1种因素时,固定其他3个因素不变,分别分析了这4个因素对丹参SmPR10-1重组蛋白表达的影响。
1.2.4 重组SmPR10-1蛋白的纯化 根据优化的诱导表达条件,在大肠杆菌中大量表达重组SmPR10-1蛋白,获得菌体,超声破碎,破碎液在4℃,12 000r/min离心30min,取上清液经0.45μm滤膜过滤,采用Ni2+亲和层析方法,利用Ni Sepharose 6Fast Flow Purification System(GE Health-care)树脂对滤液进行纯化,然后用不同浓度的咪唑梯度洗脱,SDS-PAGE电泳检测洗脱样品,收集单一目的条带样品进行透析,透析后样品经超滤管浓缩,用Bradford方法对蛋白进行定量,冷冻干燥,-70℃保存。
2 结果与分析
2.1 SmPR10-1的基因克隆与序列分析
通过对课题组前期得到的丹参转录组数据进行分析,根据PR10基因ORF设计特异性引物,扩增得到500bp左右的条带(图1),与转录组数据中PR10基因开放阅读框(ORF)大小一致,测序结果表明SmPR10-1基因的OFR为477bp,编码158个氨基酸,分子量为17.38kD,等电点pI为5.23。
SignalP 4.1server预测,SmPR10-1蛋白不含信号肽,TargetP 1.1server预测,显示SmPR10-1蛋白定位于细胞质,TMHMM server预测该蛋白不含跨膜域。用PredictProtein对SmPR10-1蛋白的二级结构进行预测,结果显示在该蛋白中α-螺旋结构占21.52%,β-折叠占34.81%,无规则卷曲占43.67%(图2,A)。用SWISS-MODEL以樱桃的allergen Pru av 1蛋白为模板(PDB ID:1e09),预测SmPR10-1蛋白的三维结构(图2,B)。结果显示SmPR10-1蛋白包含一个C端由28个氨基酸组成的α螺旋,7个β折叠以及N端在β1和β2折叠之间的1个的短α螺旋。保守的P-loop基序(G-X-GG-X-G)位于β2和β3之间,C端有(K-A-X-E-X-Y)的保守序列(图2,A)。三级结构与已经报道的PR10家族蛋白的空间结构具有很高的相似性,β-折叠在α-螺旋间反向平行排列,构成紧凑的α-β-α夹心结构,具有疏水作用和稳定的多重氢键,这个紧凑的结构可能决定了PR蛋白的高稳定性。

图1 PCR扩增SmPR10-1基因的开放阅读框Fig.1 PCR amplification of SmPR10-1 gene open reading frame M.DL2000;1.SmPR10-1ORF
将SmPR 1 0-1与NCBI GenBank中2 0种植物PR10蛋白进行比对,采用MEGA4软件构建系统进化树,结果(图3)显示,PR10聚为两类,一类是单子叶植物PR10,另一类是双子叶植物PR10,SmPR10-1归属于双子叶植物类,与葡萄、人参亲缘关系最近。
2.2 SmPR10-1基因的原核表达载体构建与鉴定
用限制性内切酶EcoRⅠ和XhoⅠ分别对原核表达载体pET-32a(+)和测序正确的pGEM-T Easy-SmPR10-1质粒进行双酶切,连接得到重组质粒pET32a-SmPR10-1,然后转化E.coli BL21(DE3),挑取单克隆进行菌液PCR和双酶切鉴定,都有500bp左右的目的条带(图4),阳性克隆测序结果显示与目的基因SmPR10-1序列一致,未发生移码突变,表明已成功将SmPR10-1基因克隆到原核表达载体pET-32a上。
2.3 SmPR10-1蛋白的原核表达条件的优化
2.3.1 IPTG浓度对SmPR10-1表达的影响 保持诱导时间8h、诱导温度30℃及起始A600为0.6不变,在0.1、0.4、0.8、1.0mmol/L这4个IPTG浓度下,观察发现IPTG浓度在0.1~1.0mmol/L对SmPR10-1表达量影响不明显(图5)。

图2 SmPR10-1蛋白的结构预测A.二级结构预测;B.三维结构预测Fig.2 Prediction of SmPR10-1protein structure A.Secondary structure prediction;B.Prediction of three-dimensional structure
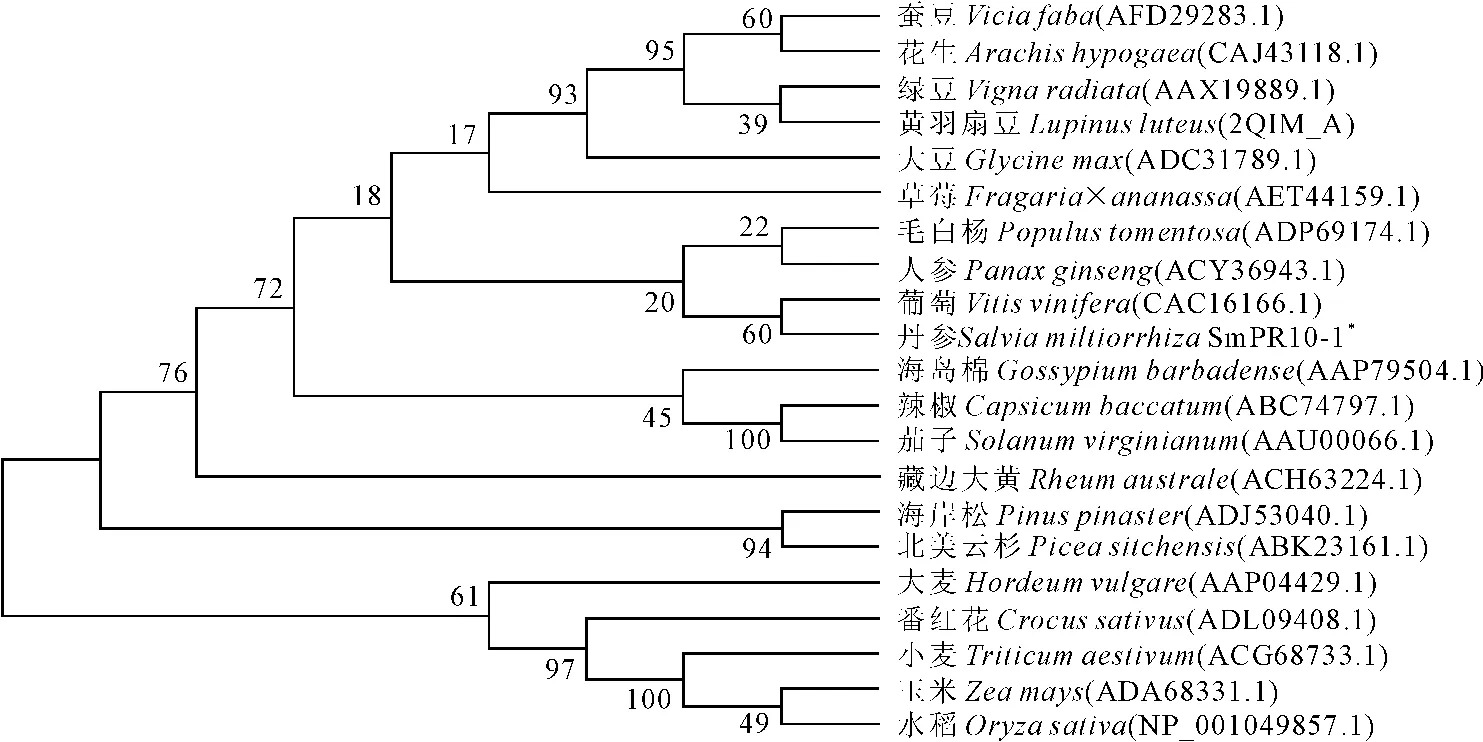
图3 SmPR10-1蛋白与其他物种PR10蛋白的系统进化树分析Fig.3 Phylogenetic tree of SmPR10-1protein and PR10proteins from other species
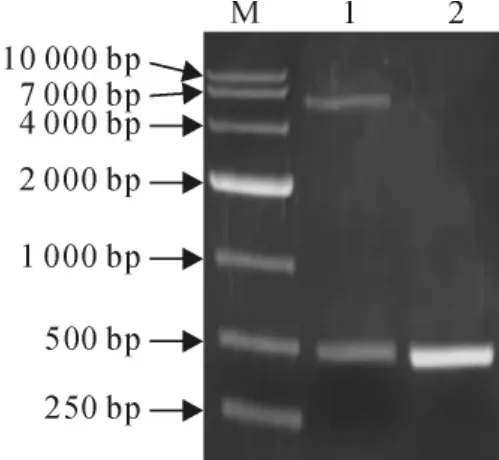
图4 原核表达载体pET32a-SmPR10-1鉴定M.DL10000;1.EcoRⅠ和XhoⅠ双酶切pET32a-SmPR10-1载体;2.阳性克隆的PCR产物Fig.4 The identification of prokaryotic expression vector pET32a-SmPR10-1 M.DL10000;1.pET32a-SmPR10-1digested by EcoRⅠand XhoⅠ;2.PCR product of positive clone
2.3.2 诱导温度对SmPR10-1表达的影响 保持诱导时间8h、IPTG浓度0.4mmol/L及起始A600为0.6不变,不同诱导温度(15℃、20℃、25℃、30℃、37℃)下,发现温度对SmPR10-1表达影响明显,20~30℃诱导均有利于可溶性蛋白的表达,而15℃和37℃时蛋白表达量减少(图6)。
2.3.3 A600对SmPR10-1表达的影响 保持诱导时间8h、诱导温度30℃及IPTG浓度0.4mmol/L不变,观察到在不同起始菌密度(A600为0.4、0.6、0.8、1.0)时加入诱导剂IPTG对SmPR10-1表达有影响,发现起始宿主菌密度(A600=0.8)时,SmPR10-1表达量最高(图7)。
2.3.4 诱导时间对SmPR10-1表达的影响 保持诱导温度30℃、IPTG浓度0.4mmol/L及起始A6000.8不变,研究诱导时间(4、6、8、20h)对SmPR10-1表达的影响,观察到诱导时间对蛋白表达量有明显影响,随着诱导时间的延长,蛋白表达量有随之增加的趋势(图8)。
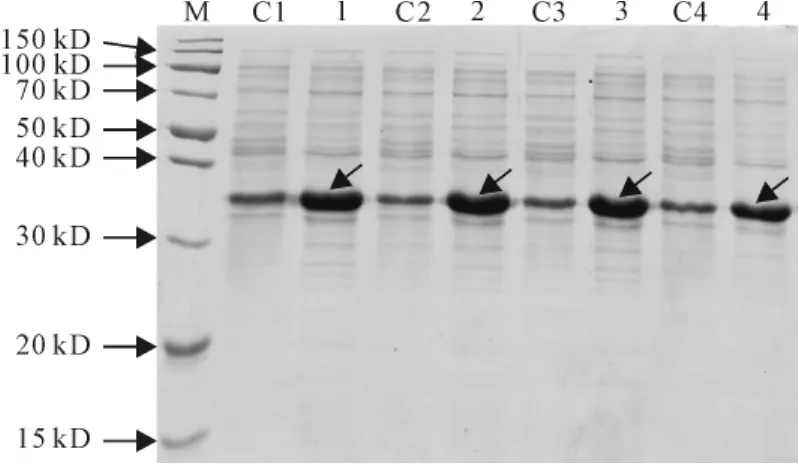
图5 不同IPTG浓度对SmPR10-1蛋白表达的影响M.蛋白分子量标准;C1~C4.含pET32a空载体的E.coli菌株;1~4.分别在0.1、0.4、0.8、1.0mmol/L IPTG浓度诱导的含pET32a-SmPR10-1质粒的E.coli菌株。箭头显示为重组SmPR10-1蛋白Fig.5 Effect of different IPTG concentrations on the expression of SmPR10-1protein M.Protein marker;C1-C4.E.coli containing pET32aused as contro;1-4.E.coli contains pET32a-SmPR10-1induced with 0.1,0.4,0.8and 1.0mmol/L IPTG,respectively.The arrows show the recombinant SmPR10-1protein

图6 不同诱导温度对SmPR10-1蛋白表达的影响M.蛋白分子量标准;C.含pET32a空载体的E.coli菌株;1~5.分别在15℃,20℃,25℃,30℃,37℃诱导的含pET32a-SmPR10-1质粒的E.coli菌株。箭头显示为重组SmPR10-1蛋白Fig.6 Effect of different temperature on the expression of SmPR10-1protein M.Protein marker;C.E.coli containing pET32aused as contro;1-4.E.coli contains pET32a-SmPR10-1induced at 15℃,20℃,25℃,30℃,37℃,respectively.The arrows show the recombinant SmPR10-1protein

图7 不同起始宿主菌密度(A600)对SmPR10-1蛋白表达的影响M.蛋白分子量标准;C1~C4:含pET32a空载体的E.coli菌株;1~4.分别在A600为0.4、0.6、0.8、1.0条件下诱导的含pET32a-SmPR10-1质粒的E.coli菌株。箭头显示为重组SmPR10-1蛋白Fig.7 Effect of different initial density of host bacterium(A600)on the expression of SmPR10-1protein M.Protein marker;C1-C4.E.coli contains pET32aused as contro;1-4.E.coli containg pET32a-SmPR10-1induced at 0.4,0.6,0.8and 1.0A600,respectively.The arrowsshow the recombinant SmPR10-1protein
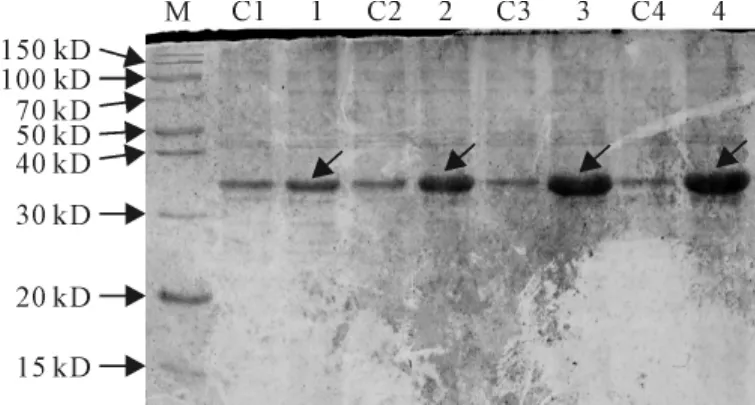
图8 不同诱导时间对SmPR10-1蛋白表达的影响M.蛋白分子量标准;C1~C4.含pET32a空载体的E.coli菌株;1~4.分别诱导4、6、8、20h的含pET32a-SmPR10-1质粒的E.coli菌株。箭头显示为重组SmPR10-1蛋白Fig.8 Effect of different inducing time on the expression of SmPR10-1protein M.Protein marker;C1-C4.E.coli contains pET32aused as control;1-4.E.coli containg pET32a-SmPR10-1 induced with 4,6,8,20h,respectively.The arrows show the recombinant SmPR10-1protein
2.4 重组SmPR10-1蛋白的纯化
根据优化的条件,IPTG浓度0.4mmol/L、起始A600为0.8、诱导温度30℃、诱导时间8h,将重组SmPR10-1蛋白在大肠杆菌中大量表达,收集大肠杆菌菌体,超声破碎,破碎液经过离心取上清液,采用Ni2+亲和层析方法,利用Ni Sepharose 6Fast Flow Purification System(GE Healthcare)树脂进行纯化,得到目的蛋白SmPR10-1(图9),Bradford法测得纯化蛋白浓度为1.02mg·mL-1。

图9 重组SmPR10-1蛋白的纯化M.蛋白分子量标准;1.含pET32a空载体的E.coli菌株作为对照;2.优化条件下诱导的含pET32a-SmPR10-1质粒的E.coli菌株;3、4.纯化后的重组SmPR10-1蛋白(3∶2μg上样;4∶5μg上样)。箭头显示为重组SmPR10-1蛋白Fig.9 Purification of recombinant SmPR10-1protein M.Protein marker;1.E.coli containing pET32aused as control;2.E.coli contains pET32a-SmPR10-1induced under optimized conditions;3,4.The purified recombinant SmPR10-1protein(3∶2μg;4∶5μg).The arrows show the recombinant SmPR10-1protein
3 讨 论
丹参为多年生草本植物,以根入药,在人工栽培条件下,易受到各种病虫害的危害,若长期大量使用农药,一方面易使病虫害产生抗药性,另一方面农药残留会降低丹参的药用品质,影响丹参临床药效。因此从丹参自身挖掘抗性相关基因,培育抗病品种,才是缓解丹参病虫害的根本途径。本研究从丹参中克隆得到病程相关蛋白10基因SmPR10-1,对其核酸及其推测的氨基酸序列分析发现,SmPR10-1基因编码蛋白的N端有典型的富含甘氨酸的P-loop基序(G-X-G-G-X-G),C端有(K-A-X-E-X-Y)的保守序列,说明SmPR10-1蛋白是PR10蛋白家族中的成员(Van Loon[2]、Fernandes[15])。SmPR10-1蛋白不含信号肽,作为细胞质蛋白发挥作用,这与其他PR家族蛋白不同,其它PR家族蛋白大多是位于胞外,具有信号肽序列,先是作为蛋白前体合成,然后在分泌过程中形成成熟蛋白[16]。
大肠杆菌是常用的外源蛋白质表达系统之一,影响外源蛋白可溶性表达的因素有多方面,要增加可溶性蛋白的表达量,除了合理的选择酶切位点、表达载体、宿主菌、试剂外,还可以通过改变培养条件来提高外源蛋白的可溶性表达量,如改变IPTG浓度[17]、诱导温度[18]、诱导时宿主菌的密度(A600)[19]和诱导时间[18]等。本研究将目的基因SmPR10-1构建到表达载体pET32a上,形成重组质粒pET32a-SmPR10-1,然后转化E.coli BL21(DE3),进行蛋白表达。pET32a载体是带有N-端硫氧还蛋白(Trx·Tag)编码序列的融合表达载体,当外源重组蛋白在E.coli中以不溶形式存在时,和Trx· Tag序列融合后,可增加重组蛋白的溶解性[20];此外,表达宿主菌BL21(DE3)可以增加存在于细胞质中蛋白质的二硫键的形成,使得蛋白的可溶性更好,同时,利用pET32a载体表达的重组蛋白N端带有6个His Tag标签,方便后续重组蛋白的纯化[18]。
IPTG浓度、温度、起始菌密度(A600)和诱导时间是影响原核表达的主要因素,本研究发现,IPTG浓度在0.1~1.0mmol/L对SmPR10-1蛋白表达量影响不明显,最终选择IPTG浓度为0.4mmol/L。温度对SmPR10-1表达量有明显影响,从15~37℃均能得到重组蛋白,但是15℃时温度过低,不利于蛋白表达,在30℃时表达量最高,虽然在37℃时也有蛋白表达,但是和30℃条件下相比,表达量却有所降低,这可能是37℃条件下大肠杆菌细胞各种代谢旺盛,生长加快,影响外源重组蛋白的表达,而且有可能使重组蛋白积累形成包涵体,而在25~30℃培养会形成可溶的、有活性的重组蛋白,最终选择诱导温度为30℃[21]。随着诱导时间的延长,SmPR10-1的表达量也随之增加,4h时表达量最低,8h与24h时表达量较高,但是诱导时间过长,重组蛋白的可溶性降低,可能形成包涵体,最终选择8h作为最终诱导时间[22]。
本研究用分子克隆方法得到丹参SmPR10-1基因,通过构建原核表达载体,在大肠杆菌中得到成功表达,在优化表达体系为IPTG浓度0.4mmol/L、起始宿主菌密度A600为0.8、诱导温度30℃、诱导时间8h的条件下,SmPR10-1在大肠杆菌中能够得到很好的表达,采用Ni2+亲和层析得到了纯化的目的蛋白,为进一步研究SmPR10-1蛋白的生物学活性,抗体制备和SmPR10-1基因在丹参抗病方面的生物学功能奠定了基础。
参考文献:
[1] WEN Y J(温韵洁),HE H W(何红卫),HUANG Q SH(黄群声),et al.Roles of pathogenesis-relative protein 10in plant defense response[J].Plant Physiology Communications(植物生理学通讯),2008,44(3):585-592(in Chinese).
[2] VAN LOON L C,REP M,PIETERSE C M J.Significance of inducible defense-related proteins in infected plants[J].Annual Review of Phytopathology,2006,44:135-162.
[3] EDREVA A.Pathogenesis-related proteins:research progress in the last 15years[J].General and Applied Plant Physiology,2005,31(1-2):105-124.
[4] PÜHRINGER H,MOLL D,HOFFMANN-SOMMERGRUBER K,et al.The promoter of an apple Ypr10gene,encoding the major allergen Mal d 1,is stress-and pathogen-inducible[J].Plant Science,2000,152(1):35-50.
[5] PARK C J,KIM K J,SHIN R,et al.Pathogenesis-related protein 10isolated from hot pepper functions as a ribonuclease in an antiviral pathway[J].The Plant Journal,2004,37(2):186-198.
[6] ROBERT N,FERRAN J,BREDA C,et al.Molecular characterization of the incompatible interaction of Vitis viniferaleaves with Pseudomonas syringae pv.pisi:Expression of genes coding for stilbene synthase and class 10PR protein[J].European Journal of Plant Pathology,2001,107(2):249-261.
[7] JWA N S,KUMAR AGRAWAL G,RAKWAL R,et al.Molecular cloning and characterization of a novel Jasmonate inducible pathogenesis-related class 10protein gene,JIOsPR10,from rice(Oryza sativa L.)seedling leaves[J].Biochemical and Biophysical Research Communications,2001,286(5):973-983.
[8] LIU J J,EKRAMODDOULLAH A K,YU X.Differential expression of multiple PR10proteins in western white pine following wounding,fungal infection and cold-hardening[J].Physiologia Plantarum,2003,119(4):544-553.
[9] MCGEE J D,HAMER J E,HODGES T K.Characterization of a PR-10pathogenesis-related gene family induced in rice during infection with Magnaporthe grisea[J].Molecular Plant-Microbe Interactions,2001,14(7):877-886.
[10] RAKWAL R,AGRAWAL G K,YONEKURA M.Light-dependent induction of OsPR10in rice(Oryza sativa L.)seedlings by the global stress signaling molecule jasmonic acid and protein phosphatase 2Ainhibitors[J].Plant Science,2001,161(3):469-479.
[11] WANG C S,HUANG J C,HU J H.Characterization of two subclasses of PR-10transcripts in lily anthers and induction of their genes through separate signal transduction pathways[J].Plant Molecular Biology,1999,40(5):807-814.
[12] EKRAMODDOULLAH A K M,TAN Y,YU X,et al.Identification of a protein secreted by the blister rust fungus Cronartium ribicola in infected white pines and its cDNA cloning and characterization[J].Canadian Journal of Botany,1999,77(6):800-808.
[13] GAO W,HILLWIG M L,HUANG L,et al.A functional genomics approach to tanshinone biosynthesis provides stereochemical insights[J].Organic Letters,2009,11(22):5 170-5 173.
[14] DAI Z,CUI G,ZHOU S F,et al.Cloning and characterization of a novel 3-hydroxy-3-methylglutaryl coenzyme A reductase gene from Salvia miltiorrhizainvolved in diterpenoid tanshinone accumulation[J].Journal of Plant Physiology,2011,168(2):148-157.
[15] FERNANDES H,MICHALSKA K,SIKORSKI M,et al.Structural and functional aspects of PR-10proteins[J].FEBS Journal,2013,280(5):1 169-1 199.
[16] ZHANG Y(张 玉),YANG A G(杨爱国),FENG Q F(冯全福),et al.Plant pathogenesis-related proteins and research progress in tobacco[J].Biotechnology Bulletin(生物技术通报),2012,5:20-24(in Chinese).
[17] BANEYX F.Recombinant protein expression in Escherichia coli[J].Current Opinion in Biotechnology,1999,10(5):411-421.
[18] ROSANO G L,CECCARELLI E A.Recombinant protein expression in Escherichia coli:advances and challenges[J].Frontiers in Microbiology,2014,5(4):172.
[19] CHOI J H,KEUM K C,Y LEE S.Production of recombinant proteins by high cell density culture of Escherichia coli[J].Chemical Engineering Science,2006,61(3):876-885.
[20] YASUKAWA T,KANEI-ISHII C,MAEKAWA T,et al.Increase of solubility of foreign proteins in Escherichia coli by coproduction of the bacterial thioredoxin[J].Journal of Biological Chemistry,1995,270(43):25 328-25 331.
[21] SCHEIN C H,NOTEBORN M H.Formation of soluble recombinant proteins in Escherichia coli is favored by lower growth temperature[J].Nature Biotechnology,1988,6(3):291-294.
[22] GALLOWAY C A,SOWDEN M P,SMITH H C.Increasing the yield of soluble recombinant protein expressed in E.coli by induction during late log phase[J].Biotechniques,2003,34(3):524,526,528,530.
(编辑:宋亚珍)
Cloning and Expression Analysis of Pathogenesis-related Protein 10Gene of Salvia miltiorrhiza
ZHAO Le1,MA Ligang1,WANG Zhishuang2,SHEN Ye2,ZHENG Xiaoke1
(1School of Pharmacy,Henan University of Traditional Chinese Medicine,Zhengzhou 450046,China;2National Resource Center for Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijing 100700,China)
The synthesis of pathogenesis-related proteins(PR)is one prominent feature of plant defense responses on abiotic or non-abiotic stress situations.According to the transcriptome data of Salvia miltiorrhiza,designing specific primers and using reverse transcription-polymerase chain reaction(RT-PCR),we isolated an open reading frame of pathogenesis-related protein 10(PR10)fromS.miltiorrhizaand named as SmPR10-1(GenBank Accession No.KF877034).The results indicated that:(1)SmPR10-1has an open reading frame(ORF)of 477bp,which encoded a protein of 158amino acid residues,with a predicted molecular mass of 17.38kD.(2)Bioinformatic analysis indicated that SmPR10-1protein showed the highest homology,69%identity,with PR10protein fromVitis vinifera with the same conserved sequence(G-X-GG-X-G)and(K-A-X-E-X-Y).(3)Escherichia coli BL21cells were transformed with the expression vector pET32a-SmPR10-1and used for prokaryotic expression.Meanwhile,the four factors,inducing IPTG concentrations,initial density of host bacterium(A600),inducing temperature and inducing time,which influenced protein expression,were optimized.The optimum expression conditions of SmPR10-1were final IPTG concentration of 0.4mmol/L,A600of 0.8,and the inducing time of 8hat 30℃.Finally,the recombi-nant SmPR10-1protein was purified through Ni2+affinity chromatography.The results of this study provided not only the first and fundamental information about SmPR10-1gene,but also a candidate gene for future genetic engineering of Chinese medical herbs,S.miltiorrhiza,against pathogen attack.
Salvia miltiorrhiza;pathogenesis-related protein;bioinformatic analysis;prokaryotic expression;optimization of expression condition
Q785;Q786
A
10.7606/j.issn.1000-4025.2015.06.1078
1000-4025(2015)06-1078-07
2015-02-03;修改稿收到日期:2015-04-17
国家自然科学基金(81173490,8130070);河南中医学院博士科研基金(BSJJ2011-07)
赵 乐(1983-),男,博士,讲师,主要从事药用植物分子生物学研究。E-mail:zhaole1983@126.com

