叶子花脱落酸生物合成关键酶基因NCED的克隆及调节开花功能初探
田亚然,薛璟祺,赵家昱,彭 坚,谷 茂,李永红*
(1深圳职业技术学院应用化学与生物技术学院,广东深圳518055;2中国农业科学院蔬菜花卉研究所,北京100081;3河北农业大学园艺学院,河北保定071001;4四川农业大学风景园林学院,成都611130)
叶子花脱落酸生物合成关键酶基因NCED的克隆及调节开花功能初探
田亚然1,3,薛璟祺2,赵家昱1,4,彭 坚1,谷 茂1,李永红1*
(1深圳职业技术学院应用化学与生物技术学院,广东深圳518055;2中国农业科学院蔬菜花卉研究所,北京100081;3河北农业大学园艺学院,河北保定071001;4四川农业大学风景园林学院,成都611130)
以叶子花品种‘大红宝巾’(Bougainvillea glabra‘Mrs Butt’)的2年生扦插苗为试验材料,克隆到了一个9-顺式-环氧类胡萝卜素双氧合酶(NCED)同源基因,并分析了内源脱落酸(ABA)含量及NCED活性等变化与该基因表达之间的内在联系,探讨ABA对促进叶子花开花的作用机理。结果表明:(1)外源50mg·L-1ABA处理促进了叶子花开花,而与10μmol·L-1的去甲二氢愈创木酸(NDGA,ABA合成抑制剂)共处理可抑制这种效果。(2)外源ABA处理可诱导叶子花叶片中内源ABA含量和NCED含量与活性上升,这种诱导可被NDGA抑制。(3)克隆得到的NCED基因全长为2 380bp,其推定的编码蛋白包含618个氨基酸残基,与草莓中的FvNCED1同源性最高,命名为BgNCED1。(4)Real-time PCR结果显示,外源ABA处理显著诱导BgNCED1基因的表达,而10μmol·L-1的NDGA可显著抑制BgNCED1基因的诱导效果,这种表达模式与内源ABA含量及NCED活性等的变化趋势较为一致。研究认为,外源ABA可能通过诱导BgNCED1的表达,增强内源ABA的生物合成,进而促进叶子花从营养生长到生殖生长的转变,使其提前开花。
脱落酸;叶子花;花朵开放;9-顺式-环氧类胡萝卜素双氧合酶(NCED);基因表达
脱落酸(abisicsic acid,ABA)作为一种重要的植物激素,不仅作为干旱诱导的信号分子在抵御环境胁迫中起重要作用,而且还广泛参与了植物的成花诱导、花芽分化及开花调控等过程[1],目前在牵牛[2]、夜来香[3]等植物中已有相关报道。已有研究表明,外源ABA处理可显著诱导荔枝叶片中ABA的生成,同时提高了荔枝的成花率[4]。在高等植物ABA生物合成过程中,9-顺式-环氧类胡萝卜素双氧合酶(Nine-cis-epoxy carotenoid dioxygenase,NCED)是主要的限速酶之一,而编码该酶的NCED基因多以基因家族的形式存在。很多研究证实,植物中NCED基因表达量的变化与ABA含量有直接关系。在拟南芥中,已经克隆到9个NCED基因,其中AtNCED3的高表达可显著提高其内源ABA的水平[5]。
叶子花(Bougainvillea glabra)属紫茉莉科(Nyctaginaceae)叶子花属常绿攀援灌木,俗称三角梅、三叶梅等。叶子花原产巴西,作为亚热带地区常见的庭院观赏植物,在中国南方如广东、云南等地区广泛种植。在栽培过程中,由于水分过多等原因,极易造成花朵不能正常开放或花期不集中现象。目前,叶子花相关的研究主要集中在生物学特性[6]和生理生化[7]等方面。花期调控也主要集中在环境调控和植株修剪等方面[8-9],相关机理研究较少。作者前期研究已表明,外源ABA对叶子花的成花具有促进作用,并对其相关酶活性等进行了系统分析[10],但仍缺少分子调控机理方面的直接证据。ABA生物合成及其调控是一个相对复杂的过程,是多种因素共同作用的结果。NCED作为其合成途径中的一个限制酶基因,是研究ABA生物合成分子调控的重要切入点。本研究从叶子花中首次克隆到了一个NCED同源基因,并分析了内源ABA含量及NCED活性等变化与该基因表达之间的内在联系,推测其在调控叶子花开花过程中的作用,这些结果可为进一步研究叶子花ABA的分子调控机理提供依据。
1 材料和方法
1.1 材料及处理
试验于2012年10月至2014年4月在深圳职业技术学院园林实训基地进行。供试材料来自深圳市莲花山公园盆栽叶子花品种‘大红宝巾’(B.glabra‘Mrs Butt’),全部为生长健壮,长势一致的两年生扦插苗。不同植株随机分为4组,分别利用4种处理溶液对叶面进行正反面喷施,每处理5盆,3次重复。4种处理液分别为:(1)清水(0+0);(2)50 mg·L-1ABA(50+0);(3)50mg·L-1ABA+5 μmol·L-1NDGA(50+5);(4)50mg·L-1ABA+10μmol·L-1NDGA(50+10)。其中,去甲二氢愈创木酸(Nordihydroguaiaretic acid,NDGA)是ABA的合成抑制剂,其主要功能是阻断胁迫诱导的ABA积累,可以抑制包括NCED在内的ABA合成关键酶活性。ABA和NDGA的使用浓度根据先前结果确定[10],50mg·L-1ABA能使叶子花提前开花,且这种提前能被浓度为10μmol·L-1的NDGA所抑制,而5μmol·L-1的NDGA能达到部分抑制的效果。
喷施时以叶面滴水为限,每5d处理1次,共喷施3次,温室养护。首次喷施为2013年7月10日,10d后3次喷施完成,开始取样,每周取样1次,共计4次。取样部位为植株嫩叶,取样后立即测定相关指标或经液氮速冻后存放于-80℃冰箱备用。
1.2 测定指标与方法
1.2.1 内源ABA含量 取每株植物顶芽往下第4~6叶位无病害功能叶,准确称量1g后迅速用液氮固定并贮存于-80℃冰箱中备用。将1g样品于液氮中研磨成粉,转入10倍量80%冰甲醇中,于4℃下不断搅拌,避光提取12h,再于4℃、5 000 r/min离心15min,取上清,残渣加5mL 80%冰甲醇,提取4h,离心,取上清。合并上清液,以Waters Sep-Pak C18小柱富集ABA,洗脱液经N2吹干,用1 mL色谱甲醇溶解,过0.45有机系微孔滤膜,用Agilent1100HPLC测ABA含量。进样量20μL,Agilent Eclipse Plus C18色谱柱,流动相为甲醇-水-甲酸(体积比为45∶54.2∶0.8),流速1.0 mL/min,检测波长为254nm。
1.2.2 NCED含量及活性 取1g叶片鲜样,加9 mL PBS(pH 7.4)充分匀浆,于4℃、3 000r/min离心25min,取上清。采用酶联免疫法进行NCED含量与活性的同步检测,重复3次。
1.2.3 总RNA的提取及cDNA第一链的合成 用Trizol(Invitrogen公司)试剂提取嫩叶总RNA。用琼脂糖凝胶电泳鉴定RNA的完整性。以提取的总RNA为模板,用M-MLV反转录酶(TaKaRa公司)合成第1链;反转录反应参照Ferrnentas RevertAidTMFirst strand cDNA synthesis Kit使用说明。1.2.4 BgNCED1基因全长克隆 基因保守片段的克隆:根据NCBI已报道的拟南芥等植物NCED基因序列用生物信息学软件Primer Premier 5.0对比分析,以保守域为模板设计简并引物,序列分别为:NCEDF1:5′-ATGATGCAYGAYTTYGCMATCACVGA-3′,NCEDR:5′-GGCCAYGGSTCDGCMABYGCYARGTA-3′;以反转的cDNA第1链为模板进行目的基因保守片段的克隆。反应程序为:94℃5min;94℃30s,45℃30s,72℃30s,5个循环;94℃30s,51℃30s,72℃30s,30个循环;72℃10min。
1.2.5 实时荧光定量PCR qRT-PCR仪为ABI PRISM®7500Sequence Detection System,RNA提取试剂盒为Hipure Plant RNA Kits,PCR引物:up:5′-AAGTCTACACGTCGGGCAAT-3′;down:5′-TCTGCTCTCCATAGATGTGCTT-3′。内参为18SrRNA,片段大小190bp;引物为:up:5′-GGGGCATTCGTATTTCATAG TC-3′;down:5′-CGGTATCTGATCGTCTTCGAG-3′。反应体系为:cDNA(1∶20)模板5.0μL,上游引物0.5μL,下游引物0.5μL,2×SYBR Green qPCR SuperMix 10μL,dH2O定容至20μL。PCR反应程序为:50℃2min;95℃2min;95℃15s,60℃32s,读板,40个循环,溶解曲线分析温度为60℃~95℃。所有样品重复3次。
2 结果与分析
2.1 不同处理对叶子花开花的影响
叶子花植株经ABA及其合成抑制剂NDGA等处理后均进行正常养护,对照组,即清水处理(0+ 0)于8月18日(处理后29d)萼片露红,9月20日(处理后62d)始花。分别以这两个时间点为露红期和始花期的0点,统计了不同处理对叶子花露红期和始花期提前的影响。
由图1可知,50mg·L-1ABA(50+0)处理后,叶子花植株露红期和始花期分别提前了3d(处理后26d)和5d(处理后57d),而50mg·L-1ABA+5μmol·L-1NDGA(50+5)处理则分别提前了8d(处理后21d)和9d(处理后53d);当NDGA的浓度进一步增大时,其对ABA的抑制作用逐渐明显,当以50mg·L-1ABA+10μmol· L-1NDGA(50+10)处理时,始花期仅提前1d(处理后61d),露红期和对照相当(处理后29d)。这些结果表明,外源ABA处理能促进叶子花花朵开放,主要表现在使露红期和始花期提前;低浓度的NDGA处理能够增强ABA的促进效果,而高浓度的NDGA处理则抑制了ABA的促进作用。
2.2 不同处理对叶子花内源ABA含量的影响
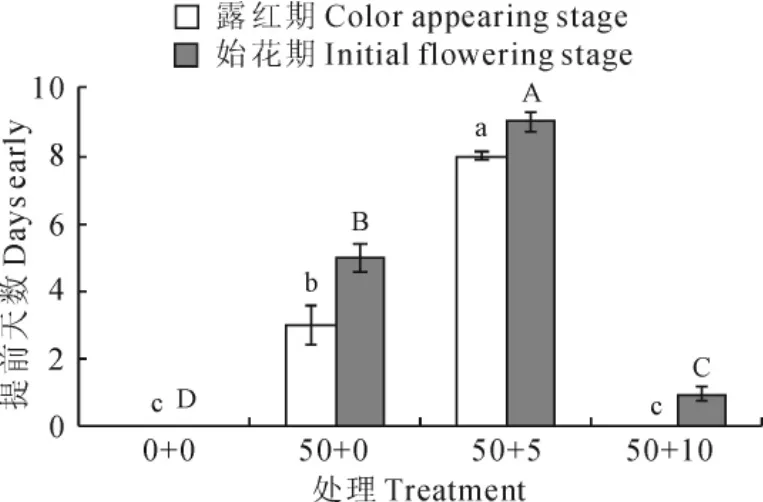
图1 不同浓度ABA和NDGA处理对叶子花花朵开放的影响0+0代表清水对照;50+0代表50mg·L-1ABA处理;50+5代表50mg·L-1ABA+5μmol·L-1NDGA处理;50+10代表50mg·L-1ABA+10μmol·L-1NDGA处理。下同。小写字母表示不同处理间露红期的差异显著性(P<0.05);大写字母表示不同处理间始花期的差异显著性(P<0.05)Fig.1 The effect of different concentrations of ABA and NDGA treatments on the flowering of B.glabra 0+0means the water control;50+0means the treatment with 50mg·L-1ABA;50+5means the treatment with 50mg·L-1ABA+5μmol·L-1NDGA;50+10 means the treatment with 50mg·L-1ABA+10μmol·L-1NDGA.The same as below.Lowercase means significant difference at 0.05level of color appearing stage among different treatments;Majuscule means significant difference at 0.05level of initial flowering stage among different treatments
叶子花植株经ABA及NDGA处理后,其内源ABA含量变化受到一定的影响(图2)。其中,在处理后1d时,各处理ABA含量均处于较高水平,随后均有不同程度下降,但在处理后29d时略有回升;与对照(0+0)相比,ABA单独处理(50+0)能够显著促进内源ABA的积累;低浓度NDGA与ABA共同处理(50+5)时抑制了这种促进作用,其内源ABA含量与对照基本持平;高浓度的NDGA处理(50+10)对内源ABA的抑制作用更为明显,尤其是处理初期,其内源ABA含量显著低于对照。这些结果表明,叶子花从营养生长向生殖生长转换伴随着内源ABA积累的变化,外源ABA能够促进内源ABA的累积,而且一定浓度的NDGA能抑制外源ABA对内源ABA的积累促进效果。
2.3 不同处理对叶子花叶片NCED含量及活性的影响
不同处理对叶子花叶片NCED含量及活性都有一定的影响。其中,对照(清水处理)叶子花叶片NCED含量在开花前呈先下降再缓慢上升的变化趋势,50mg·L-1的ABA处理后叶片中NCED含量在前22d时均显著高于对照,5和10μmol·L-1的NDGA均可抑制外源ABA诱导的NCED含量的升高,且后者效果更为明显(图3,A);叶子花叶片NCED活性表现略有不同,对照在处理后8d其活性略有下降,随后恢复到处理后1d水平,50mg· L-1的ABA处理后显著提高了NCED活性,而不同浓度的NDGA处理均可抑制由外源ABA诱导的NCED活性升高,且高浓度NDGA表现出的抑制作用更强(图3,B)。以上结果表明,外源ABA能诱导叶子花叶片中NCED含量和活性的上升,而NDGA能抑制(或部分抑制)这种上升,在本研究范围内这种抑制和NDGA浓度正相关。

图2 不同处理下叶子花叶片内源ABA含量的变化不同小写字母表示同期处理间在0.05水平存在显著性差异;下同Fig.2 The generation of endogenous ABA in leaves of B.glabra under different treatments The different normal letters mean significant difference among different treatments at 0.05level;The same as below

图3 不同处理下叶子花叶片NCED含量及活性的变化Fig.3 The NCED enzyme content and activity in leaves of B.glabra under different treatments
2.4 叶子花BgNCED1基因全长克隆与序列分析
为了进一步明确NCED对叶子花开花的影响,本研究根据Genbank中NCED类基因并结合RACE方法,在叶子花花瓣中克隆得到一个NCED同源基因。
该基因全长2 380bp,包含一个1 857bp的ORF区域、206bp的5′非翻译区和317bp的3′非翻译区。其推定的编码蛋白包含618个氨基酸,分子量为68.2kD,理论等电点为7.43。将该蛋白质氨基酸序列提交到Genbank进行BLAST比对,发现其和野草莓(Fragaria vesca)、苹果(Malus domestica)、梅花(Prunus mume)等中的NCED类蛋白同源性较高,其中和野草莓中FvNCED1(XP_004300667.1)同源性最高,达到了90.9%。因此,将本研究克隆得到的基因命名为BgNCED1。
通过不同物种序列对比发现,BgNCED1编码蛋白和其他物种在N端差异性较大,在大约100aa以后保守性增大。进一步研究发现,BgNCED1编码蛋白包含NCED类蛋白的典型特征,包括1个两亲性的α-螺旋区域、2个NCED的特征区域和4个保守的组氨酸残基(图4)。
NCED属于类胡萝卜素裂解双加氧酶(carotenoid cleavage dioxygenase,CCD)家族,其重要功能为催化类胡萝卜素氧化裂解,生成脱辅基类胡萝卜素。通过BgNCED1与拟南芥CCD家族的系统进化树分析表明,其推定的氨基酸序列与AtNCED3聚为一支,表明BgNCED1与AtNCED3可能具有相似的生理功能和表达模式(图5)。

图4 BgNCED1推定的氨基酸序列与其他植物NCED蛋白序列比对VvNCED1:葡萄(NP_001268199);StNCED1:马铃薯(NP_001275103);AtNCED3:拟南芥(NP_188062)。下划线序列为转运肽氨基酸序列;双下划线为具有两亲性的α-螺旋区;方框内为发挥功能所需的4个保守组氨酸残基Fig.4 Alignment of the amino acid residues of BgNCED1with NCED proteins from other plants VvNCED1.Vitis vinifera(NP_001268199);StNCED1.Solanum tuberosum(NP_001275103);AtNCED3.Arabidopsis thaliana(NP_188062).A putative chloroplast-targeting transit peptide is underlined;The putative amphipathicα-helix domain is double-underlined;Four conserved histidine residues required for activity are marked by the square
2.5 不同处理对BgNCED1表达变化的影响
本研究通过荧光定量PCR检测了BgNCED1的表达变化。结果表明,叶子花对照在处理8d后BgNCED1表达量略有下降,到后期又有所恢复;ABA处理显著诱导了BgNCED1的表达,在处理后1d即达到了对照的2.2倍,处理22d后诱导表达达到最大,为对照的4.6倍,随后有所降低;ABA与不同浓度的NDGA共同处理均抑制了ABA对BgNCED1表达的诱导作用,所不同的是,5μmol· L-1的NDGA在整个处理过程中BgNCED1的表达量仍高于对照或与对照基本持平,而10μmol· L-1的NDGA对BgNCED1的抑制效果更为明显,到处理后22d时,其表达量已显著低于对照(图6)。

图5 BgNCED1与拟南芥NCED蛋白的系统进化分析Fig.5 Phylogenetic tree among BgNCED1 and its orthologues in Arabidopsis thaliana

图6 不同处理下BgNCED1表达变化特征Fig.6 The expression of BgNCED1 under different treatments
3 讨 论
ABA能够调控植物成花和花期,如高浓度的内源ABA对橄榄树花芽形成与分化起促进作用[11],我们前期的工作也表明,ABA是影响叶子花成花的主要因子[10]。在本研究中,外源ABA处理能使叶子花露红期和始花期提前,并且促进了内源ABA的合成;利用ABA的合成抑制剂NDGA与ABA竞争性处理,发现NDGA在抑制ABA合成的同时,也抑制了其促进成花提前的效果,进一步验证了叶子花从营养生长到生殖生长转变需要ABA的参与。值得注意的是,低浓度的NDGA处理增强了ABA的效果,使植株提前开花。分析其原因,可能是5μmol·L-1NDGA没有达到抑制ABA的合成的浓度阈值,但作为信号,诱导了ABA的反馈调节,但具体原因还需后续试验验证。
关于ABA的生物合成途径,目前已基本明确,主要是通过一系列的酶促反应,即由C40类胡萝卜素降解形成ABA,其中NCED是催化ABA合成的主要限速酶。本研究中,ABA处理可提高植株的NCED含量和活性,这可能就是导致内源ABA升高的主要原因。通过NDGA的反向实验也验证了这一结果。
编码NCED的基因首先在玉米ABA缺失突变体viviparousl4(vpl4)中获得[12],之后陆续从菜豆[13]、拟南芥[14]和柑橘[15]等植物中分离,近年来在多种观赏植物中也克隆得到,如唐菖蒲[16]、牡丹[17]等。NCED基因编码的氨基酸序列在不同物种中高度保守,除了具有转运所需的转运肽序列和两亲性的α-螺旋外,还有发挥催化活性必需的4个保守组氨酸残基。通过对BgNCED1的氨基酸系列分析发现,其在N末端有一段转运肽序列,还有一个α-螺旋的两亲性结构区,这个结构的主要功能是蛋白定位,可以将该蛋白结合到质体膜上,与底物发生作用;同时在BgNCED1中也检测到了全部4个保守的组氨酸残基,这些结果都可进一步验证克隆得到的基因属于NCED家族。另外,通过与拟南芥NCED基因家族的进化分析,发现BgNCED1与AtNCED3同源性最高,意味着这两个基因在功能上也可能有更高的相似性,可在今后的工作中进一步研究。
在基因调控方面,研究表明,高等植物NCED基因的转录调控是ABA生物合成的主要调控步骤[14]。现已明确,拟南芥中AtNCEDs是调控ABA合成的主要基因,且各基因之间存在一定的分工;在越橘(Vaccinium myrtillus)果实成熟过程中,伴随着ABA含量的增加,VmNCED1也大量表达,表明其对ABA生物合成存在调控作用[18];而在葡萄果实成熟前,ABA的积累主要是VvNCED1的高水平表达[19]。在观赏植物方面,近年来关于NCED也有一些报道,在唐菖蒲种球贮藏及休眠解除过程中,其ABA生物合成可能主要受GhNCED基因的调控[16];在牡丹中,利用外源ABA处理牡丹花瓣,发现Ps-NCED1表达量变化与内源ABA含量变化趋势一致,推测该基因是调控内源ABA含量的主要基因[17]。本研究中,BgNCED1表达与内源ABA含量及NCED活性等的变化较为一致,推测外源ABA可能通过诱导BgNCED1的表达,进而使得NCED含量和活性达到较高水平,促进了内源ABA的生物合成,从而促进了叶子花从营养生长到生殖生长转变,提前开花。此外,本研究还发现,NDGA处理在前期和后期(处理后第1天和第9天)抑制了BgNCED1的表达。一般情况下,生物体内特定酶活性的变化与其生物合成限速酶基因之间存在着反馈调节或应答。因此,该结果也从另一个方面证明了BgNCED1对于ABA的生物合成存在调节功能。
总之,NCED是ABA合成途径的一个限制酶。明确叶子花BgNCED1的表达模式,可为从分子层面了解ABA对促进叶子花开花的作用机理提供数据支持,也可为进一步利用基因工程改良叶子花成花奠定基础,而关于ABA对叶子花的调控机理值得深入研究。
[1] KOSHITA Y,TAKAHARA T.Effect of water stress on flower-bud formation and plant hormone content of Satsuma mandarin(Citrus unshiu Marc.)[J].Scientia Horticulturae,2004,99:301-307.
[2] TAKENO K,MAEDA T.Abscisic acid both promotes and inhibit sphotoperiodic flowering of Pharbitis nil[J].Physiol.Plant,1996,98:467-470.
[3] SU W R,HUANG K L,SHEN R S,et al.Abscisic acid affects floral initiation in Polianthes tuberose[J].Journal Plant Physiol.,2002,159:557-559.
[4] ZHOU B Y(周碧燕),LI Y B(李宇彬),CHEN J ZH(陈杰忠),et al.Effects of low temperature stress and ABA on flower formation and endogenous hormone of Litchi[J].Acta Horticulturae Sinica(园艺学报),2002,29(6):577-578(in Chinese).
[5] WEI K F(魏开发),JIA W S(贾文锁),LIN Z Y(林子英),et al.Efect of NCED3gene estradiol-induced expression on ABA biosynthetic genes and metabolic enzyme gene expression[J].Joural of Hubei University for Nationalities(Nat.Sci.Edi.)(湖北民族学院学报·自然科学版),2009,27(1):70-80(in Chinese).
[6] XU F X(徐凤侠),WANG L SH(王亮生),SHU Q Y(舒庆艳),et al.Progress of study of the biology of the resource plant Bougainvillea[J].Chinese Bulletin of Botany(植物学通报),2008,24(4):483-490(in Chinese).
[7] LIN L X(林丽仙),XIE ZH N(谢志南),SU M H(苏明华),et al.Effects of electrostatic field on rooting and some physiological and biochemical function of Bougainvilleacuttings[J].Chinese Journal of Tropical Crops(热带作物学报),2010,31(10):1 730-1 735(in Chinese).
[8] CHEN Y K(陈永康).Flowering control technology of Bougainvillea spectabilis Willd[J].Journal of Guangdong Landscape Architecture(广东园林),1994,3:12(in Chinese).
[9] TANG Y G(唐玉贵),ZHU J Y(朱积余),HUANG Y G(黄亚光),et al.Study on flower period control of Bougainvilleaspp.[J].Journal of West China Forestry Science(西部林业科学),2006,35(1):36-39(in Chinese).
[10] ZHAO J Y(赵家昱),PAN Y ZH(潘远志),LI Y H(李永红).Effects of abscisic acid on flowering and some key enzymes of Bougainvillea glabra[J].Acta Horticulturae Sinica(园艺学报),2014,41(10):2 085-2 093(in Chinese).
[11] ULGER S,SONMEZ S,KATKACIER M,et al.Determination of endogenous hormones,sugars and mineral nutrition levels during the induction,initiation and differentiation stage and their effects on flower formation in olive[J].Plant Growth Regulation,2004,42:89-95.
[12] TAN B C,SCHWARTZ S H,ZEEVAART J A D,et al.Genetic control of abscisic acid biosynthesis in maize[J].Proceedings of the National Academy of Sciences,1997,94(22):12 235-12 240.
[13] QIN X,ZEEVAART J A D.The 9-cis-epoxycarotenoid cleavage reaction is the key regulatory step of abscisic acid biosynthesis in waterstressed bean[J].Proceedings of the National Academy of Sciences,1999,96(26):15 354-15 361.
[14] IUCHI S,KOBAYASHI M,TAJI T,et al.Regulation of drought tolerance by gene manipulation of 9-cis-epoxycarotenoid dioxygenase,a key enzyme in abscisic acid biosynthesis in Arabidopsis[J].Plant J.,2001,27:325-333.
[15] RODRIGO M J,ALQUEZAR B,ZACARÍAS L.Cloning and characterization of two 9-cis-epoxycarotenoid dioxygenase genes,differentially regulated during fruit maturation and under stress conditions,from orange(Citrus sinensis L.Osbeck)[J].Journal of Experimental Botany,2006,57(3):633-643.
[16] LUO X,YI J,ZHONG X H,et al.Cloning,characterization and expression analysis of key genes involved in ABA metabolism in Gladiolus cornels during storage[J].Scientia Horticulturae,2012,143:115-121.
[17] WANG X Q(王晓庆),ZHANG CH(张 超),WANG Y J(王彦杰),et al.Isolation and expression of 9-cis epoxycarotenoid dioxygenase gene in tree Peony[J].Acta Horticulturae Sinica(园艺学报),2012,39(10):2 033-2 044(in Chinese).
[18] KARPPINEN K,HIRVELA E,NEVALA T,et al.Changes in the abscisic acid levels and related gene expression during fruit development and ripening in bilberry(Vaccinium myrtillus L.)[J].Phytochemistry,2013,95:127-134.
[19] WANG Y SH(王延书),LI CH L(李春丽),et al.Studies on transcriptional level of VvNCED1and VvBG1,two key genes related to ABA accumulation around the veraison of grape berry ripening[J].Acta Horticulturae Sinica(园艺学报).2010,37(5):801-804(in Chinese).
(编辑:裴阿卫)
Isolation of NCED,the Key ABA Biosynthesis Gene and Its Function Analysis in Flowering Regulation of Bougainvillea glabra
TIAN Yaran1,3,XUE Jingqi2,ZHAO Jiayu1,4,PENG Jian1,GU Mao1,LI Yonghong1*
(1School of Applied Chemistry and Biotechnology,Shenzhen Polytechnic,Shenzhen,Guangdong 518055,China;2Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences,Beijing 100081,China;3College of Horticulture,Agricultural University of Hebei,Baoding,Hebei 071001,China;4College of Landscape Architecture,Sichuan Agricultural University,Chengdu 611130,China)
In this study,Bougainvillea glabra‘Mrs Butt’was used to analyze the regulation mechanism of ABA in promoting its flowering promotion.The results showed that:(1)50mg·L-1ABA treatment promotes B.glabraflowering,and 10μmol·L-1NDGA(Nordihydroguaiaretic acid,one kind of ABA biosynthesis inhibitor)treatment inhibited this effect.(2)Exogenous ABA treatment increased the content of endogenous ABA and the enzyme content and activity of nine-cis-epoxy carotenoid dioxygenase(NCED)in B.glabraleaves,and these inductions could be inhibited by NDGA treatment.(3)The full length of cloned NCEDgene was 2 380bp,and the putative encoding protein is 618aa,which showed the highest homologywith FvNCED1in the strawberry,and was named as BgNCED1.(4)Real-time PCR results showed that the expression of BgNCED1was significantly induced by ABA treatment,and 10μmol·L-1NDGA could significantly inhibit the induction effect.This expression pattern was similar to the changes of endogenous ABA content and NCED enzyme activity.Therefore,exogenous ABA may enhance endogenous ABA biosynthesis through the induction of BgNCED1expression,which promoted B.glabra from vegetative growth to reproductive growth,and ultimately make it flowering early.
ABA;Bougainvillea glabra;flower opening;nine-cis-epoxy carotenoid dioxygenase(NCED);gene expression
Q789
A
10.7606/j.issn.1000-4025.2015.06.1106
1000-4025(2015)06-1106-07
2014-12-19;修改稿收到日期:2015-03-30
深圳市科技项目(2112K3070004)
田亚然(1988-),女,在读硕士研究生,主要从事园林植物开花生理研究。E-mail:245824586@qq.com
*通信作者:李永红,教授,博士,主要从事园林植物开花生理与分子生物学研究。E-mail:liyonghong_03@163.com

