生菜硝酸还原酶基因的克隆及高氮水平下外源γ-氨基丁酸对其表达和叶片硝酸盐含量的影响
田 真,李敬蕊,王 祥,吴晓蕾,宫彬彬,高洪波
(河北农业大学园艺学院,河北保定071001)
生菜硝酸还原酶基因的克隆及高氮水平下外源γ-氨基丁酸对其表达和叶片硝酸盐含量的影响
田 真,李敬蕊,王 祥,吴晓蕾,宫彬彬,高洪波*
(河北农业大学园艺学院,河北保定071001)
硝酸还原酶(NR)是硝酸盐代谢的关键酶。该研究在成功克隆生菜NR基因的同时,进行了高氮水平下外源γ-氨基丁酸(GABA)对生菜叶片NR基因表达和NO3--N含量的研究。结果表明:(1)生菜NR基因(GenBank登录号为KP122207)序列长1 791bp,编码585个氨基酸残基,蛋白保守结构域含钼辅蛋白超家族、细胞色素b5超家族和FNR超家族;生菜NR基因与菊苣NR基因亲缘关系最近,序列一致性为93%,与烟草、甜菜、黄瓜、大豆等NR序列的一致性均在80%以上。(2)高氮水平下外源2.5mmol/L GABA处理生菜可诱导NR基因上调表达,并显著提高了生菜叶片NR、亚硝酸还原酶(NiR)、谷氨酸脱羧酶(GAD)活性和NH4+-N含量,降低了NO3--N、NO2--N含量;虽然NO3--N含量与NR、GAD、NiR活性、NO2--N、NH4+-N含量均呈显著相关关系,但与NR活性的相关系数最高且达极显著水平。研究认为,高氮水平下外源GABA可通过诱导NR基因上调表达、增强相关酶活性来影响无机氮代谢,从而降低了生菜叶片硝酸盐含量,其中NR在该过程中发挥着至关重要的作用,为生产中GABA的施用及降低叶菜类蔬菜硝酸盐含量提供了理论依据。
γ-氨基丁酸(GABA);高氮水平;生菜;基因克隆;硝酸盐含量
近年来,设施蔬菜发展迅速,但在蔬菜生产中一部分菜农为追求经济效益常滥施化肥,特别是单一大量施用氮肥,导致蔬菜体内硝酸盐含量超标的现象较严重。许多学者提出了降低蔬菜硝酸盐含量的方法,如合理施用氮肥、改善蔬菜生长环境、选择合适的采收期、采用适宜贮藏加工及食用处理方法等,但是这些方法的实施受外界环境因素的影响较大,从而效果不稳定[1]。硝酸还原酶(ritrate reductase,NR)作为催化硝酸盐同化反应的限速酶,是影响蔬菜硝酸盐累积的主要内源因子,在氮素代谢中占有重要地位[2]。研究证明通过提高NR活性有利于蔬菜硝酸盐的降解[3],但不同蔬菜体内NR活性存在很大差异,通过外源物质调控的方法稳定提高NR活性对降低蔬菜体内硝酸盐积累具有重要作用[4]。
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种四碳非蛋白质氨基酸,广泛存在于动植物体内,有缓解高血压、提高免疫力、改善睡眠等的作用。外源GABA可被植物根系和叶片吸收,作为氨基酸态氮参与植物一系列生理代谢反应,在促进植株生长发育、提高抗逆性等方面具有重要作用[5-6]。近年来,关于GABA对植物硝酸盐含量的影响受到关注,研究证明外源γ-氨基丁酸可调节拟南芥幼苗硝酸盐的吸收和利用[7],可作为甘蓝型油菜硝酸盐吸收上调的长途信号[8],但在高氮水平下GABA降低蔬菜硝酸盐含量的作用和机理研究较少。生菜作为一种重要的叶菜类蔬菜,极易富集硝酸盐,而实际生产中设施土壤氮素水平超标现象日趋严重,为此从克隆生菜NR基因入手,探求高氮水平下外源GABA降低生菜叶片硝酸盐含量的作用机理,旨在寻求降低生菜硝酸盐含量、提高产品品质的有效措施。
1 材料和方法
1.1 材 料
试验生菜品种为‘大速生’,种子由中国农业科学院蔬菜花卉研究所提供。种子经55℃温水浸种后,播于装有石英砂的塑料盆中育苗,温室昼温27~30℃,夜温16~18℃。子叶展开后,用1/2倍的Hoagland营养液浇苗。幼苗长有4片真叶时,选整齐一致的健壮幼苗定植到装有1倍Hoagland营养液[pH(6.3±0.1),EC(2.0~1.2)]的盆中水培,气泵正常通气。待幼苗长出第6片叶子时,将幼苗分成2组并分别进行下列处理。(1)NaNO3处理(CK):在Hoagland营养液(含有14mmol/L NO3-)中添加18mmol/L NaNO3,使得营养液中NO3-浓度达到32mmol/L(此浓度接近设施土壤硝态氮浓度);(2)NaNO3+2.5mmol/L GABA处理(2.5GABA):Hoagland营养液中同时添加18 mmol/L NaNO3和2.5mmol/L GABA。NaNO3和GABA的浓度均为前期试验筛选出的最佳浓度[9]。在处理0、3、6d取生菜叶片,用液氮速冻后存放到-80℃超低温冰箱内,用于硝酸还原酶基因的克隆和表达分析;并在处理0、3、6、9、12d后取生菜叶片,测定硝酸盐代谢中主要产物含量和相关酶活性。试验重复3次。
1.2 方 法
1.2.1 生菜总RNA提取及cDNA合成 分别称取不同处理冷冻的生菜叶片0.1g,液氮研磨。采用塞勒生物EASYEX植物RNA快速提取试剂盒提取总RNA,通过Thermo Scientific NanoDrop 2000/2000C和琼脂糖凝胶电泳检测其浓度和纯度。按照TAKARA PrimerScriptTMRT Master Mix反转录试剂盒合成cDNA第一链。
1.2.2 生菜NR基因的克隆和表达 生菜NR基因序列尚未见报道,本试验以同为菊科的菊苣NR基因组DNA序列(GenBank登录号为X84103.1)为依据,运用Primer Premier 5.0软件设计特异引物NR-s(5′-CAAATACGGGACCAGCATAA-3′)和NR-a(5′-TTGGCAACAACATACCATACCT-3′)。PCR反应体系为:cDNA 1.25μL、dNTP(2.5 mmol·L-1)4.0μL、上下游引物(10μmol·L-1)各0.5μL、Buffer(10×)2.5μL、Taq酶0.25μL和ddH2O 16μL。反应程序为94℃预变性2min;94℃变性30s,53℃退火30s,72℃延伸2min,40个循环;72℃延伸10min;4℃保温。克隆获得的产物切胶回收,与pMD19-T载体连接后转化大肠杆菌DH5α,在含有氨苄青霉素抗性的固体LB培养基上37℃过夜培养,挑取单菌落,在氨苄青霉素抗性的液体LB培养基中37℃摇菌3h,经菌液PCR验证后送生工生物工程(上海)股份有限公司测序。
另外,就不同处理生菜叶片cDNA(通过Thermo Scientific NanoDrop 2000/2000C仪器检测并调节为一致的浓度),分别用上述所设计引物进行PCR扩增,后经2%琼脂糖凝胶电泳检测,以此来分析生菜叶片NR基因的表达量。
1.2.3 生物信息学分析 序列比对采用NCBI Blast;利用ExPASy ProtParam对NR基因编码蛋白理化性质进行预测;采用NCBI CDD数据库(http://www.ebi.ac.uk/Tools/pfa/iprscan/)预测蛋白保守结构域;多序列比对用DNAMAN软件,并用MEGA 4软件构建系统进化树。
1.2.4 硝酸盐代谢过程中主要产物含量和相关酶活性的测定及其相关性分析 硝态氮(NO3--N)、铵态氮(NH4+-N)含量的测定参照吕伟仙[10]的方法;亚硝态氮(NO2--N)含量采用盐酸萘乙二胺比色法测定;硝酸还原酶(ritrate reductase,NR)和亚硝酸还原酶(nitrite reductase,NiR)活性的测定分别参照Foyer等[11]和Takahashi等[12]的方法;谷氨酸脱羧酶(glutamate decarboxylase,GAD)活性采用GABA比色定量法[13]测定。采用Excel软件处理数据和作图,SAS 8.1软件Duncan多重比较法进行方差分析。同时,利用SPSS 17.0软件的Pearson相关系数法对硝酸盐代谢过程中的NO3--N、NO2--N、NH4+-N含量与相关酶NR、NiR、GAD活性进行相关性分析。
2 结果与分析
2.1 生菜NR基因的克隆和表达
PCR扩增产物经2%琼脂糖凝胶电泳检测,在1 000~2 000bp之间出现预期条带(图1),测序结果良好,均为单峰。经NCBI Blast比对,与菊苣(Cichorium intybus,GenBank登录号为P43101.1)NR基因序列一致性为93%,初步证明获得的序列为生菜NR基因(GenBank登录号为KP122207),可用于后续序列分析。
将不同处理生菜叶片的cDNA进行PCR扩增,经2%琼脂糖凝胶电泳检测,电泳条带的亮度表示基因的表达量。结果显示,在处理3、6d时,2.5 mmol/L GABA处理的生菜叶片NR基因的表达量均高于对照处理(图2),表明2.5mmol/L GABA处理提高了生菜叶片NR基因的表达量。
2.2 生物信息学分析
测序结果分析表明,生菜叶片NR基因序列长1 791bp(图1),该基因编码的氨基酸残基长度为585。ProtParam预测结果显示该序列编码的蛋白由20种氨基酸组成,分子量为66kD,理论等电点为6.15,酸性氨基酸残基总数(Asp+Glu)为72,碱性氨基酸残基总数(Arg+Lys)为63。
图1 生菜叶片NR基因的扩增结果M.DL2000;1.生菜叶片NR基因扩增结果Fig.1 NRgene amplification products in lettuce leaves M.DL2000;1.NR gene amplification products in lettuce leaves
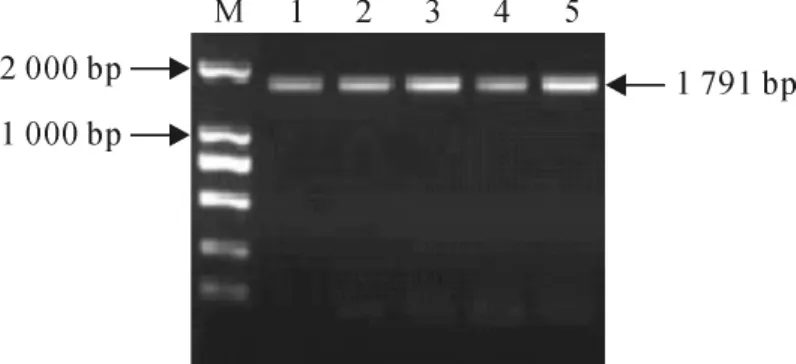
图2 GABA处理后高氮水平下生菜叶片N R基因的表达结果M.DL200;1~5分别表示0 d的C K处理、3 d的C K和2.5 G A B A处理、6 d的C K和2.5 G A B A处理的生菜叶片N R基因表达量Fig.2 Expression result of NRgene after the treatmen to fGAB Aunder highnit ro gen leve lin lettuce leaves M.DL 2000;1-5stand for thee xpress ion ofNR genein lettuce leaves at0d(CK),3d(CKand 2.5 GABA),6d(CKand 2.5 GABA)
同时,NCBI CDD数据库对生菜NR基因结构域的预测结果显示(图3),生菜NR基因含有钼辅蛋白超家族(1~213),其在硝酸盐还原为亚硝酸盐的过程中发挥着重要作用。另外还包含细胞色素b5超家族(271~351)和FNR超家族(396~585),且含有FAD和NADH结构域的FNR超家族,是众多还原酶类所共有的保守结构。
另外,氨基酸序列比对发现,生菜NR基因编码的氨基酸序列与菊苣(Cichorium intybus)、可可(Theobroma cacao)、烟草(Nicotiana tabacum)、蓖麻(Ricinus communis)、甜菜(Beta vulgaris)、黄瓜(Cucumis sativus)、苜蓿(Medicago truncatula)、拟南芥(Arabidopsis thaliana)、大豆(Glycine max)9个物种中的同源基因编码的氨基酸序列具有很高的相似性,均含有3个保守结构域(图4,A~C为3个保守结构域)。系统进化树进一步分析表明,生菜NR基因编码的氨基酸序列与菊苣亲缘关系最近,序列一致性高达93%;而且其与烟草、可可、蓖麻、甜菜、黄瓜、苜蓿、拟南芥、大豆的序列一致性也在80%以上(图5)。
2.3 外源GABA对生菜叶片硝酸盐代谢过程中主要产物含量和相关酶活性的影响
图6,A显示,随处理时间的延长,2.5mmol/L GABA处理的生菜叶片的NR活性呈先升高后降低的变化趋势,而对照叶片的NR活性基本保持稳定,且在处理3、6、9d时2.5mmol/L GABA处理分别比同期对照显著提高21.8%、22.2%、20.1%(P<0.05);同期两种处理的生菜叶片NO3--N含量呈相似的变化趋势,但是2.5mmol/L GABA处理的生菜叶片NO3--N含量在整个培养过程中均显著低于对照处理,如在处理9d时比对照降低26.1%(图6,B)。
同时,2.5mmol/L GABA处理和对照的生菜叶片NiR活性也呈先升高后降低的趋势,且2.5 mmol/L GABA处理在整个培养过程中均显著高于同期对照处理,并在处理6d时达最大,此时比对照显著提高21.1%(图6,C);2.5mmol/L GABA处理下的生菜叶片NO2--N含量在处理时间为3、12 d时却显著低于对照处理(图6,D)。
另外,两种处理的生菜叶片NH4+-N含量和GAD活性均呈先升高后降低的趋势,均在处理6d时达最大值,并在整个处理过程中2.5mmol/L GABA处理均高于对照处理。且除处理12d时的GAD活性外,两处理间的差异均达显著水平。其中,2.5mmol/L GABA处理的生菜叶片NH4+-N含量在处理6d时约为对照的1.5倍,而其相应的GAD活性约为对照的1.2倍(图6,E、F)。
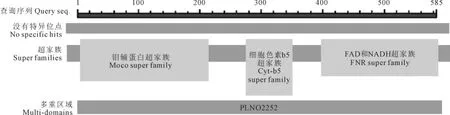
图3 NR蛋白保守结构域Fig.3 NR conservative protein domains

图5 不同植物NR氨基酸系统进化树分析分支上数值为1 000次重复Bootstrap值Fig.5 Phylogenetic tree of NR amino acid sequences from different plants The number on the branches mean Bootstrap value for 1 000replicates

图4 不同植物NR基因编码氨基酸序列比对图A、B、C表示NR基因蛋白保守结构域Fig.4 Alignment of amino acid sequences of encode by NRgene from different plant species NRgene conserved protein domains(A-C)are shown by line
此外,硝酸盐代谢过程中主要产物含量及相关酶活性相关分析结果(表1)显示,高氮水平下生菜叶片NR活性、NiR活性、GAD活性、NO3--N含量、NO2--N含量、NH4+-N含量两两之间均呈显著相关关系。其中,NO3--N含量与NR活性、GAD活性呈极显著负相关关系,与NiR活性、NH4+-N含量呈显著负相关关系,而与NO2--N含量的正相关性也达极显著水平。表明生菜叶片中NR、GAD、NiR活性与其NO3--N含量关系密切。
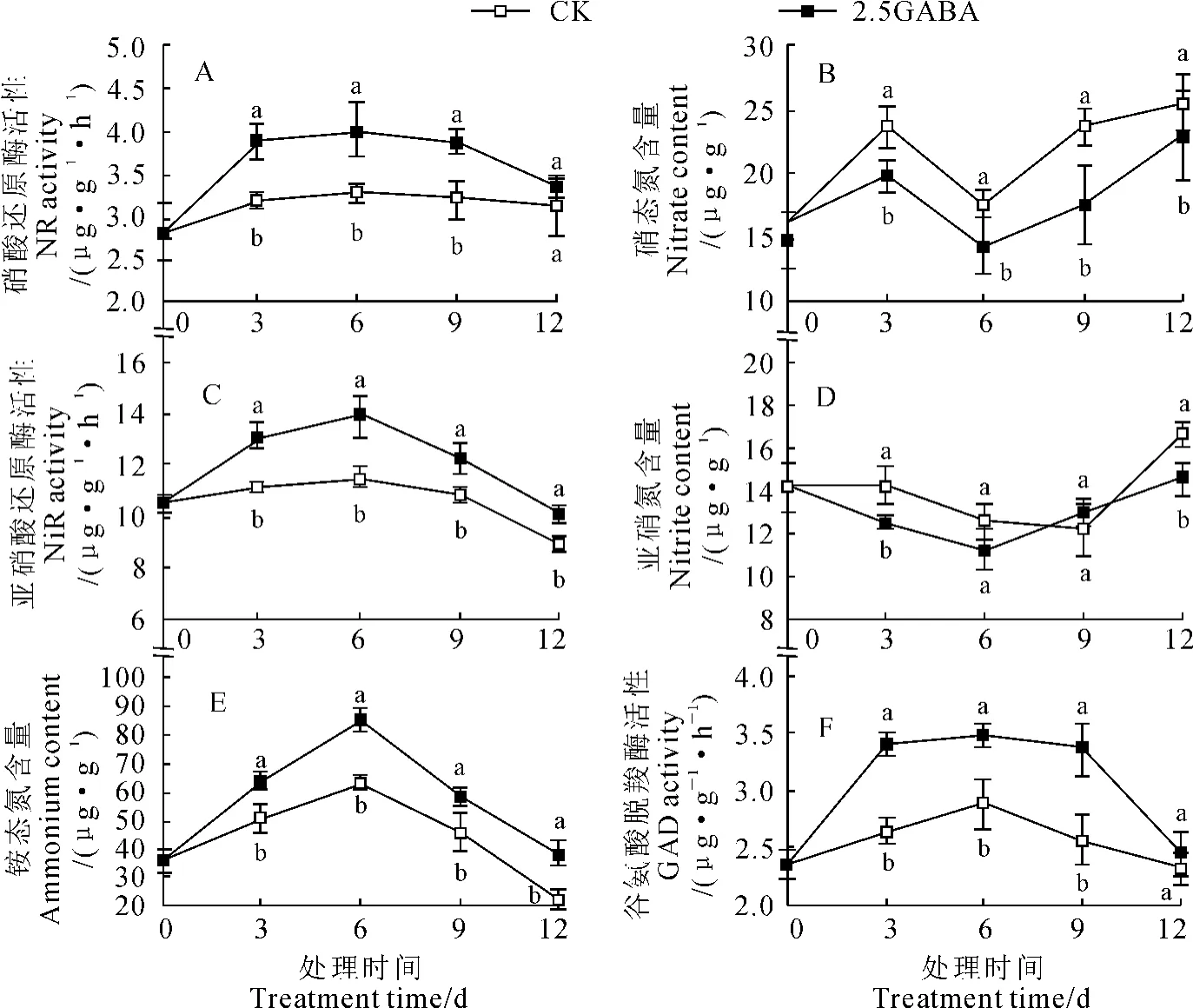
图6 外源GABA对高氮水平下生菜叶片NO3--N、NO2--N、NH4+-N含量及NR、NiR、GAD活性的影响不同小写字母表示同一时间对照与处理间差异达0.05水平Fig.6 The effects of exogenous GABA on contents of nitrate,nitrite,ammonium as well as activities of nitrate reductase,nitrite reductase,glutamate decarboxylase in leaves of lettuce under high nitrogen level in nutrient solution The letters mean significant difference at 0.05level between CK and treatment with the same time
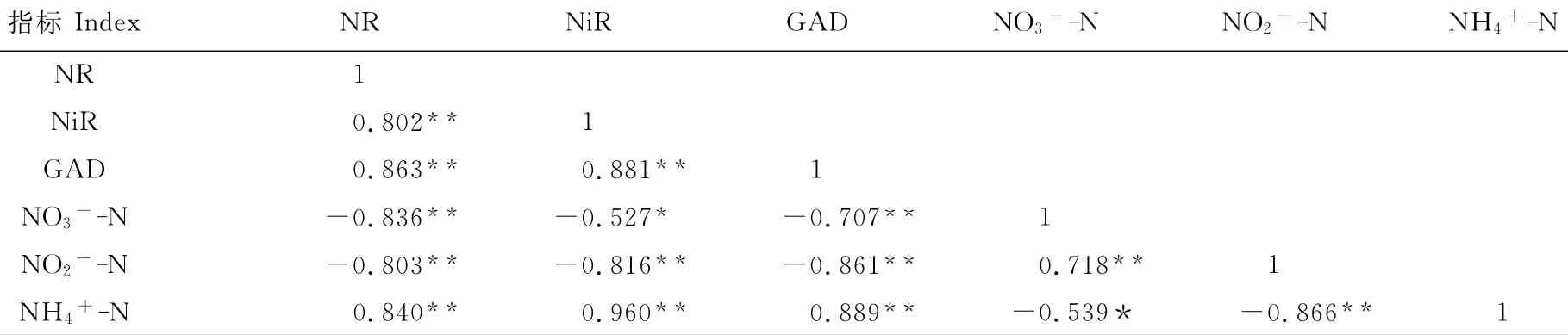
表1 硝酸盐代谢过程中主要产物含量和酶活性的相关系数Table 1 The correlation coefficient of the metabolite contents and enzyme activities in the process of nitrate metabolism
3 讨 论
硝酸盐污染是影响设施蔬菜品质的重要因素之一,对人们的健康构成了潜在的威胁。NR在植物氮素代谢中起着关键作用,研究表明NR重组基因nia的表达降低了生菜中硝酸盐的含量[14],将烟草NR基因与CaMV35S启动子的融合基因导入到马铃薯中并在其中表达,马铃薯块茎中的硝酸盐含量显著下降[15]。利用基因工程的手段提高叶菜类蔬菜NR基因的含量,以此来降低叶菜类蔬菜的硝酸盐含量越来越受到人们的关注,研究NR基因的克隆和表达具有重要的意义。目前已有针对不结球白菜、黄瓜、菜豆等蔬菜的NR基因的克隆和表达展开研究[16-18],然而高氮水平下外源GABA对生菜NR基因表达情况的研究较少。本试验成功克隆到一段长为1 791bp的生菜NR基因序列,其编码蛋白由585个氨基酸残基组成;蛋白保守结构域包括3个NR家族基因的保守结构:钼辅蛋白超家族、细胞色素b5超家族及FNR超家族[16],与不同物种NR基因氨基酸序列比对具有很高的相似性,表明NR基因在进化上具有很强的保守性。同时,高氮水平下外源添加GABA使生菜叶片NR基因的表达量升高,说明外源GABA有诱导NR基因表达的作用,对降低生菜硝酸盐含量有重要作用。
氨基酸作为硝态氮的还原产物,对氮代谢具有反馈调节作用,当植株生长环境中有氨基酸态氮存在时,就不会吸收硝态氮,以此来降低硝态氮吸收、还原和氨基酸合成过程中能量的消耗,达到降低硝酸盐含量的目的[19]。研究表明,氨基酸态氮源和硝态氮同时存在的情况下,不结球白菜和生菜先吸收氨基酸态氮,从而降低其体内硝酸盐含量[20,4]。GABA是一种潜在的植物体中调节离子转运的调节因子[21]或硝酸盐吸收上调的长途信号[8],并通过调节与氮、碳代谢相关的酶活性,如硝酸还原酶、谷氨酸合成酶等影响拟南芥幼苗硝酸盐的吸收和利用,当硝酸盐的浓度升高时会抑制硝酸盐的吸收[7];外源添加GABA可通过促进NR活性的提高,达到降低生菜硝酸盐含量的目的[3]。本试验研究结果表明,高氮水平下外源添加2.5mmol/L GABA显著提高了生菜叶片NR、NiR、GAD活性和NH4+-N含量,同时降低了NO3--N、NO2--N含量。这可能是因为,外源GABA作为氨基酸态氮源可以被植物根系直接吸收,当环境中同时存在硝态氮和氨基酸态氮时,GABA被优先吸收,通过诱导NR、NiR、GAD活性的提高,从而达到降低叶片硝酸盐含量的目的。
环境因子、不合理的施肥方式、植物种类等都是影响植物体内硝酸盐积累的因素[22]。植物体对硝酸盐的同化反应需要经过两个步骤:首先,NO3--N在NR的作用下还原成NO2--N;NO2--N由NiR还原为NH4+-N后进一步合成氨基酸和蛋白质[16]。研究表明,NR的活性代表氮代谢的强弱,NR活性对整个氮素代谢的强弱起着关键的调控作用[23]。由本试验结果可知,生菜叶片内NO3--N含量与NR、NiR、GAD活性,以及与NO2--N、NH4+-N含量均呈显著相关关系,表明NR、NiR、GAD活性对NO3--N含量的积累有重要作用。
综上所述,本试验克隆了生菜NR基因序列,该基因在进化上具有很强的保守性,而且高氮水平下外源GABA可以通过影响无机氮代谢来降低生菜叶片NO3--N含量,在此过程中NR发挥重要作用。此结果为生产中GABA的合理施用及降低叶菜类蔬菜硝酸盐含量提供了理论依据,但GABA对硝酸盐代谢中其他关键酶基因的克隆和表达的影响尚需进一步深入研究。
[1] SUN F F(孙菲菲),HOU X L(侯喜林),LI Y(李 英),et al.Cloning and sequence analysis of nitrate reductase gene cDNA fragments from non-heading Chinese cabbage[J].Journal of Nanjing Agricultural University(南京农业大学学报),2006,29(2):15-19(in Chinese).
[2] LIU L(刘 丽),GAN ZH J(甘志军),WANG X Z(王宪泽).Advances of studies on the regulation of nitrate metabolism of plants at nitrate reductase level[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2004,24(7):1 355-1 361(in Chinese).
[3] GONG R J(弓瑞娟),LU F G(卢凤刚),XIA Q P(夏庆平),et al.Effects of exogenousγ-aminobutyric acid on nitrate content and quality in lettuce[J].Journal of Agricultural University of Hebei(河北农业大学学报),2012,35(3):31-35(in Chinese).
[4] CHEN G L(陈贵林),GAO X D(高秀瑞).Effect of partial replacement of nitrate by amino acid and Urea on nitrate content of nonheading Chinese cabbage and lettuce in hydroponics[J].Scientia Agricultura Sinica(中国农业科学),2002,35(2):187-191(in Chinese).
[5] XIA Q P(夏庆平),GAO H B(高洪波),LI J R(李敬蕊).Effects ofγ-aminobutyric acid on the photosynthesis and chlorophyll fluorescence parameters of muskmelon seedlings under hypoxia stress[J].Chinese Journal of Applied Ecology(应用生态学报),2011,22(4):999-1 006(in Chinese).
[6] LUO H Y(罗黄颖),GAO H B(高洪波),XIA Q P(夏庆平),et al.Effects of exogenous GABA on reactive oxygen species metabolism and chlorophyll fluorescence parameters in tomato under NaCl stress[J].Scientia Agricultura Sinica(中国农业科学),2011,44(4):753-761(in Chinese).
[7] BARBOSA J M,SINGH N K,CHERRY J H,et al.Nitrate uptake and utilization is modulated by exogenous gamma-aminobutyric acid in Arabidopsis thaliana seedlings[J].Plant Physiology and Biochemistry,2010,48(6):443-450.
[8] BEUVE N,RISPAIL N,LAINE P,et al.Putative role ofγ-aminobutyric acid(GABA)as a long-distance signal in up-regulation of nitrate uptake in Brassica napus L.[J].Plant,Cell and Environment,2004,27(8):1 035-1 046.
[9] 弓瑞娟.γ-氨基丁酸对生菜氮代谢及营养品质的影响[D].河北保定:河北农业大学,2012.
[10] LÜW X(吕伟仙),GE Y(葛 滢),WU J ZH(吴建之),et al.Study on the method for the determination of nitric nitrogen,ammoniacal nitrogen and total nitrogen in plant[J].Spectroscopy and Spectral Analysis(光谱学与光谱分析),2004,24(2):204-206(in Chinese).
[11] FOYER C H,VALADIER M H,MIGGE A,et al.Drought-induced effects on nitrate reductase activity and mRNA and on the coordination of nitrogen and carbon metabolism in maize leaves[J].Plant Physiology,1998,117(1):283-292.
[12] TAKAHASHI M,SASAKI Y,IDA S,et al.Nitrite reductase gene enrichment improves assimilation of NO2in Arabidopsis[J].Plant Physiology,2001,126(2):731-741.
[13] YANG SH Y(杨胜远),LU ZH X(陆兆新),LÜF X(吕凤霞),et al.Colorimetric determination of GABA in GAD activity assay[J].Food Science(食品科学),2006,27(7):205-209(in Chinese).
[14] CURTIS I S,POWER J B,DE LAAT A M M,et al.Expression of a chimeric nitrate reductase gene in transgenic lettuce reduces nitrate in leaves[J].Plant Cell Reports,1999,18(11):889-896.
[15] DJENNANE S,CHAUVIN J E,QUILLERE I,et al.Introduction and expression of a deregulated tobacco nitrate reductase gene in potato lead to highly reduced nitrate levels in transgenic tubers[J].Transgenic Research,2002,11(2):175-184.
[16] SUN F F(孙菲菲),HOU X L(侯喜林),LI Y(李 英),et al.Molecular cloning of a non-heading Chinese cabbage nitrate reductase gene(BcNR)and transformation into Arabidopsis thaliana[J].Scientia Agricultura Sinica(中国农业科学),2009,42(2):577-587(in Chinese).
[17] MAO W H(毛伟华),GONG Y M(龚亚明),XIA X J(夏晓剑),et al.Clonging of a cDNA fragment of nitrate reductase(NR)gene in cucumber and its expression analysis under nitrogen deficiency stress[J].Acta Agriculturae Zhejiangensis(浙江农业学报),2007,19(3):160-163(in Chinese).
[18] HOFF T,STUMMANN B M,HENNINGSEN K W.Cloning and expression of a gene encoding a root specific nitrate reductase in bean(Phaseolus vulgaris)[J].Physiologia Plantarum,1991,82(2):197-204.
[19] PADGETT P E,LEONARD R T.Regulation of nitrate uptake by amino acids in maize cell suspension culture and intact roots[J].Plant and Soil,1993,155-156(1):159-161.
[20] GAO X D(高秀瑞),CHEN G L(陈贵林).Effect of replacement of nitrate by Gly on growth and accumulation of nitrate of nonheading Chinese cabbage and lettuce[J].Journal of Agricultural University of Hebei(河北农业大学学报),2003,26(1):40-43(in Chinese).
[21] KINNERSLEY A M,LIN F.Receptor modifiers indicate that 4-aminobutyric acid(GABA)is a potential modulator of ion transport in plants[J].Plant Growth Regulation,2000,32(1):65-76.
[22] YANG B(杨 波),ZHENG Q S(郑青松).Accumulation and control of nitrate in vegetables[J].Hubei Agricultural Sciences(湖北农业科学),2009,48(8):2 020-2 025(in Chinese).
[23] WANG L Q(王利群),WANG Y(王 勇),DONG Y(董 英),et al.Induced activity of nitrate reductase by nitrate and cloning of nitrate reductase gene[J].Chinese Journal of Biotechnology(生物工程学报),2003,19(5):632-635(in Chinese).
(编辑:裴阿卫)
Cloning of Nitrate Reductase Gene of Lettuce and Effect of Exogenous γ-Aminobutyric Acid on Gene Expression and Nitrate Content in Leaves under High Nitrogen Level
TIAN Zhen,LI Jingrui,WANG Xiang,WU Xiaolei,GONG Binbin,GAO Hongbo*
(College of Horticulture,Agricultural University of Hebei,Baoding,Hebei 071001,China)
Nitrate reductase(NR)is the key enzyme of nitrate metabolism.This paper successfully cloned the gene of NRin lettuce and investigated the effect of exogenousγ-aminobutyric acid(GABA)on the expression of NRgene and NO3--N content under high nitrogen level in leaves of lettuce cultured with hydroponics culture at the same time.The result showed that:(1)the NRgene(the accession NO.of Genbank is KP122207)sequence of lettuce was 1 791bp that encoding 585amino acid residues,and contained the Moco superfamily,Cyt-b5superfamily and FNR superfamily protein domains.The NRgene sequence of lettuce had close genetic relationship with Cichorium intybus(93%consistency)and had relative close genetic relationship with tobacco,sugar beets,cucumber and soybeans(more than 80%consistency).(2)The exogenous 2.5mmol/L GABA induced a marked increase in NRgene expression.Meanwhile,significantly in-creased the activities of NR,nitrite reductase(NiR),glutamate decarboxylase(GAD)and the content of NH4+-N in lettuce leaves under high nitrogen level of nutrient solution,but reduced the contents of NO3--N and NO2--N.The content of NO3--N had significant correlation with the activities of NR,NiR,GAD and the contents of NO2--N,NH4+-N,but the correlation coefficient was the highest between NO3--N and NR which reaching extremely significant negative correlation.The study suggested that,exogenous GABA could affect inorganic nitrogen metabolism and reduce the nitrate content in lettuce leaves by inducing NR gene up-regulated expression and enhancing enzyme activities under high nitrogen level.Especially the NR played a key role in the process,which provided a theoretical basis for the application of GABA and reducing the nitrate content in leafy vegetables.
γ-aminobutyric acid(GABA);high nitrogen level;lettuce;gene clone;nitrate content
Q789;Q945.79
A
10.7606/j.issn.1000-4025.2015.06.1098
1000-4025(2015)06-1098-08
2014-12-26;修改稿收到日期:2015-05-10
河北省教育厅重点项目(ZH2012048);河北省自然科学基金(C2014204074)
田 真(1988-),女,在读硕士研究生,主要从事设施园艺与无土栽培的研究。E-mail:pingdixienvhai@163.com
*通信作者:高洪波,教授,硕士生导师,主要从事设施蔬菜和无土栽培的教学和研究工作。E-mail:hongbogao@hebau.edu.cn

