结核分枝杆菌北京基因型亚型的流行及与耐药性的关系研究
谢彤 巨韩芳 王春花 王志锐 穆成 赵慧 王艳楠 孙蕊 王撷秀
·论著·
结核分枝杆菌北京基因型亚型的流行及与耐药性的关系研究
谢彤 巨韩芳 王春花 王志锐 穆成 赵慧 王艳楠 孙蕊 王撷秀
目的 通过分析Mtb北京基因型基因组NTF(noise transfer function)区插入序列IS6110,揭示北京基因型在进化过程中所形成的古代株和现代株2个亚型在天津市的流行情况及其与耐药表型的关系。方法 收集2012—2014年天津市临床分离的816株Mtb菌株。采用PCR试验分析菌株基因组中差异区域(Region of difference, RD)RD207和RD105片段是否有缺失,以鉴定是否为北京基因型。通过检测北京基因型菌株基因组NTF区中IS6110插入序列的数目,了解北京基因型菌株中古代株和现代株所占的比例,并进一步分析这两种亚型与菌株耐药表型间的关系。计数资料采用卡方检验进行分析,以P<0.05为差异有统计学意义。 结果 在所分析的816株临床分离的Mtb菌株中,764 (93.63%)株为北京基因型菌株。764株北京基因型菌株中, 110株(14.40%)为古代株, 654株(85.60%)为现代株。现代株中仅有1株为北京基因型W株。在古代株和现代株中,耐异烟肼菌株分别占26.36%(29/110) 和 10.70%(70/654)(χ2=20.47,P<0.01);耐利福平菌株分别占14.55%(16/110) 和 6.57%(43/654)(χ2=8.40,P<0.01);耐乙胺丁醇菌株分别占8.18%(9/110) 和3.21%(21/654),(χ2=6.17,P<0.05)。此外,MDR-TB患者中古代株和现代株分别占13.64%(15/110)和4.74%(31/654)(χ2=13.17,P<0.01)。结论 Mtb北京基因型中的现代株是天津市的主要流行株,但古代株与耐药结核病的关系更为密切,提示在天津市,对抗结核药物产生耐药并不是导致北京基因型广泛流行的主要因素。
结核分枝杆菌; 基因型; 抗药性,细菌; 表型
目前,结核病仍是全球导致死亡人数最多的传染病。我国2013年登记的新发肺结核患者近90万例,其中大约5.4万例为MDR-TB患者,MDR-TB患者例数分别占初治和复治患者的5.7%和26%,我国仍是仅次于印度的结核病高负担国家[1]。分子流行病学研究证实,受环境和宿主双重因素的影响,全球不同区域流行的主要结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)菌株的基因型并不相同。在所发现的各种基因型中,北京基因型在全球传播的速度最快,分布也最为广泛。在我国不同地区北京基因型菌株占临床分离菌株的50%至90%[2]。
北京基因型Mtb菌株最显著的特点为基因组中差异区域(Region of difference, RD)RD207片段的缺失,这一缺失使得该基因型在采用间隔区寡聚核苷酸分型技术 (Spoligotyping)进行分型时1~34的间隔序列缺失[3]。RD105片段缺失是北京基因型的另一个显著特点,Chen等[4]利用此特点建立了快速鉴定北京基因型的PCR方法。北京基因型菌株在进化过程中还会出现RD181、RD142和RD150等片段的缺失[5]。IS6110插入序列的转位(transposition)是北京基因型菌株的另一种进化机制,根据基因组NTF区中IS6110的数目,北京家族又被分为3个分支[6]。菌株NTF区中没有IS6110,则为古代株,古代株被认为是北京基因型进化早期的菌株类型;菌株NTF区若有1个IS6110,则为现代株;若NTF区包含有2个IS6110则被称为W型菌株,W型菌株被认为是现代北京基因型进化过程中出现的一个分支,曾在20世纪90年代中期在美国纽约等地区引发小规模的MDR-TB流行[7]。本研究旨在初步揭示北京基因型古代株和现代株Mtb在人群中的流行情况,以及这2个亚型与耐药表型的关系。
材料和方法
一、菌株来源与试剂
1. 菌株:本研究选取天津市结核病参比实验室收集的2012年1月至2014年2月从天津市结核病患者痰标本中分离培养的Mtb 816株。其中536株分离自市区结核病患者;280株分离自其他各区(县)结核病患者,包括滨海新区42株,东丽区2株,西青区28株,津南区31株,北辰区54株,武清区27株,宝坻区49株,宁河县25株,蓟县22株。所有菌株经对硝基苯甲酸试验和噻吩-2-羧酸肼生长试验以排除非结核分枝杆菌和牛结核分枝杆菌。H37Rv标准株购自中国药品生物制品检定所。
2.培养基与试剂:Mtb分离培养采用改良罗氏培养基(天津金章科技发展有限公司);Mtb鉴定与药敏试验培养基(珠海贝索生物技术有限公司);PCR扩增试剂为2×HotMaster Taq MasterMix (天根生化科技有限公司);PCR扩增引物合成(上海英骏生物有限公司);溶菌酶、蛋白酶K、十六烷基三甲基溴化铵(CTAB)、十二烷基磺酸钠(SDS)等Mtb基因组提取试剂(美国Sigma公司)。
二、试验方法
1. Mtb基因组的提取:从改良罗氏培养基斜面上挑取Mtb菌落转移至装有500 μl磷酸盐缓冲液(PBS)的1.5 ml Eppendorf管中;细菌经80 ℃,60 min灭活后,加入50 μl(10 mg/ml)的溶菌酶,37 ℃过夜孵育;分别加入70 μl 10%SDS和5 μl 10 mg/ml 蛋白酶K,70 ℃孵育10 min,然后分别加入100 μl 5 mol NaCl、100 μl CTAB与NaCl混合液和600 μl氯仿与异戊醇(24∶1)混合液,充分混匀Eppendorf管中的溶液,10 000×g离心10 min;转移含有基因组的上清至另一个装有500 μl预冷的异丙醇溶液的Eppendorf管。混匀后将Eppendorf管置于-20 ℃冰箱中至少30 min; 离心沉淀DNA并经预冷的1 ml 70%乙醇洗涤后,用200 μl TE [Tris(三羟甲基氨基甲烷)与乙二胺四乙酸(EDTA)配制而成]缓冲液溶解基因组DNA。提取的基因组DNA在测定基因组含量后,置于-70 ℃环境保存。
2.药敏试验:采用《分枝杆菌分离培养标准化操作程序及质量保证手册》推荐的比例法药敏试验[8]。检测的药物包括异烟肼、利福平、链霉素、乙胺丁醇、氧氟沙星和卡那霉素,其在改良罗氏培养基的终浓度分别为0.2 μg/ml、40 μg/ml、4 μg/ml、2 μg/ml、4 μgml 和30 μg/ml。若耐药百分比大于1%,判定为受试菌株耐药。
3.北京基因型的鉴定:根据北京基因型Mtb的基因组特点,通过PCR试验分析菌株基因组在Rv2616至Rv2819(RD207)和Rv0071至Rv0074(RD105)区域的缺失情况。RD207缺失分析采用多重PCR方法[9],RD105缺失分析采用Hanekom等[10]报道的方法。每批次PCR试验均以H37Rv标准菌株(非北京基因型)为对照,并设阴性对照和试剂空白对照。
4.北京基因型NTF区IS6110分析:NTF区IS6110分析采用Wada等[11]报道的方法。首先使用上游引物MDR-6: 5′-CCAGATATCGGGTGTGTCGAC-3′和下游引物MDR-6r:5′-TGCCGTTGTCGAAATCTAAACCC-3′分析NTF区是否存在IS6110,如果含有IS6110,则为现代株,其扩增产物为1.5 kb;反之则为古代株,其扩增产物为302 bp。然后采用上游引物MDR-7:5′-CGCGAGATCTCATCGACAACC-3′和下游引物MDR-7r:5′-GTACGAAACAGCACGGTGCGG-3′分析现代株NTF区IS6110的数量,根据PCR产物的长度判断IS6110的数量。W型北京株含有2个IS6110,PCR扩增产物为1.5 kb。而普通的北京型现代株中仅含有1个IS6110,PCR扩增产物为280 bp。25 μl PCR反应体系中含有12.5 μl的Master Mix,0.4 μmol/L的引物,以及10~50 ng的基因组DNA。PCR反应条件为95 ℃变性 5 min;94 ℃反应 30 s,63 ℃ 反应30 s,72 ℃反应 1 min,35个循环;72 ℃反应 10 min。
三、 统计学分析
采用Excel 2007进行数据录入,运用SPSS 11.5软件进行数据统计分析。构成比及率的比较采用χ2检验,P<0.05为差异有统计学意义。
结 果
一、北京基因型及其亚型的流行
对Mtb的进化研究发现,菌株基因组在RD207缺失后进化为北京基因型,进而该基因型又出现RD105的缺失。本研究中对816株临床分离的Mtb菌株经PCR扩增RD207和RD105所在的区域,证实有764株Mtb为北京基因型Mtb,占临床分离菌株的93.63%。在764株北京基因型Mtb中现代株为654株(85.60%),古代株为110株(14.40%)。对现代株NTF区IS6110的数量进一步分析,证实654株现代株中仅有1株Mtb在NTF区中含有2个IS6110,即W型菌株;其余菌株在NTF区只含有1个IS6110(图1)。
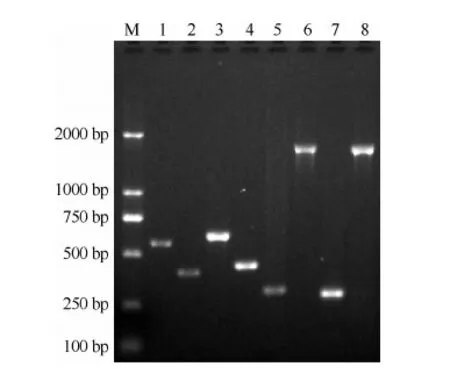
M:DL2000分子量标准;1:H37Rv(RD207无缺失,为非北京基因型);2:临床分离菌株(RD207缺失,为北京基因型);3:H37Rv(RD105无缺失,为非北京基因型);4:临床分离菌株(RD105缺失,为北京基因型);5:北京基因型菌株NTF区无IS6110(古代株);6:北京基因型菌株NTF区含有IS6110(现代株);7:北京基因型现代株NTF区仅含1个IS6110;8:北京基因型现代株NTF区含有2个IS6110(W型菌株)图1 菌株RD207、RD105和NTF区IS6110数目分析的PCR扩增产物电泳结果
二、药敏试验
52株非北京基因型菌株中,有9株耐至少一种抗结核药物,其中2株单耐异烟肼,3株单耐链霉素,3株单耐氧氟沙星,另有1株为MDR菌株同时对链霉素、异烟肼和利福平耐药。在764株北京基因型菌株中全敏感菌株为590株,至少耐一种药的菌株为174株,耐药菌株中MDR 46株,耐异烟肼菌株99株(包括MDR),耐利福平菌株59株(包括MDR),耐链霉素菌株124株,耐乙胺丁醇菌株30株,耐氧氟沙星菌株42株,耐卡那霉素菌株7株。研究中所发现的1株W型菌株为全敏感菌株。统计分析未发现北京基因型菌株与耐药相关(表1)。

表1 天津市不同耐药表型在北京与非北京基因型Mtb中的分布与比较
注 括号外数值为“株数”;括号内数值为“耐药率(%)”
三、古代和现代菌株与耐药的关系
古代菌株中耐药者占30.91%(34/110),现代菌株中耐药者占21.41%(140/654),两者比较,χ2=4.83,P<0.05;古代菌株中耐利福平者占14.55%,显著高于现代菌株的6.57%(χ2=8.40,P<0.01),26.36%的古代株异烟肼耐药,显著高于现代株中10.70%的异烟肼耐药比例(χ2=20.47,P<0.01)。此外,耐乙胺丁醇的菌株在古代菌株中占8.18%,高于在现代菌株的3.21%(χ2=6.17,P<0.05)。古代与现代菌株中耐链霉素、氧氟沙星和卡那霉素的比例差异无统计学意义。在MDR菌株中,古代菌株占13.64%(15/110)显著高于现代菌株的4.74%(χ2=13.17,P<0.01)(表2)。

表2 天津市不同耐药表型在北京基因型古代与现代Mtb菌株中的分布与比较
注 括号外数值为“株数”;括号内数值为“耐药率(%)”
讨 论
全国范围内的研究表明,北京基因型Mtb占全部临床分离菌株的62.2%,且北方高于南方[12]。在本研究中对菌株基因组中RD207和RD105片段缺失分析证实天津市93.63%的菌株为北京基因型,与之前关于北京基因型在这一地区的研究结果相符,说明北京基因型Mtb在天津市广泛传播,是绝对的优势菌株[9,13]。这一比例与我国黑龙江省报道的北京基因型菌株占临床分离菌株的89.5%相近[14]。进一步分析北京基因型菌株基因组NTF区中IS6110,85.60%(654/764)的菌株为现代菌株,但我国宁夏,现代菌株的比例仅为54.4%[15]。在日本,仅21.4%为北京基因型现代菌株[11]。由此可见,北京基因型进化过程中所形成的不同亚型在不同地区的流行程度并不相同,本研究提示在北京基因型高流行地区,现代菌株可能更容易在人群中传播。此外,在NTF区中含有2个IS6110的W型菌株被认为是现代菌株中最新进化的一个分支,但本研究仅发现1株,说明W型菌株在天津市并不是主要的流行菌株。
分子流行病学研究提示,一些地区北京基因型菌株与耐药结核病的传播相关,某些耐药基因突变位点(如与异烟肼耐药相关的KatG基因 315位点)在北京基因型菌株中Ser→Thr的突变比例高于非北京基因型菌株[16]。在我国北京基因型菌株的大规模流行与耐药结核病传播之间的关系还需要进一步研究。Pang等[12]的研究发现,流行的北京基因型Mtb可能与利福平、氧氟沙星耐药菌株的传播有关,还可能与MDR-TB的传播相关。但另一项对我国6个省收集的菌株开展的分子流行病学研究则未发现,北京基因型菌株中耐药菌株的比例显著高于非北京基因型菌株[17],本研究中未发现耐药菌株在北京与非北京基因型Mtb菌株中的比例差异有统计学意义。
目前,全球多个地区的流行病学研究提示,较之其他基因型,北京基因型可能更容易对抗结核治疗药物产生耐药,而耐药则被认为可能是促进北京基因型广泛传播的主要因素之一[18]。但在本研究中,虽然古代菌株仅占北京基因型菌株的14.40%,但其中耐异烟肼者占26.36%,耐利福平者占14.55%,MDR菌株占13.64%,均显著高于现代株。这一研究结果提示,北京基因型在进化过程所产生的不同亚型中,古代株与耐药结核病的关系更为密切,但导致古代耐药菌株流行的机制还需要通过对临床分离菌株开展大规模的分子流行病学研究才能进一步阐明。在人群中传播更占优势的现代Mtb菌株其耐异烟肼、利福平和MDR的比例却低于古代菌株,提示在天津这样的北京基因型Mtb高流行地区,古代耐药北京菌株产生的主要原因可能由于其本身更容易产生耐药,而不是由于耐药菌株在人群中的传播所导致。菌株产生耐药性可能并不是引起北京基因型流行的主要因素,其广泛传播的原因可能是由于其他的机制所导致。最新研究提示,现代北京基因型菌株的广泛流行可能与以下两个因素有关:一方面是BCG疫苗的接种,统计分析表明接种BCG疫苗的人群更容易感染现代菌株,提示现代菌株能够更好地克服宿主接种BCG后所产生的免疫[19];另一方面,现代菌株具有更强的抑制宿主的免疫应答的能力。最近研究发现,古代菌株诱导巨噬细胞产生白细胞介素(IL)-1β、IL-6、IL-8等细胞因子的水平明显高于现代株[20]。
综上所述,作为北京基因型Mtb的高流行地区,天津以现代株的流行为主,但现代株的一个重要分支——W型菌株并不是主要的流行株。北京基因型Mtb古代菌株与耐利福平、异烟肼等多种抗结核药物具有显著的相关性,而且在耐多药菌株中古代菌株的比例显著高于现代菌株。因此,今后有必要进一步研究古代菌株易产生耐药的机制,从而更好地遏制耐药结核病的流行。同时本研究结果提示,在天津市耐药并不是引起北京基因型Mtb在人群中广泛传播的主要原因。
[1] Would Health Organization. Global tuberculosis report 2014. Geneva: World Health Organization, 2014.
[2] Wan K,Liu J,Hauck Y, et al. Investigation onMycobacteriumtuberculosisdiversity in China and the origin of the Beijing clade. Plos One,2011,6(12):e29190.
[3] Bifani PJ,Mathema B,Kurepina NE, et al. Global dissemination of theMycobacteriumtuberculosisW-Beijing family strains(Review). Trends Microbiol,2002, 10(1):45-52.
[4] Chen J,Tsolaki AG,Shen X, et al. Deletion-targeted multiplex PCR (DTM-PCR) for identification of Beijing/W genotypes ofMycobacteriumtuberculosis. Tuberculosis,2007,87(5):446-449.
[5] Rindi L,Lari N,Cuccu B, et al. Evolutionary pathway of the Beijing lineage ofMycobacteriumtuberculosisbased on genomic deletions and mutt genes polymorphism. Infect Genet Evol,2009, 9(1):48-53.
[6] Mokrousov I,Ly HM,Otten T, et al. Origin and primary dispersal of theMycobacteriumtuberculosisBeijing genotype: Clues from human phylogeography. Genome Res,2005, 15(10):1357-1364.
[7] Bifani PJ,Plikaytis BB,Kapur V, et al. Origin and interstate spread of a New York City multidrug-resistantMycobacteriumtuberculosisclone family. JAMA,1996, 275(6):452-457.
[8] 赵雁林,王黎霞,成诗明.分枝杆菌分离培养标准化操作程序及质量保证手册.北京:人民卫生出版社,2013.
[9] 赵德福,谢彤,巨韩芳,等. 利用多重PCR方法快速鉴定结核分枝杆菌北京基因型菌株. 中国防痨杂志,2010,32(6):315-317.
[10] Hanekom M,van der Spuy GD,Streicher E, et al. A recently sublineage of theMycobacteriumtuberculosisBeijing strain family is associated an increased ability to spread and cause disease. J Clin Microbiol,2007,45(5):1483-1490.
[11] Wada T,Iwamoto T,Maeda S. Genetic diversity of theMycobacteriumtuberculosisBeijing family in East Asia revealed through refined population structure analysis. FEMS Micro-biol Lett,2009, 291(1):35-43.
[12] Pang Y, Zhou Y, Zhao B, et al. Spoligotyping and drug resistance analysis ofMycobacteriumtuberculosisstrains from national survey in China. PLoS One, 2012,7(3):e32976.
[13] 柴利泉,李卫民,李丽,等. 天津地区临床分离结核分枝杆菌分型的初步研究. 中华流行病学杂志,2007,28(8): 785-788.
[14] Wang J,Liu Y,Zhang CL, et al. Genotype and characteristics of clustering and drug susceptibility ofMycobacteriumtuberculosisisolates collected in Heilongjiang province, China. J Clin Microbiol,2011,49(4):1354-1362.
[15] 王小平,逄宇,赵晓,等. 宁夏回族自治区结核分枝杆菌基因分型及与耐药性的关系研究. 中国防痨杂志,2013, 35(12):655-659.
[16] Park YK,Shin S,Ryu S, et al. Comparison of drug resistance genotype between Beijing and non-Beijing family strains ofMycobacteriumtuberculosisin Korea. J Microbiol Methods,2005, 63(2):165-172.
[17] Yang C,Luo T,Sun G, et al.MycobacteriumtuberculosisBeijing strains favor transmission but not drug resistance in China. Clin Infect Dis,2012,55(9):1179-1187.
[18] Parwati I,van Crevel R,van Soolingen D. Possible underlying mechanisms for successful emergence of theMycobacteriumtuberculosisBeijing genotype strains(Review). Lancet Infect Dis,2010,10(2):103-111.
[19] Kremer K,van-der-Werf MJ,Au BK, et al. Vaccine-induced immunity circumvented by typicalMycobacteriumtuberculosisBeijing strains. Emerg Infect Dis,2009,15(2):335-339.
[20] Chen YY,Chang JR,Huang WF,et al. The pattern of cytokine production in Vitro induced by ancient and modern BeijingMycobacteriumtuberculosisstrains. PLoS One,2014,9(4):e94296.
(本文编辑:范永德)
AncientMycobacteriumtuberculosisBeijing genotype clinical isolates are associated with drug resistance in Tianjin, China
XIETong*,JUHan-fang,WANGChun-hua,WANGZhi-rui,MUCheng,ZHAOHui,WANGYan-nan,SUNRui,WANGXie-xiu.
*TianjinCentersForDiseaseControlandPrevention,Tianjin300011,China
WANGXie-xiu,Email:wjsttigo@126.com
ObjectiveMycobacteriumtuberculosis(Mtb) Beijing genotype strains are globally distributed and have evolved a variety of sublineages. Based on the absence or presence of IS6110 insertions in the noise transfer function (NTF) chromosomal region, Beijing genotype strains can be divided into two sublineages, known as ancient (atypical) and modern (typical) strains. This study aimed to investigate the prevalence of Beijing sublineages and the relationship between these sublineages and drug-resistance. Methods A total of 816 clinical isolates of Mtb from 2012 to 2014 were used. Deletion of Region of difference (RD) 207 and RD105 was detected using PCR to identify Beijing genotype isolates. Numbers of IS6110 insertions in the NTF region in the Beijing strains were determined and the association between Beijing genotype sublineage and drug-resistance was analyzed. Results Of the 816 isolates examined, 764 (93.63%) strains belonged to the Beijing genotype. Of these, 110 (14.40%) were ancient strains, and 654 (85.60%) strains were modern strains. One modern strain belonged to W strain, which had two IS6110 insertions in the NTF region. Ancient Beijing strains were more highly represented than modern Beijing stains among isoniazide-resistant (26.36% vs 10.70%,χ2=20.47,P<0.01), rifampin-resistant (14.55% vs 6.57%,χ2=8.40,P<0.01) and ethambutol-resistant (8.18% vs 3.21%,χ2=6.17,P<0.05) strains. Proportions of ancient Beijing strains were significantly higher than those of modern Beijing stains among MDR-TB strains (13.64% vs 4.74%,χ2=13.17,P<0.01). Conclusion Modern Beijing strains are predominant in China, and ancient Beijing strains exhibit a greater association with drug resistance. Our findings imply that drug resistance may not be the major factor driving Beijing genotype transmission in Tianjin, China.
Mycobacteriumtuberculosis; Genotype; Drug resistance,bacterial; Phenotype
10.3969/j.issn.1000-6621.2015.09.003
国家自然科学基金(81172736)
300011 天津市疾病预防控制中心(谢彤、王志锐、王撷秀);天津市结核病控制中心结核病参比实验室(巨韩芳、王春花、穆成、赵慧、王艳楠、孙蕊)
王撷秀,Email: wjsttigo@126.com
2015-03-03)

