依达拉奉减轻大鼠肾小管上皮细胞氧化应激与凋亡作用
张敏,沈建明
(1.湖北省医学会,武汉 430071;2.湖北医药学院附属人民医院肾内科,十堰 442000)
依达拉奉减轻大鼠肾小管上皮细胞氧化应激与凋亡作用
张敏1,沈建明2
(1.湖北省医学会,武汉 430071;2.湖北医药学院附属人民医院肾内科,十堰 442000)
目的 观察依达拉奉对大鼠肾小管上皮细胞的保护作用及其机制。方法 将传代培养的大鼠肾小管上皮细胞(NRK-52E)分为对照组、模型对照组(50 μmol·mL-1顺铂)、给药组A(50 μmol·mL-1顺铂+10 μmol·mL-1依达拉奉)、给药组B(50 μmol·mL-1顺铂+20 μmol·mL-1依达拉奉)和给药组C(50 μmol·mL-1顺铂+40 μmol·mL-1依达拉奉),检测各组细胞增殖能力、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性、活性氧(ROS)水平、细胞凋亡率、Bax和Bcl-2蛋白和mRNA表达以及Caspase-3活性。结果 顺铂刺激NRK-52E细胞后,细胞增殖能力下降,MDA含量和ROS水平升高,SOD活性下降,细胞凋亡增加,Bax、Bcl-2蛋白和mRNA表达增多,Caspase-3活性升高。依达拉奉可以提高细胞增殖能力,降低MDA含量,降低ROS水平,增强SOD活性,减少细胞凋亡,下调Bax蛋白和 mRNA表达,上调Bcl-2 蛋白和mRNA表达,降低Caspase-3活性(P<0.05)。结论 依达拉奉通过减轻氧化应激和抑制细胞凋亡而减轻顺铂诱导的大鼠肾小管上皮细胞损伤。
依达拉奉;顺铂;损伤,肾;氧化应激;凋亡,细胞
顺铂是临床常用化学治疗(化疗)药物,由于其对癌细胞缺乏选择性,而且进入机体后主要通过肾脏排泄,所以其肾毒性明显。如何防治顺铂造成的肾损伤是亟待解决的问题。研究发现,在顺铂造成肾损伤的病理生理过程中,肾小管上皮细胞氧化应激和凋亡具有重要作用[1]。作为氧自由基清除药,依达拉奉可以减轻急性脑梗死患者发生急性肾损伤的风险[2]。笔者在本研究中通过体外培养大鼠肾小管上皮细胞,在应用顺铂造成细胞损伤的同时予以依达拉奉干预,以观察依达拉奉对顺铂诱导大鼠肾小管细胞损伤的影响并探讨其可能机制。
1 材料与方法
1.1 细胞与试剂 大鼠近端肾小管上皮细胞株(NRK-52E)购自广州市齐云生物技术有限公司;依达拉奉(南京先声东元制药有限公司,批号:80-131111),顺铂(浙江海正药业股份有限公司,批号:20100123),达尔伯克改良伊格尔培养液(Dulbecco's modification of Eagle's medium,DMEM,批号:11965-092)和胎牛血清(批号:120921)购自美国Gibco公司,丙二醛(malondialdehyde,MDA,批号:20121217)和超氧化物歧化酶(superoxide dismutase,SOD,批号:20121215)试剂盒购自南京建成生物工程研究所,活性氧(reactive oxygen species,ROS)检测荧光探针氯甲基二氯二氢荧光素二乙酯[5-(and-b)-chloromethyl-2',7'-dichorodihydrofluorescein diacetate, acetylester,CM-H2DCFDA,批号:D12058]购自Molecular Probes公司,Annexin V-FITC/PI凋亡检测试剂盒(批号:20121013)购自南京凯基公司,兔抗大鼠Bax、Bcl-2单克隆抗体(批号:SC7780,BA1437)购自北京中山生物技术公司,RNA提取试剂Trizol(批号:1175563)购自Invitrogen公司,逆转录-聚合酶链反应(RT-PCR)试剂盒(批号:998697)购自杭州博日公司,PCR引物由上海英骏生物公司合成,Caspase-3活性试剂盒(批号:20120815)购自碧云天生物技术研究所。
1.2 细胞培养与分组 NRK-52E细胞用培养液于含5%二氧化碳(CO2)、37 ℃恒温培养箱中孵育,0.25%胰蛋白酶消化,1:3传代培养。待细胞融合达70%~80%时,改用无血清培养液培养24 h使其同步化。取对数生长期NRK-52E细胞分为5组:对照组、模型对照组(顺铂50 μmol·mL-1)、给药组A(顺铂50 μmol·mL-1+依达拉奉10 μmol·mL-1)、给药组B(顺铂50 μmol·mL-1+依达拉奉20 μmol·mL-1)、给药组C(顺铂50 μmol·mL-1+依达拉奉40 μmol·mL-1)。每组均设5个复孔,顺铂和依达拉奉剂量参考文献[3-4]。
1.3 检测指标
1.3.1 细胞增殖能力检测 按上述分组加入处理因素培养48 h,培养结束前4 h,培养板每孔加四甲基偶氮唑盐(methyl thiazolyl tetrazolium salt,MTT,5 mg·mL-1)工作液20 μL,继续培养4 h,终止培养,吸弃孔内培养液,加入二甲亚砜(dimethyl sulfoxide,DMSO)100 μL,振荡混匀10 min。在酶标仪上检测波长490 nm处各孔吸光度(A值),各组细胞抑制率(%)=(1-实验组A值/对照组A值)×100%。
1.3.2 细胞MDA含量和SOD活性检测 按上述分组加入处理因素培养48 h,0.25%胰酶消化细胞,磷酸盐缓冲液(phosphate buffered solution,PBS)洗3次,加细胞裂解液100 μL裂解细胞,4 000 r·min-1离心,取上清液,Brad ford蛋白浓度测定试剂盒测蛋白浓度,按试剂盒说明书操作,化学比色法测定细胞内MDA含量和SOD活性。
1.3.3 细胞内ROS水平检测 按上述分组加入处理因素培养48 h后,滴加CM-H2DCFDA染液,37 ℃避光孵育30 min,吸除染液,PBS洗涤细胞3次,应用FLUOstar荧光定量仪检测细胞内荧光强度,用以反映ROS水平。
1.3.4 细胞凋亡率的检测 按上述分组加入处理因素培养48 h,取细胞1 mL(细胞密度1×109个·L-1),800 r·min-1、4 ℃离心后,弃去上清液。预冷PBS漂洗,将细胞重悬于500 μL结合缓冲液中。加入AnnexinⅤ-FITC和PI各5 μL混匀,筛网过滤后,流式细胞仪检测细胞凋亡率。
1.3.5 Western blot检测Bax和Bcl-2蛋白表达 按上述分组加入处理因素培养48 h收集细胞,加细胞裂解液,破碎后样品经低温离心,取上清液测定蛋白含量,Western blot法检测Bax和Bcl-2蛋白表达;β-actin内参,ECL化学发光,胶片显影定影,Quatity One软件进行灰度分析。
1.3.6 RT-PCR检测细胞Bax和Bcl-2 mRNA表达检测 按上述分组加入处理因素培养48 h后收集细胞。Trizol试剂盒提取细胞总RNA,紫外分光光度计测定其含量及纯度。引物设计参照Premier 6.0设计,β-actin上游引物5′-AGAGCTACGAGCTGCCTGAC-3′,下游引物5′- AGCACTGTGTTGGCGTACAG-3′,扩增产物片段227 bp。Bax上游引物5′-TTTGCTTCAGGGTTTCATCC-3′,下游引物5′-CAGTTGAAGTTGCCGTCAGA-3′,扩增产物片段135 bp。Bcl-2上游引物5′-CCTGGCATC-TTCTCCTT-3′,下游引物5′-ACATCTCCCTGTTGACG-3′,扩增产物片段355 bp。退火温度分别为58,55.1和49.7 ℃,30个循环。PCR产物在2%琼脂糖凝胶电泳,应用凝胶成像系统分析,计算目的基因与内参照基因A值的比值。
1.3.7 细胞Caspase-3活性检测 上述分组加入处理因素培养48 h后收集细胞,加细胞裂解液,破碎后样品经低温离心,取上清液测定蛋白含量,与P硝基苯胺反应,比色法在波长405 nm处测A值表示Caspase-3活性。
2 结果
2.1 依达拉奉对NRK-52E细胞增殖能力的影响 模型对照组细胞生长抑制率(46.27±9.76)%。与模型对照组比较,给药组A、给药组B和给药组C细胞生长抑制率[分别为(34.33±8.34)%,(23.88±5.73)%和(13.43±6.16)%]均降低(F=18.20,P<0.05)。
2.2 依达拉奉对NRK-52E细胞MDA含量和SOD活性的影响 对照组以蛋白质为单位的MDA含量为(6.24±1.33) nmol·mg-1,模型对照组MDA含量[(12.79±2.73) nmol·mg-1]较对照组高;给药组A、给药组B和给药组C MDA含量[分别为(11.05±1.71)、(9.93±1.91)和(8.25±1.88)nmol·mg-1]均较模型对照组低(F=8.26,P<0.05)。对照组以蛋白质为单位的SOD活性(74.62±5.83)U·mg-1,模型对照组SOD活性[(43.52±6.94)U·mg-1]较对照组低;给药组A、给药组B和给药组C SOD活性[分别为(52.38±7.75),(60.26±6.74)、(65.67±7.32)U·mg-1]均较模型对照组高(P<0.05)。
2.3 依达拉奉对NRK-52E细胞ROS水平的影响 对照组荧光强度为(3.1±0.6),模型对照组荧光强度(13.6±2.1)较对照组升高,给药组A、给药组B和给药组C的荧光强度[分别为(11.5±2.0),(8.9±1.8),(7.1±1.5)]均较模型对照组低(P<0.05)。
2.4 依达拉奉对NRK-52E细胞凋亡的影响 对照组细胞凋亡率(6.33±0.38)%,模型对照组细胞凋亡率[(38.41±1.59)%]较对照组高,给药组A、给药组B和给药组C细胞凋亡率[分别为(32.17±1.65)%,(27.63±1.56)%和(21.58±1.32)%]均较模型对照组降低(P<0.05)(图1)。
2.5 依达拉奉对NRK-52E细胞Bax和Bcl-2蛋白和mRNA表达的影响 对照组Bax蛋白和mRNA的表达分别为 0.21±0.04,0.46±0.05;模型对照组Bax蛋白(0.89±0.23)和mRNA(1.96±0.56)表达均较对照组增加;给药组A、给药组B和给药组C的Bax蛋白[分别为(0.77±0.10),(0.53±0.08),(0.43±0.07)]和mRNA[分别为(1.70±0.33),(1.46±0.24),(0.89±0.13)]表达均较模型对照组低(F=23.71,18.99,P<0.05);对照组Bcl-2蛋白和mRNA的表达分别为(0.29±0.08),(0.54±0.03),模型对照组Bcl-2蛋白(0.39±0.09)和mRNA(0.70±0.09)均较对照组增加;给药组A、给药组B和给药组C的Bcl-2蛋白[分别为(0.52±0.11),(0.63±0.12),(0.74±0.17)]和mRNA[分别为(0.89±0.15),(1.22±0.17),(1.48±0.29)]均较模型对照组高(F=15.57,23.52,P<0.05)(图2,图3)。
2.6 依达拉奉对NRK-52E细胞Caspase-3活性的影响 对照组Caspase-3活性为(0.07±0.03),模型对照组Caspase-3活性(0.51±0.11)较对照组高,给药组A、给药组B和给药组C的Caspase-3活性[分别为(0.40±0.09),(0.32±0.08)和(0.24±0.07)]均较模型对照组低(P<0.05)。
3 讨论
顺铂是一种铂类抗癌药物,对部分肿瘤有较好疗效[5]。但在临床应用过程中发现,因顺铂化疗而导致肾损害的发生率高达20%~30%[6],顺铂对肾脏的损伤主要表现在肾小管损伤。与QI等[3]报道相似,本研究将大鼠NRK-52E细胞和顺铂一同培养48 h,发现NRK-52E细胞增殖能力降低,也说明顺铂可以引起肾小管上皮细胞损伤。
病理情况下,顺铂可以损害线粒体呼吸链的正常电子传递,导致ROS生成过多,进而引起更加剧烈的氧化应激反应,加重细胞损伤。国外研究显示,在顺铂肾损伤大鼠模型中,肾组织SOD活性降低,MDA含量升高[7],将顺铂和猪肾小管上皮细胞一起培养,细胞ROS水平明显升高[8]。本研究也发现,顺铂可以引起大鼠NRK-52E细胞MDA含量升高,SOD活性下降,ROS水平升高,进一步说明氧化应激参与顺铂诱导肾小管上皮细胞损伤。研究显示,顺铂可以引起人肾小管上皮细胞Bax/Bcl-2比值和Caspase-3活性升高,细胞凋亡显著[9]。本研究也发现顺铂引起NRK-52E细胞凋亡增多,Bax和Bcl-2蛋白和mRNA表达增加,caspase-3活性增强。
依达拉奉是目前常用于治疗脑梗死的自由基清除药[10],在过氧化氢诱导的海马神经元HT22细胞损伤模型里,依达拉奉可以具有拮抗氧化应激、降低ROS水平、下调Bax表达、上调Bcl表达、抑制细胞凋亡、减轻细胞损伤的作用[11]。本研究给予依达拉奉干预后,大鼠NRK-52E细胞增殖能力升高,说明依达拉奉可以减轻顺铂造成的肾小管上皮细胞损伤。同时给药组肾小管上皮细胞MDA含量降低、SOD活性增强、ROS水平下降,说明依达拉奉可以减轻顺铂诱导的肾小管上皮细胞氧化应激反应;而给药组肾小管上皮细胞凋亡减少,Bax 蛋白和mRNA表达下调,Bcl-2蛋白和 mRNA表达上调,Caspase-3活性减弱,证明依达拉奉通过下调促凋亡基因表达和上调抗凋亡基因表达,抑制Caspase-3活化,进而抑制顺铂诱导的肾小管上皮细胞凋亡。而国外研究也证实,通过抑制氧化应激,减少细胞凋亡,可以减轻顺铂造成的肾小管上皮细胞损伤[12-13]。
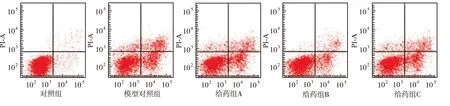
图1 5组NRK-52E细胞凋亡率测定结果

图2 5组NRK-52E细胞Bax与Bcl-2蛋白表达情况
Fig.2 Protein expression of Bax and Bcl-2 in five groups of NRK-52E cells

图3 5组NRK-52E细胞Bax和Bcl-2 mRNA表达情况
Fig.3 mRNA expression of Bax and Bcl-2 in five groups of NRK-52E cells
本研究通过体外实验结果表明,依达拉奉可通过抑制氧化应激和细胞凋亡,减轻顺铂诱导的大鼠肾小管上皮细胞。
[1] JEONG J J,PARK N,KWON Y J,et al.Role of annexin A5 in cisplatin-induced toxicity in renal cells:molecular mechanism of apoptosis[J].J Biol Chem,2014, 289(4):2469-2481.
[2] KAMOUCHI M,SAKAI H,KIYOHARA Y,et al.Acute kid-ney injury and edaravone in acute ischemic stroke:the Fukuoka Stroke Registry[J].J Stroke Cerebrovasc Dis,2013,22(8):470-476.
[3] QI S,WU D.Bone marrow-derived mesenchymal stem cells protect against cisplatin-induced acute kidney injury in rats by inhibiting cell apoptosis[J].Int J Mol Med,2013,32(6):1262-1272.
[4] 何勇,李战宁,耿希刚.依达拉奉对缺氧复氧损伤诱导心肌细胞凋亡的影响[J].西安交通大学学报(医学版),2013,34(4):490-494.
[5] 张梦怡,郑恒,陈鹰,等.多肽P161联合顺铂对多种肿瘤细胞增殖的抑制作用[J].医药导报,2014,33(10):1288-1290.
[6] MILLER R P,TADAGAVADI R K,RAMESH G,et al.Mec-hanisms of cisplatin nephrotoxioity [J].Toxins(Basel),2010,2(11):2490-2518.
[7] HELMY M W,HELMY M M,ABD ALLAH D M,et al.Role of nitrergic and endothelin pathways modulations in cisplatin-induced nephrotoxicity in male rats[J].J Physiol Pharmacol,2014,65(3):393-399.
[8] SONG J,LIU D,FENG L,et al.Protective effect of stand-ardized extract of ginkgo biloba against cisplatin-induced nephrotoxicity[J].Evid Based Complement Alternat Med,2013,2013,846126.
[9] KAEIDI A,RASOULIAN B,HAJIALIZADEH Z,et al.Cis-platin toxicity reduced in human cultured renal tubular cells by oxygen pretreatment[J].Ren Fail,2013,35(10):1382-1386.
[10] 胡仁林,张细六,李鸣,等.丹红注射液联合依达拉奉治疗脑梗死50 例[J].医药导报,2014,33(8):1050-1053.
[11] ZHAO Z Y,LUAN P,HUANG S X,et al.Edaravone pro-tects HT22 neurons from H2O2-induced apoptosis by inhibiting the MAPK signaling pathway[J].CNS Neurosci Ther,2013,19(3):163-169.
[12] ABDEL MONEIM A E,OTHMAN M S,AREF A M.Azad-irachta indica attenuates cisplatin-induced nephrotoxicity and oxidative stress[J].Biomed Res Int,2014,2014:647131.
[13] ZOU P,SONG J,JIANG B,et al.Epigallocatechin-3-gallate protects against cisplatin nephrotoxicity by inhibiting the apoptosis in mouse[J].Int J Clin Exp Pathol,2014,7(8):4607-4616.
DOI 10.3870/yydb.2015.07.007
Protection of Edararone on Oxidative Stress and Apoptosis 40 Renal Tubular EpithelialCells in Rats
ZHANG Min1, SHEN Jianming2
(1.HubeiMedicalAssociation,Wuhan430071,China;2.DepartmentofNephrology,RenminHospital,HubeiUniversityofMedicine,Shiyan442000,China)
Objective To investigate the protective effect and its mechanism of edaravone against rat renal tubular epithelial cell injury induced by cisplatin. Methods The rat renal tubular epithelial cells (NRK-52E) were divided into the control, model control (50 μmol·mL-1cisplatin), group A (50 μmol·mL-1cisplatin plus 10 μmol·mL-1edaravone), B (50 μmol·mL-1cisplatin plus 20 μmol·mL-1edaravone), and C (50 μmol·mL-1cisplatin plus 40 μmol·mL-1edaravone).The cell proliferation ability, content of malondialdehyde, activity of superoxide dismutase(SOD), level of reactive oxygen species(ROS), rate of apoptosis, express of protein and mRNA of Bax, Bcl-2 and Caspase-3 activation of cell were detected. Results The proliferation and SOD activity in NRK-52E cells declined, malondialdehyde and ROS were elevated upon being co-cultured with cisplatin.Moreover, the rate of apoptosis, express of protein and mRNA of Bax and Bcl-2, and Caspase-3 activation of cells were upregulated compared to the control group.However, edaravone stimulated cell proliferation, SOD activity and protein and mRNA of Bcl-2 and lowered content of malondialdehyde, level of ROS, rate of apoptosis, express of Bax protein and mRNA and Caspase-3 activation of cell(P<0.05). Conclusion Edaravone can alleviate rat renal tubular epithelial cell injury induced by cisplatin, via inhibiting oxidative stress and down-regulating cell apoptosis.
Edaravone;Cisplatin;Injury,renal;Oxidative stress;Apoptosis, cell
2014-09-19
2014-10-22
张敏(1976-),女,湖北十堰人,副主任医师,硕士,主要从事肿瘤疾病研究。E-mail:zhminhb@sina.com。
沈建明(1975-),男,副主任医师,硕士,主要从事肾脏病专业研究。E-mail:shmushjm@hotmail.com。
R692.5;R969
A
1004-0781(2015)07-0875-04

