YC-1体外调控卵巢癌化学治疗敏感性*
黄金玲,洪莉,洪莎莎,闵洁,胡鸣,赵杨,杨青
(武汉大学人民医院妇产科,武汉 430060)
YC-1体外调控卵巢癌化学治疗敏感性*
黄金玲,洪莉,洪莎莎,闵洁,胡鸣,赵杨,杨青
(武汉大学人民医院妇产科,武汉 430060)
目的 探讨缺氧诱导因子抑制剂YC-1对人卵巢癌细胞A2780s顺铂化疗敏感性的影响。方法 将培养好的卵巢癌细胞分为对照组、YC-1组、顺铂组、YC-1+顺铂组,分别给予等量0.9%氯化钠溶液、YC-1、顺铂、YC-1 +顺铂处理。Real time PCR检测各组缺氧诱导因子HIF-1α和血管内皮生长因子(VEGF)mRNA相对表达量2-△△CT值;蛋白质印迹法检测各组HIF-1α和VEGF灰度值反应蛋白表达量;比较各组间HIF-1α和VEGF表达水平差异,评价卵巢癌细胞微环境中缺氧程度及血管生成能力变化。结果 HIF-1α和VEGF mRNA及蛋白在YC-1组、顺铂组、YC-1+顺铂组中的表达均显著低于对照组(P<0.05);YC-1+顺铂组HIF-1α和VEGF mRNA及蛋白表达显著低于顺铂组(P<0.05);YC-1组与顺铂组比较,mRNA及蛋白表达差异无统计学意义;HIF-1α与VEGF mRNA在各组间的表达水平呈正相关(相关系数为0.830 5)。结论 YC-1具有抗卵巢癌作用,与顺铂联合应用能够增强其化学治疗敏感性。
3-(5'-羟甲基-2'-呋喃基)-1-苯甲基吲唑;缺氧诱导因子;癌,卵巢;顺铂;耐药
卵巢癌在女性生殖系统恶性肿瘤中发病率居第 2 位。因其发病隐匿、病情发展迅速,病死率居于妇科恶性肿瘤之首,5 年生存率25%~30%[1]。对于中、晚期卵巢癌患者,手术后化学治疗(化疗)是主要治疗手段,因此耐药与药物不良反应是影响治疗效果的重要因素。顺铂目前被广泛用于多种恶性肿瘤化疗,也是卵巢癌化疗的临床一线用药,但耐药问题普遍存在,严重影响化疗效果,导致不良预后比例增加,因此寻找改善其耐药状况的有效手段是亟待解决的问题。
研究认为,恶性肿瘤中缺氧微环境的形成与肿瘤的恶性侵袭能力及耐药性密切相关。缺氧诱导因子1(hypoxia-inducible factor-1,HIF-1)是介导肿瘤缺氧适应并促进肿瘤生长的关键因子,同时在基因水平直接调控血管内皮生长因子(vascular endothelial growth factor,VEGF)表达,导致血管大量增生,进而导致肿瘤生长失控、耐药性增加[2]。
3-(5′-羟甲基-2′-呋喃基)-1-苯甲基吲唑[1-benzyl-3- (5-hydroxymethylfur-2-yl) indazole ,YC-1]是一种人工合成物的HIF-1抑制药,可从多方面抑制肿瘤生长,如细胞周期抑制、诱导细胞凋亡、抗肿瘤血管生成等,已有细胞及动物实验等发现其在治疗肝癌及宫颈癌等方面的价值[3],笔者在本实验中将YC-1与顺铂联合作用于卵巢癌细胞A2780s,观察其抗卵巢癌、增加顺铂化疗敏感性的效果,以期为其临床应用提供实验依据。
1 材料与方法
1.1 细胞培养 人卵巢癌细胞株A2780s,购自中国典型培养物保藏中心。
1.2 药品与试剂 Trizol Reagent(Invitrogen Life Technologies,目录号:15596-026);反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit,Thermo生产,目录号:#K1622);定量PCR试剂盒[FastStart Universal SYBR Green Master(Rox),Roche生产,目录号:04 913914 001];引物:由Invitrogen Biotechnology Co., LTD中国公司合成;兔抗人Actin(Santa公司)、兔抗人HIF-1α、兔抗人VEGF(Epitomics公司),二抗山羊抗兔(KPL公司);三氯甲烷、异丙醇、无水乙醇购自国药集团化学试剂有限公司。YC-1(Enzo life sciences,批号:ALX-420-025-M001,含量:1 mg)
1.3 仪器与设备 离心机(Heal Force,型号:台式高速冷冻离心机Neofuge 15R);荧光定量PCR仪(SLAN荧光定量PCR检测系统,上海宏石医疗科技有限公司生产);超净工作台(苏净安泰,型号:SW-CJ-1FD);离心管、TIP头均购自Axygen Biosciences。
1.4 实验步骤
1.4.1 细胞分组及处理 将细胞培养并传代后制成1×107个·mL-1细胞悬液,台盼蓝染色示活细胞数>95%。将培养好的细胞随机分为对照组、YC-1组、顺铂组、YC-1+顺铂组,每组3个样本。对照组给予等量0.9%氯化钠溶液处理,YC-1组给予10 μmol·L-1YC-1,顺铂组给予10 μg·L-1顺铂,YC-1+顺铂组给予10 μmol·L-1YC-1 +10 μg·L-1顺铂。均孵育24 h。
1.4.2 Real time PCR 采用TriIzoL试剂提取总RNA。经反转录后按实时荧光定量PCR试剂盒说明书进行操作定量PCR,引物由Invitrogen Biotechnology Co.,LTD中国公司合成,见表1,实验重复3次。结果计算采用相对定量ΔΔCT法,即以内参基因actin 为标准,计算实验样本相对于校准样本目标基因的变化倍数,CT值为初始循环数,即扩增产物累积增多至足以产生荧光信号时记录下来的循环数,取3个样本CT值的平均数,△CT=CT目的基因-CTβ-actin,△△CT=△CT实验-△CT对照,扩增倍数=2-△△CT,代表mRNA的相对表达量。
1.4.3 蛋白质印迹法(Western blot) 药物孵育后每组取106个细胞,提取蛋白质。经Bradford法定量,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离、转膜、反应后分别加入兔抗人Actin、兔抗人HIF-1α、兔抗人VEGF,经孵育过夜、二抗山羊抗兔反应并显影,实验重复3次。以AlphaEase FC软件扫描并分析图象,计算灰度值。

表1 引物序列
2 结果
2.1 Real time PCR结果
2.1.1 HIF-1α及VEGF mRNA的表达 实验结果显示,与对照组比较,YC-1组、顺铂组及YC-1+顺铂组HIF-1α及VEGF mRNA表达均显著降低,差异有统计学意义(P<0.05);YC-1+顺铂组HIF-1α和VEGF mRNA表达明显低于YC-1组和顺铂组,均差异有统计学意义(P<0.05);YC-1组与顺铂组比较,HIF-1α及VEGF mRNA表达差异无统计学意义(图1)。
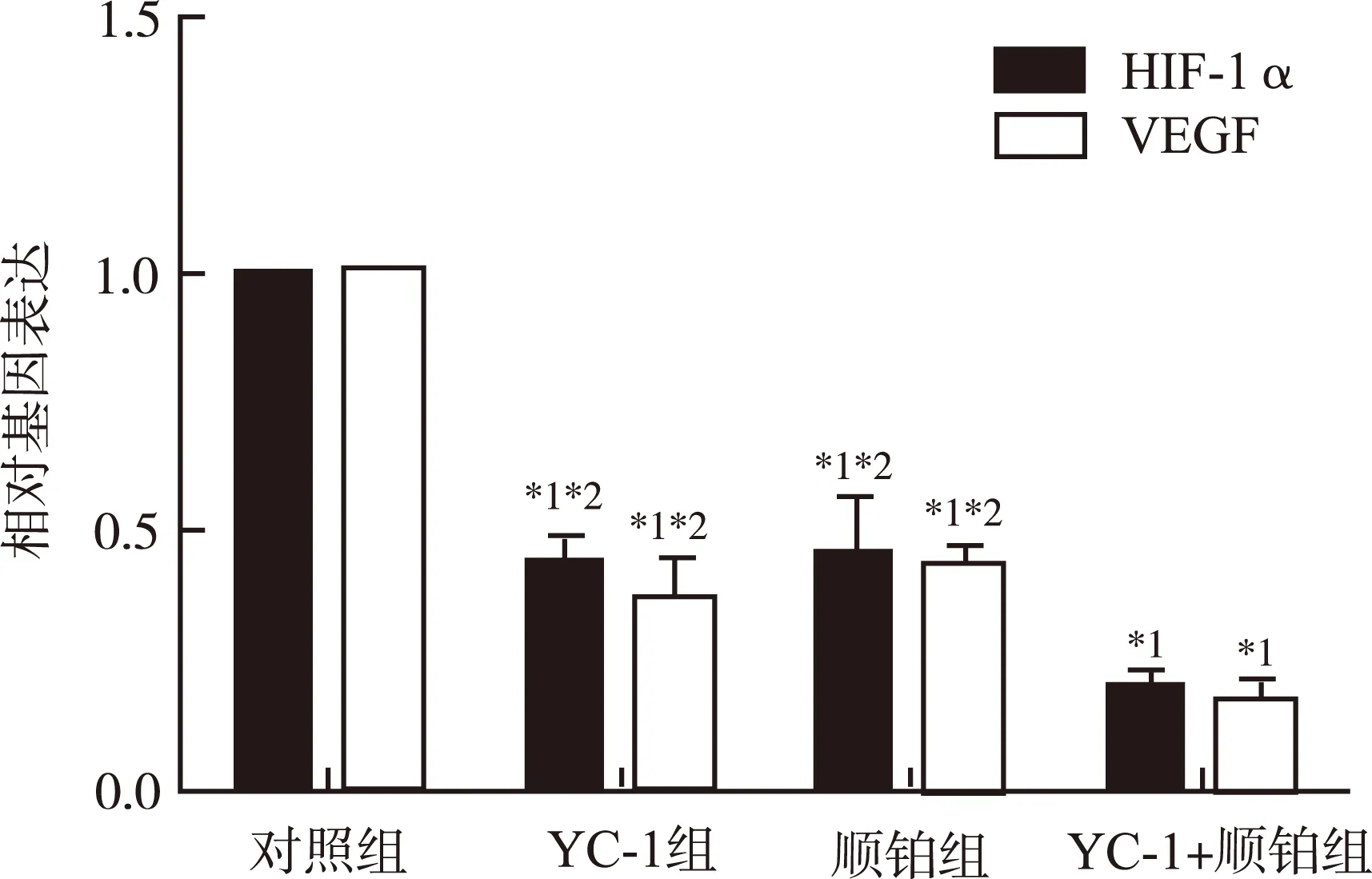
与对照组比较,*1P<0.05;与YC-1+顺铂组比较,*2P<0.05
图1 4组细胞HIF-1α与VEGF mRNA表达情况
Compared with control group ,*1P<0.05;compared with YC-1 plus cisplatin group,*2P<0.05
Fig.1 mRNA expression of HIF-1α and VEGF in four groups of cells
2.1.2 HIF-1α及VEGF mRNA表达相关性分析 经Pearson相关性分析,取95%可信区间,结果HIF-1α与VEGF mRNA 在各组的表达具有正相关性,r=0.830 5(图2)。
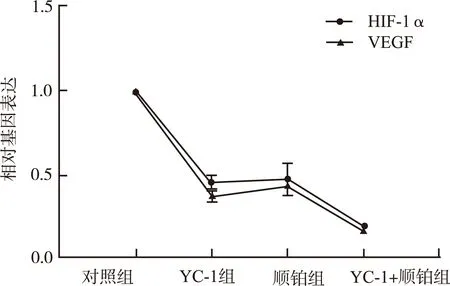
图2 HIF-1α与VEGF mRNA 相关性分析
Fig.2 Correlation analysis on mRNA expression of HIF-1α and VEGF
2.2 Western blot结果 在actin 蛋白表达基本一致的情况下,YC-1组、顺铂组及YC-1+顺铂组HIF-1α及VEGF蛋白表达低于对照组;YC-1+顺铂组HIF-1α和VEGF蛋白表达低于YC-1组和顺铂组(图3)。通过AlphaEase FC软件计算灰度值,HIF-1α/actin及VEGF/actin代表蛋白表达量,进行统计学分析,亦得到相似结果:YC-1组、顺铂组及YC-1+顺铂组HIF-1α与VEGF蛋白表达均低于对照组,差异有统计学意义(P<0.05);YC-1+顺铂组HIF-1α与VEGF mRNA表达低于YC-1组和顺铂组,差异有统计学意义(P<0.05);YC-1组与顺铂组比较,HIF-1α及VEGF蛋白表达差异无统计学意义(图4)。
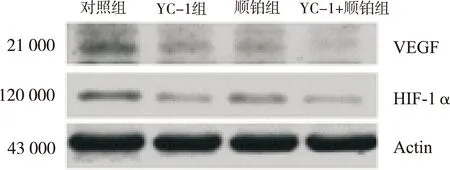
图3 HIF-1α及VEGF 蛋白电泳结果
Fig.3 Protein electrophoresis of HIF-1α and VEGF
3 讨论
卵巢癌化疗耐药是目前临床导致卵巢癌死亡率高、预后差的重要因素之一,本研究从蛋白及mRNA水平证实YC-1降低卵巢癌细胞株A2780s中HIF-1α及血管生成因子VEGF的表达,改善了其中的缺氧状态,抑制血管的生成,与顺铂联合应用能够增加卵巢癌细胞A2780s对顺铂化疗的敏感性。
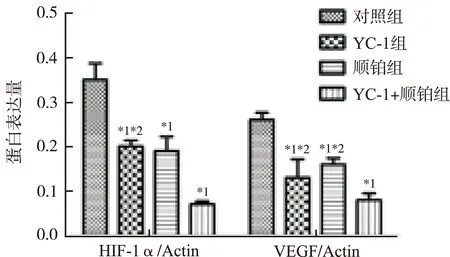
与对照组比较,*1P<0.05;与YC-1+顺铂组比较,*2P<0.05
图4 HIF-1α及VEGF蛋白的表达灰度分析
Compared with control group,*1P<0.05;compared with YC-1 plus cisplatin group,*2P<0.05
Fig.4 Gradation analysis on the protein expression of HIF-1α and VEGF
研究证实,实体肿瘤中缺氧环境的形成是肿瘤生长失控、浸润转移、血管异常增生及肿瘤耐药发生的关键微环境改变,其形成原因可能是因为其生长速度快,其中的新生血管生成相对缓慢,造成瘤体中部分缺氧区域,为了改善缺氧环境,肿瘤又进一步产生了一系列诱导新生血管生成的机制以保证供氧,造成肿瘤中大量异形血管生成,而这种典型的恶性侵袭行为又进一步增加了肿瘤的生存力和侵犯能力[4]。在这其中起到调节作用的HIF-1转录因子,在调节新生血管的生成中起到了关键作用。许多研究表明,HIF-1在实体肿瘤中高表达,对肿瘤的生长过程起正调节作用,意味着肿瘤的缺氧状态,而缺氧又进一步使肿瘤细胞变得更加不稳定,增加肿瘤的侵袭力及对放化疗的抵抗性[2],因此近年来对HIF-1为靶点的研究逐渐增多。HIF-1包括α和β两个亚基,目前发现HIF-α有3个亚型,分别为HIF-1α、HIF-2α和HIF-3α,其中HIF-1α是唯一的氧调节亚单位,决定HIF-1转录活性的关键蛋白,HIF-1α的表达程度随细胞内氧浓度而变,缺氧状态抑制了HIF-1α的降解,导致其在细胞内的浓度升高。并且HIF-1α因其氧相关表达的特异性,在肿瘤治疗中有其独特的优势:在缺氧环境、癌基因激活或抑癌基因失活时会被激活并过量表达,在正常组织中通过蛋白酶体途径被降解,表达量很低[5]。
近年对于HIF-1α抑制药的研究较多,其中YC-1为人工合成的一种化合物,最初主要应用于血栓方面的研究,具有抑制血小板聚集、ATP释放、磷酸肌醇分解的作用,并上调细胞内游离钙离子,在临床上具有防治血管内血栓形成的研究价值[3,6]。后来有研究发现其在肝癌细胞中能够抑制HIF-1α及VEGF表达,抑制肿瘤的进展[7],在动物实验中也发现YC-1引起HIF-1α的下调,减少新生血管的生成[8],抑制肿瘤的生长,而且并未发现YC-1引起严重的毒副作用或免疫抑制[9],因此其作为抗肿瘤药物在临床应用的潜在可能前景较为乐观。本实验中已经证实卵巢癌细胞株A2780s在经过YC-1孵育之后其内的HIF-1α蛋白及mRNA的表达明显低于对照组,证明在卵巢癌细胞中YC-1可有效改善肿瘤缺氧状态,从而达到抑制肿瘤生长的作用。
另外本实验中检测癌细胞中VEGF的表达,VEGF蛋白及mRNA表达降低提示血管生成受到抑制。VEGF是最主要的血管生成因子,也是目前研究最为热点的肿瘤血管生成及转移相关的细胞因子之一。VEGF在正常细胞和肿瘤细胞中均可合成分泌,可以促进内皮细胞增殖、新生血管形成和增加血管通透性,实验证实卵巢癌组织中HIF-1 mRNA表达与VEGF表达呈正相关,HIF-1通过诱导VEGF分泌的增加促进肿瘤新生血管形成[10],本研究进一步证实YC-1能够抑制A2780s卵巢癌细胞株中的血管生成。
本实验中笔者通过体外培养卵巢癌细胞,从蛋白和mRNA水平分别检测癌细胞中HIF-1α和VEGF的表达,结果显示经YC-1孵育后的卵巢癌细胞HIF-1α、VEGF mRNA和蛋白表达量明显低于对照组,而和顺铂组比较差异无统计学意义,相关性分析显示两组间正相关,已知HIF-1α与环境缺氧程度呈正相关,而VEGF反映肿瘤细胞中血管生成的能力,因此实验结果提示YC-1能够改善卵巢癌当中的缺氧状况,抑制新生血管生成,有可能作为抗卵巢癌的药物独立使用。而YC-1+顺铂组中HIF-1α、VEGF mRNA和蛋白表达量明显低于YC-1、顺铂单一用药组,可见二者联合应用增加了卵巢癌细胞A2780s对顺铂化疗的敏感性,有效抑制肿瘤细胞生长。但是对于YC-1增加顺铂化疗敏感性的机制目前尚未完全明确。考虑可能是缺氧环境改善后抑制了相关耐药基因的表达[11],或可能因改善了缺氧环境而抑制了多药耐药基因MDRI中的低氧反应原件,进而改善了肿瘤耐药性[12]。CHI等[11]在2007年即通过细胞体外培养和动物实验两种途径证实了YC-1下调肝癌中P-Stat3的表达,而后者是肿瘤化疗耐药的重要递质,YC-1与顺铂联合用药可增强肝癌的化疗敏感性,而对于卵巢癌目前为止尚无相关研究报道,本实验部分填补了这方面的研究空白。
关于YC-1对肿瘤中血管生成的影响,已经证实其对乳腺癌中血管生成的抑制作用[13],本实验结果表明VEGF与 HIF-1α mRNA表达呈正相关,证明了卵巢癌细胞中的缺氧条件可使VEGF表达增强,从而影响组织中血管的生成及红细胞能量代谢,卵巢癌细胞更好的适应缺氧状态,而YC-1能够抑制卵巢癌细胞中HIF-1α的表达,进而降低VEGF的表达,抑制血管生成,降低肿瘤的侵袭力。
本实验结果表明,YC-1在体外实验中可以有效改善卵巢癌细胞中的缺氧状况,抑制新生血管的生成,提高卵巢癌细胞对顺铂化疗的敏感性,为未来卵巢癌临床药物治疗多样化提供一定的实验基础。
[1] 孙燕,石远凯.临床肿瘤内科手册[M].5版.北京:人民卫生出版社,2007:582.
[2]SEMENZA G L.Hypoxia-inducible factors:mediators of cancer progression and targets for cancer therapy[J].Trends Pharmacol Sci,2012,33(4):207-214.
[3] CHUN Y S,YEOE J,PARK J W.Versatile pharmacological actions of YC-l:anti-platelet to anticancer[J].Cancer LETT,2004,207(1):1-7.
[4] BRISTOW R G,HILL R P.Hypoxia and metabolism.hyp-oxia,DNA repair and genetic instability[J].NAT REV Cancer,2008,8(3):180-192.
[5] SEMENZA G L.Defining the role of hypoxia-inducible fac-tor 1 in cancer biology and therapeutics[J].Oncogene,2010,29(5):625-634.
[6] DENNINGER J W,SCHELVIS J P,BRANDISH P E,et al.Interaction of soluble guanylate cyclase with YC-I:kinetic and resonance raman studies[J].Biochemistry,2000,39(14):4191-4198.
[7] KO F N,WU C C,KUO S C,et al.YC-l,a novel activator of platelet guanylate cyclase[J].Blood,1994,84(12):4226-4233.
[8] CHUN Y S,YEO E J,CHOI E,et al.Inhibitory effect of YC-1 on the hypoxic induction of erythropoietin and vascular endothelial growth factor in HeP3B cells[J].Biochem Pharmacol,2001,61(8):947-954.
[9] YEO E J,CHUN Y S,CHO Y S,et al.YC-l:a potential anticancer drug targeting hypoxia-inducible factor 1[J].J NATL Cancer INST,2003,95(7):516-525.
[10] 李东华,陈孝平,张万广,等.应用组织芯片技术研究卵巢癌组织中缺氧诱导因子1A与血管生成的关系[J].中华妇产科杂志,2005,40(1):38-40.
[11] CHI K L, ZHEN F Y, SHUK P L,et al.Inhibition of Stat3 activity by YC-1 enhances chemo-sensitivity in hepatocellular carcinoma[J].Cancer Biol Ther,2007,12(6):1900-1907.
[12] 魏金花,张广美,贾坤,等.缺氧诱导因子-1α和肺耐药相关蛋白在卵巢癌耐药中的作用[J].中国实用妇科与产科杂志,2012,28(5):398-400.
[13] CZRROLL C E, LIANG Y, BENAKANAKERE I, et al.The anticancer agent YC-1 suppresses progestin-stimulated VEGF in breast cancer cells and arrests breast tumor development[J].Int J Oncol,2013,42(1):179-187.
DOI 10.3870/yydb.2015.07.006
InvitroReguation of YC-1 on the Chemotherapy Sensitivity of Ovarian Cancer
HUANG Jinling,HONG Li,HONG Shasha,MIN Jie,HU Ming,ZHAO Yang,YANG Qing
(DepartmentofGynecologyandObstetrics,RenminHospitalofWuhanUniversity,Wuhan430060,China)
Objective To investigate the contribution of hypoxia-inducible factor inhibitor YC-1 to cisplatin chemo-sensitivity to human ovarian cancer cells A2780sinvitro. Methods Ovarian cancer cells were divided into four groups which were treated with saline, YC-1, cisplatin, and YC-1 + cisplatin, separately, mRNA of HIF-1α and VEGF in the A2780s cells were detected by real-time fluorescence quantitative PCR by calculating 2-△△CT;the protein were detected by Western blot, to evaluate the change of hypoxia and angiogenesis capabilities under the ovarian cancer microenvironment. Results Compared with the control group, mRNA and protein of HIF-1α and VEGF expressed less in the group of YC-1, cisplatin and YC-1+cisplatin;while, those in the group of YC-1 + cisplatin were lower than the monotherapy (P<0.05), but no significant difference was detected between the YC-1 and cisplatin groups, and the expression of HIF-1 α and VEGF mRNA were positively related(r=0.830 5)in each group. Conclusion YC-1 exerts the antitumor effect and may contribute to sensitivity to cisplatin in the therapy of ovarian cancer.
1-Benzyl-3-(5-hydroxymethylfur-2-yl)indazole;Hypoxia-inducible factor;Cancer, ovarian;Cisplatin;Chemo-resistance
2014-06-25
2014-07-22
*湖北省自然科学基金资助项目(2010CDB06903)
黄金玲(1983-),女,吉林吉林人,主治医师,在读博士,研究方向:妇科肿瘤。电话:027-88041911-82128,E-mail:sherryjinling@foxmail.com。
洪莉(1970-),女,湖北武汉人,主任医师,博士,研究方向:妇科肿瘤和盆底功能障碍性疾病。E-mail:drhongli1011@yeah.net。
R737.31;R965
A
1004-0781(2015)07-0871-05

